经门静脉途径灌注化疗时5-Fu在肝脏和血液中的浓度和药动学特点
郑惊雷,梁力建,王在国,黄文静,王雪丁
肝癌易早期侵犯门静脉分支并经门静脉转移,目前经门静脉灌注区域化疗常作为临床上合并门静脉癌栓的肝癌患者术后防治肿瘤复发的重要措施[1-2]。为从药动学角度了解门静脉灌注化疗的数据,本文通过大鼠门静脉和颈静脉注射5-Fu后,观察血浆及肝脏组织中药物浓度变化过程,比较分别经门静脉和外周静脉(颈静脉)化疗的药动学差异,探讨5-Fu在血浆和肝脏组织中的动态变化规律,从而评估区域性门静脉灌注化疗对肝脏恶性肿瘤化学治疗的优势。
1 材料和方法
1.1 仪器、试药与实验动物
(1)仪器:Waters高效液相色谱系统包括Waters 486紫外检测器,Waters 510泵,SCL进样器,三锐色谱工作站(美国Waters);XW-80A旋涡混合器(上海医科大学仪器厂);飞鸽TGL-16C台式高速离心机(上海安亭科学仪器厂);微量采样器(上海求精生化试剂厂);0.45 μm微孔滤膜(天津腾达过滤器件厂)。(2)试药:5-氟尿嘧啶(5-Fu),南通精华制药有限公司生产,批号:070402,规格10 ml: 0.25 g。5-Fu对照品:南通精华制药有限公司提供,批号02005098。磷酸二氢钾、磷酸氢二钾及磷酸均为色谱纯,水为双蒸水。(3)实验动物:SPF级Wistar大鼠24只,体重(400±50)g,雌雄兼用,由中山大学动物实验中心提供。
1.2 方法
1.2.1 血液和肝脏组织标本采集方法 24只大鼠随机分为A1、A2、B1、B2四小组,每组6只,其中A1、A2组经外周静脉注射给药;B1、B2组经回结肠静脉插管至门静脉后灌注给药。实验大鼠禁食12 h后,用10%水合氯醛腹腔注射麻醉后经相应途径注射5-Fu,剂量为20 mg/kg。A1、B1两组分别在外周静脉、门静脉灌注给药后采集血液样本;A2、B2组分别在外周静脉、门静脉灌注给药后采集肝脏样本。标本采集时间:A1、B1两组大鼠分别于5-Fu注射完毕后5、10、20、30、45、60、90、120、180 min经鼠尾静脉取血约0.5 ml置于已肝素化的聚乙烯塑料管,2 500r/min离心20 min取血浆,-20 ℃低温保存;A2、B2两组大鼠于5-Fu注射完毕后5、10、30、45、60 min分别在肝叶外缘楔形钳夹切取肝组织约1 g,匀浆后置于-20 ℃低温保存,备用。
1.2.2 标本处理和药物浓度测定 取血浆和肝脏匀浆样本室温下解冻后,精密加入流动相至2 ml,旋涡振荡,5 000 r/min离心10 min,取上清液经微孔滤膜过滤后注入进样阀进行测定。根据色谱工作站软件自动积分记录色谱峰并计算峰面积,色谱条件同参考文献[3]。制作标准曲线:取大鼠空白血浆2.0 ml, 加入不同浓度的5-Fu系列标准溶液,运用同一液相抽提法抽提后进样测定,结果以药物浓度(C)对色谱峰面积(S)进行线性回归,得标准曲线回归方程S=0.5691C-0.473(r=0.999 8)。以上述方法测定大鼠血液和肝脏组织标本中5-Fu的色谱峰面积,计算药物浓度。
2 结果
2.1 门静脉和外周静脉两组注射5-Fu后在血浆和肝脏中的药物浓度
具体数据见表1,通过门静脉和外周静脉分别注射5-Fu后,药物在血浆和肝脏组织中的浓度呈规律性变化,其在肝脏中的药物浓度变化和血药浓度变化均可用数学模型来描述。门静脉注射5-Fu后血浆药物浓度变化过程符合药代动力学二室模型;外周静脉注射5-Fu后血浆和肝脏组织中药物浓度变化,以及门静脉注射后药物肝脏中浓度分布变化过程均符合药代动力学一室模型。
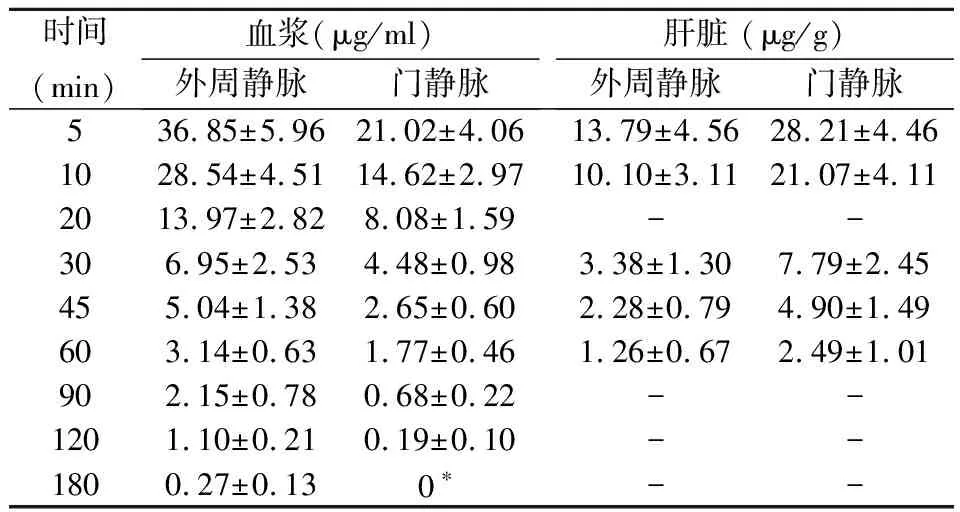
表1 不同途径注射5-Fu后大鼠血浆和肝脏组织的药物浓度(n=6)
2.2 门静脉和外周静脉两组注射5-Fu后的药代动力学参数
具体数据见表2,由表2可知,通过门静脉和外周静脉分别注射5-Fu后,两组药代动力学参数有所不同。经外周静脉注射5-Fu时,肝脏组织中的药物峰浓度(Cmax)和药物时量曲线下面积(AUC)均明显低于经门静脉灌注;而血浆中的Cmax和AUC则前者高于后者。
2.3 门静脉和外周静脉注射5-Fu穿透比率和穿透指数的比较
经1.2.3项下的公式计算穿透比率、穿透指数及治疗优势度。通过门静脉灌注5-Fu后,药物在肝脏和血浆中的PR为1.34;外周静脉灌注5-Fu后,药物在肝脏和血浆中的PR为0.37。经两种不同给药途径注射化疗时,门静脉区域灌注组的穿透指数较大(1.38);而外周静脉注射组的穿透指数仅为0.41。门静脉灌注化疗与外周静脉注射相比的治疗优势度为3.37。
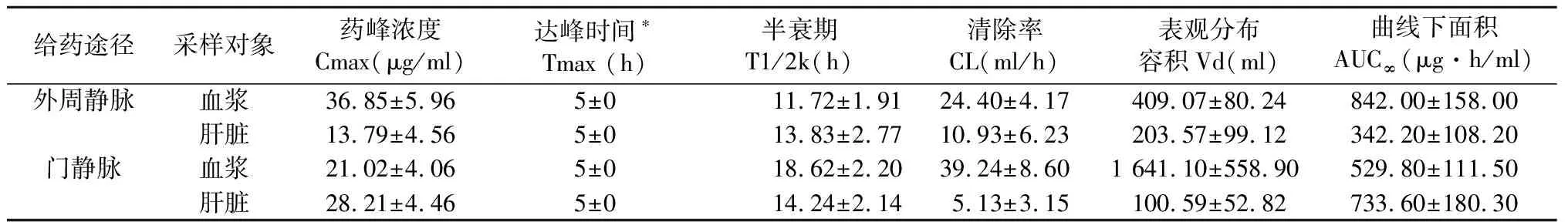
表2 不同途径注射5-Fu后大鼠血浆和肝脏药动学参数(n=6)
3 讨论
药动学是指导临床针对性有效用药治疗的重要依据[4]。抗癌药物在肿瘤部位和靶组织器官的浓度分布和药代动力学行为,对化疗效果有重要影响。癌灶或靶组织器官药物浓度越高其药物作用相对越强;而非肿瘤部位的其他组织器官及外周血的药物浓度越低,化疗药物产生的毒副作用相对越小[5]。肝癌全身化疗效果不理想,有效率不超过20%。区域性灌注化疗是目前肝癌常采用的化疗方法,用于肝癌术后预防复发和不能切除的晚期肝癌的治疗,目的是通过局部给药提高药物在癌灶和靶组织器官中的浓度,同时也可减少药物在外周血和全身其他部位的分布[6-7]。
虽然目前肝癌以手术治疗为主要手段,但即使行肝癌根治性切除,余肝内仍有可能残留目视及影像学不能发现的小癌灶。手术中对肿瘤的挤压也会导致肿瘤细胞进入门静脉或癌栓脱落而发生转移。此外,门静脉癌栓也是影响肝癌预后的主要因素之一,所以门静脉化疗对预防肝癌复发及门静脉转移有重要临床价值。肝癌由肝动脉和门静脉双重供血,尽管以肝动脉供血为主,目前研究表明肝癌的血管并不与肝动脉直接沟通,而是与瘤体的末梢门静脉和肝窦相通,故即使通过肝动脉灌注,化疗药物也是经这些吻合支先到门静脉再进入肿瘤组织的[8]。门静脉灌注化疗时,药物首先进入了肝脏组织和肝内病灶,然后再进入体内系统循环,分布到其他组织中去;而外周静脉注射化疗后,药物首先经过系统循环,分布至全身,其中一部分进入肝脏,故门静脉灌注和外周静脉注射化疗药物后,药物经历了不同的过程。本实验结果显示:这一过程的不同带来了相应的药代动力学差异,但药物在血浆和肝脏中不断代谢、消除的变化趋势均是一致的。经门静脉或外周静脉注药后,大鼠肝脏及血浆中药物浓度均呈规律性改变,药物浓度在血浆分布相中快速降低的同时,肝脏组织中药物浓度也是同步快速下降的,这可能是由于化疗药物在体内肝肾等器官中不断代谢、消除的同时,药物在体内是不断减少的。
5-Fu在现有化疗药物中是对肝癌敏感性较好的药物,且毒副作用小、价格便宜,目前仍是肝癌化疗的最常用药物[9-10]。本实验研究结果显示:药物在血浆和肝脏组织中的分布速度,门静脉和外周静脉注射两组间差异无显著性,血浆和肝脏中的浓度均在注射后5 min时已达峰值。门静脉灌注5-Fu后,药物在肝脏和血浆中的PR为1.34;外周静脉灌注5-Fu后,药物在肝脏和血浆中的PR为0.37。经门静脉区域灌注化疗与外周静脉注射比较,肝脏组织药物浓度有显著提高,药峰浓度比达2倍以上,而外周血药浓度则显著降低,前者约为后者的2/3。此外,通过门静脉区域灌注等量化疗药物与外周静脉注射相比,前者的外周血药物代谢消除速度更快,给药后3小时血浆中已未能检测到药物。
从本研究的结果还可以看出,通过两种不同的给药途径,门静脉灌注化疗的肝脏组织药物时量曲线AUC较外周静脉注射有显著提高,而血浆中药物时量曲线AUC较后者明显降低。以上药动学指标的测定结果说明采用门静脉灌注区域化疗可显著提高肝脏内药物浓度及作用时间,同时有效减少药物在外周血中不必要的分布。门静脉区域灌注和外周静脉注射5-Fu的肝-血穿透指数(PI)分别为1.38和0.41。与外周静脉注射相比较,门静脉灌注5-Fu化疗的治疗优势度(Rd)为3.37,提示区域性门静脉灌注化疗整体上明显优于经外周静脉注射化疗。
综上所述,区域性门静脉灌注化疗可提高肝脏药物时-量作用强度,同时有效降低化疗药物在外周血中的分布,与经外周静脉注射化疗相比较具有显著的药动学优势。
参考文献:
[1] Matono R,Yoshiya S,Motomura T,et al.Factors linked to longterm survival of patients with hepatocellular carcinoma accompanied by tumour thrombus in the majorportal vein after surgical resection[J].HPB (Oxford),2012,14(4):247-253.
[2] Liu S,Guo W,Shi J,et al.MicroRNA-135a contributes to the development of portal vein tumor thrombus by promoting metastasis in hepatocellular carcinoma[J].J Hepatol,2012,56(2):389-396.
[3] Gu Y,Lu R,Si DY,et al.Determination of 5-fluorouracil in human plasma by high-performance liquid chromatography (HPLC)[J].Transactions of Tianjin University,2010,16(3):167-173.
[4] Gomolin IH,Smith C,Jeitner TM.Cholinesterase inhibitors: applying pharmacokinetics to clinical decision making[J].Am J Geriatr Pharmacother, 2011,9(4):259-263.
[5] 肖亮,宫爱申,别平彦,等.酪氨酸激酶抑制药SHR115723的药效学及药动学[J].中国新药与临床杂志,2008,27(8):561-567.
[6] Ikeda M,Okusaka T,Furuse J,et al.A multi-institutional phase Ⅱ trial of hepatic arterial infusion chemotherapy with cisplatin for advanced hepatocellular carcinoma with portal vein tumor thrombosis[J].Cancer Chemother Pharmacol,2013,72(2):463-470.
[7] Park MS,Kim SU,Park JY,et al.Combination treatment of localized concurrent chemoradiation therapy and transarterial chemoembolization in locally advanced hepatocellular carcinoma with intrahepatic metastasis[J].Cancer Chemother Pharmacol,2013,71(1):165-173.
[8] Kirchhoff TD,Bleck JS,Dettmer A,et al.Transarterial chemoembolization using degradable starch microspheres and iodized oil in the treatment of advanced hepatocellular carcinoma: evaluation of tumor response, toxicity, and survival[J].Hepatobiliary Pancreat Dis Int,2007,6(3):259-266.
[9] 杨富春,郑树森,李敏伟,等.环孢素A与他克莫司对5-氟尿嘧啶治疗肝癌的影响及机制[J].中华外科杂志,2003,41(6):449-454.
[10] Nagano H,Kobayashi S,Marubashi S,et al.Combined IFN-α and 5-Fu treatment as a postoperative adjuvant following surgery for hepatocellular carcinoma with portal venous tumor thrombus[J].Exp Ther Med,2013,5(1):3-10.

