趋化因子受体CCR5在胃癌患者外周血调节性T细胞上的表达及其临床意义
吴德南,庄建良,许荣誉,苏子剑,何荣琦
人类机体肿瘤的发生发展与患者的免疫功能状态密切相关,免疫功能降低是肿瘤发展及转移最关键的内因。Tregs细胞是具有一类特殊表型和抑制功能的T淋巴细胞亚群,可通过多种方式抗肿瘤免疫反应,在肿瘤免疫逃逸中起着重要作用。肿瘤可以通过多种途径来引导Tregs细胞在肿瘤局部的聚集和维持,其中最重要的一种方式为肿瘤细胞表面高表达趋化因子。特别是CCL5-CCR5轴在参与及调节免疫细胞向外浸润或转移,促进肿瘤免疫逃逸等方面在近几年引起广泛研究。Azenshtein等[1]研究发现乳腺癌细胞可以表达和分泌趋化因子CCL5及受体CCR5,两者相互作用趋化淋巴细胞向肿瘤部位移动,促进疾病发展,并且CCR5表达阳性细胞有明显向淋巴结转移趋势,这可能与淋巴结内存在CCL5有关。本研究将初步探讨CCR5在胃癌外周血Tregs细胞上的表达水平及其临床意义。
1 资料与方法
1.1 试剂和仪器 FACSsort型流式细胞仪、GS-15型离心机:美国BECKMAN公司生产。WH-2型微型旋涡混合仪:上海沪西分析仪器厂生产。可调式微量移液器:德国Eppendrof公司。鼠抗人CD4-ECD及CD25-PC5均购自美国 BECKMAN COULTER MUNOTECH公司。CCR5单克隆抗体:美国R&D公司。CD127单克隆抗体:美国 eBioscience公司。Falcon管及溶血素均购自美国BD公司。人淋巴细胞分离液:北京索莱宝科技有限公司。
1.2 标本来源及分组 收集2013年1月至2014年2月于福建医科大学附属泉州第一医院肿瘤外科住院且经术后病理证实为胃癌的患者49例,均为初治病例,术前均未接受放射治疗、化学治疗、免疫治疗及靶向治疗。其中男33例,女16例,年龄为40~80岁,中位年龄61岁,年龄<55岁11例,≥55岁38例。胃癌TMN分期标准采用2010年国际抗癌联盟/美国癌症联合委员会(UICC、AJCC) 的分期标准,其中Ⅰ期患者10例,Ⅱ期患者15例,Ⅲ期患者24例。镜下病理组织分化程度分组:低分化26例,中高分化23例。49例中有淋巴结转移者37例。肿瘤直径:直径<5 cm 24例,直径≥5 cm 25例。另外同期选取我院体检中心正常体检者20例作为健康对照组,经电子胃镜取材并经病理证实无胃部疾病,其中男13例,女7例,年龄43~77岁,中位年龄60岁,年龄<55岁7例,≥55岁13例。胃癌组和对照组在性别、年龄等方面比较,差异均无统计学意义。所有对象均无自身免疫性疾病、免疫缺陷疾病、器官移植或其他部位肿瘤;且近4个月未使用过免疫增强和(或)抑制性药物。
1.3 研究方法及操作步骤 (1) 标本血采集:收集胃癌患者术前以及健康对照组外周血2 ml于EDTA抗凝管中,充分混匀。(2)利用Ficoll密度梯度离心法分离人外周单个核细胞(PBMC):往抗凝管中加入的PBS缓冲液等体积(1∶1)稀释血液。取淋巴细胞分层液1.5 ml,放入15 ml的离心管,用吸管吸取稀释血液3 ml,沿试管壁加入,使稀释血液量叠于分层液上,保持两者界面清晰。然后以1 800 r/min离心10 min,离心后其中的内容物分为4层,用毛细吸管轻轻插入白膜层,沿试管壁周缘吸取界面层单个核细胞,移入另一离心管中。加入5 ml的PBS缓冲液,混匀,以2 800 r/min离心5 min两次,吸弃上清,重悬细胞。(3)加入抗体:吸取25 μl细胞悬液在Falcon管,向管中加入10 μl CCR5-FITC、10 μl CD25-PC5、20 μl CD127-PE和10 μl CD4-ECD标记的抗体,充分混匀后,低温避光孵育45 min。同时设同型阴性对照管,只加入50 μl细胞悬液。(4) 加入溶血素,室温避光8 min。(5)2 800 r/min离心5 min两次,弃上清。(6) 加入300 μl PBS缓冲液,检测。(7) 流式细胞仪检测结果:设立同型阴性对照,设立淋巴细胞门,检测淋巴细胞数量和Tregs细胞上CCR5的表达水平。
1.4 检测及数据采集 利用流式细胞仪检测每一例胃癌患者及健康对照组的外周血,检测CCR5在外周血Tregs细胞上表达水平。数据采用SPSS19.0统计软件处理。统计学方法:t检验、方差分析、多元线性回归分析及秩相关分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 CCR5在胃癌患者组与健康对照组外周血Treg细胞上表达水平的比较 胃癌患者组与健康对照组的比较检测采用t检验,结果t=7.5,P<0.01;差异有显著统计学意义,可以认为胃癌患者组外周血Tregs细胞上CCR5表达水平比健康对照组高。说明CCR5在外周血Tregs细胞上的表达与胃癌的存在状态有关。详见表1。
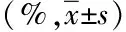
表1 胃癌患者组与健康对照组CCR5表达水平比较结果
2.2 CCR5在外周血Tregs细胞的表达水平与胃癌相关参数的关系 胃癌患者外周血中Tregs细胞上CCR5的表达水平在TNM 分期、分化程度及淋巴转移组内比较差异有统计学意义(P<0.01) ,而在性别、年龄及肿瘤大小参数中无统计学意义,结果详见表2。
2.3 CCR5在外周血Tregs细胞的表达水平与胃癌病理学参数的相关性分析 先将CCR5在胃癌患者外周血Treg细胞表达水平结果与患者的性别、年龄、肿瘤分化程度、肿瘤大小、淋巴结转移和病理分期(TNM分期)进行多元线性回归分析,结果仅有病理分期及淋巴结转移两项进入方程。结果详见表3。表3表明 CCR5在胃癌患者外周血Treg细胞的表达水平与性别、年龄、分化程度、肿瘤大小无统计学意义的线性关系,与病理分期(B=0.331,P=0.005)及淋巴结转移(B=0.783,P=0.000)呈线性关系,有显著统计学意义。提示CCR5在胃癌患者外周血Treg细胞的表达水平受胃癌的病理分期和淋巴结转移影响显著。此外,对CCR5的表达程度与性别、年龄、分化程度、淋巴结转移和病理分期分别进行两个变量的秩相关分析,结果详见表4。从4表中可知,CCR5在外周血Treg细胞的表达水平与TNM分期及淋巴结转移关系密切,均呈正直线相关关系,与性别、肿瘤大小及年龄均无直线相关关系。与肿瘤分化程度秩相关虽然有统计学意义,但其r<0.5,提示其与CCR5表达水平关系不密切。

表2 CCR5表达水平与胃癌相关参数的关系
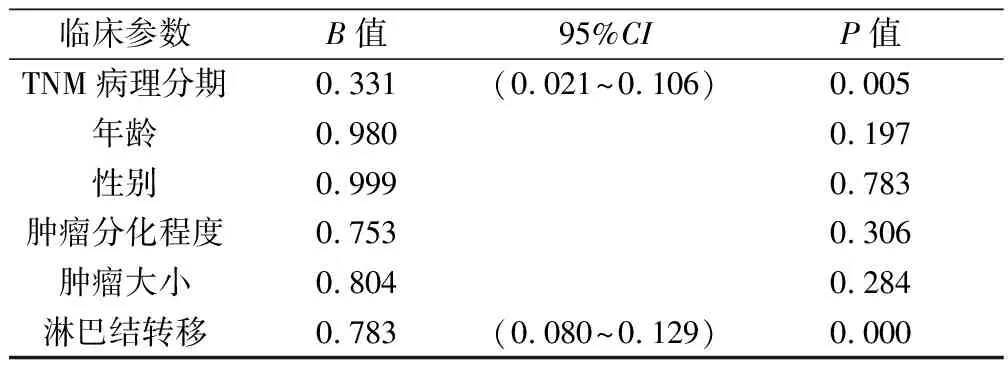
表3 CCR5表达与胃癌病理学参数的多元线性回归分析结果
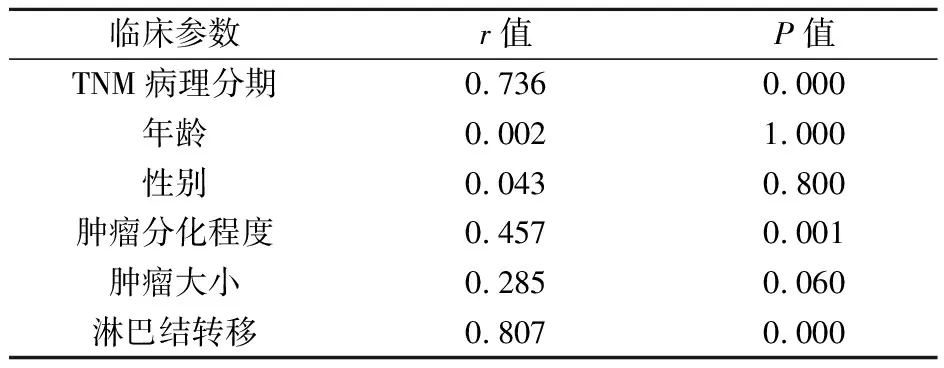
表4 CCR5表达与胃癌病理学参数的秩相关分析结果
3 讨论
CD4+CD25+CD127-调节性T细胞通过抑制自身的免疫抗原和抑制过度的免疫应答以维持机体免疫平衡方面起着关键性的作用。Tregs细胞比例升高会导致肿瘤免疫失调,可能参与肿瘤的发生、进展和转移。在近几年的研究发现,趋化因子及其受体在Tregs细胞发挥免疫功能的过程中发挥重要作用[2]。趋化因子受体是一类表达于不同类型细胞上的G蛋白耦联受体,含有7个跨膜区,通常表达于免疫细胞、内皮细胞的细胞膜上。趋化因子与其受体的相互作用控制着各种免疫细胞在循环系统和组织器官间定向迁移[3]。CCR5在CD4+ T细胞、NK细胞、单核细胞、未成熟的DC等多种淋巴细胞上均有表达,参与不同的免疫反应[4]。关于外周血Tregs上CCR5的表达和胃癌的关系,目前临床研究较少。
在肿瘤免疫领域中,CCL5/CCR5信号轴途径与Tregs如何相互介导、作用及作用方式近年来得到广泛研究。CCL5/CCR5 信号轴可能通过对Tregs细胞的趋化,引起肿瘤组织及其引流区域的富集及维持来影响机体局部或整体的免疫功能,进而促进机体肿瘤的发生及进展。Tan等[5]研究发现胰腺癌患者的外周血、肿瘤组织、肿瘤引流淋巴结中,Tregs 细胞数量较健康对照组多,Tregs 细胞表面表达的 CCR5 也较正常组织多,且胰腺癌组织中 CCR5 的配体 CCL3、CCL4、CCL5 的表达均增多,CCL5 与 CCR5 相互识别,趋化 Treg 细胞进入肿瘤组织发挥作用,为证明CCL5/CCR5 信号轴的存在,该课题组又利用CCR5拮抗剂阻断实验鼠中CCL5 / CCR5 信号轴后发现募集到肿瘤组织的Tregs细胞减少,减弱Tregs细胞的抗肿瘤免疫作用,肿瘤生长受影响。这为肿瘤的分子靶向治疗提供了研究方向。结合本试验结果,CCR5在胃癌外周血Tregs细胞上的高表达,表明CCR5可能参与了肿瘤免疫过程,加速肿瘤进展及介导转移,但是否可以通过阻断它们的相互作用来治疗胃癌,CCL5/CCR5信号轴与Tregs细胞在肿瘤免疫中有何种作用,仍需做进一步研究。
本实验利用流式细胞仪检测49例胃癌患者外周血Tregs细胞上CCR5的表达程度,与健康对照比较,并分析CCR5的表达与胃癌的病理分期(TNM分期)、肿瘤分化程度、肿瘤大小和淋巴结转移的相关性,初步探讨CCR5与Tregs在胃癌的发生、发展及浸润转移过程中的作用。对实验结果初步分析得出以下结论:(1)CCR5在胃癌患者外周血Tregs细胞上高度表达,跟健康对照组有显著统计学差异,推测其参与了胃癌的发生过程;(2)CCR5的表达程度与胃癌的病理分期及淋巴结转移程度呈正相关,表现为其表达越高,提示肿瘤分期越晚,淋巴结转移越广泛,我们也可以推测Tregs细胞上CCR5的表达参与了胃癌浸润和淋巴结转移过程。说明CCR5与外周血Tregs细胞相互介导可能参与机体的肿瘤免疫,在胃癌的发生、发展及侵袭转移中可能起重要作用。由于本试验病例选择的限制,未对末期胃癌进行研究,未得出他们与胃癌的远处转移有关的结果,这一问题还需要进一步的实验,从而得出更完善、有说服力的结果。
参考文献:
[1] Azenshtein E,Luboshits G,Shina S,et al.The CC chemokine RANTES in breast carcinoma progression:regulmion of expression and potential mechanisms of promalignant activity[J].Cancer Res,2002,62(4):1093-1102.
[2] Schaller MA,Kallal LE,Lukacs NW.A key role for CC chemokine receptor 1 in T-cell-mediated respiratory inflammation[J].Am J Pathol,2008,172(2):386-394.
[3] Alain PV,Smina AY,Karine C,et al.Antitumor effects of the mouse chemokine 6Ckine/SLC through angiostatic and immunological mechanism[J].Immunol,2000,165(4):1992-2000.
[4] González-Martín A,Gómez L,Lustgarten J,et al.Maximal Tcell-mediated antitumor responses rely upon CCR5 expression in both CD4 + and CD8 + T cells[J].Cancer Res,2011,71(16):5455-5466.
[5] Tan MC,Goedegebuure PS,Belt BA,et al.Disruption of CCR5-dependent homing of regulatory T cells inhibits tumor growth in murine model of pancreatic[J].J Immunol,2009,182(3):1746-1755.

