外源激素对黄瓜抗病特性的影响
冯宗琪,刘福军,秦艳艳,王瑞刚
(1.内蒙古农业大学生命科学学院,内蒙古呼和浩特010018;2.内蒙古赤峰市松山区安庆沟林场,内蒙古赤峰024000)
0 引言
作为新型植物激素,外源水杨酸(SA)可诱导植物产生对真菌、细菌和病毒的抗性,同时,SA也能诱导植物产生对重金属、臭氧、紫外辐射、低温、热激、水分亏缺和盐害等非生物胁迫的抗(耐)性[1]。这说明SA在诱导植物交叉保护反应中具有重要作用。脱落酸(ABA)是一种重要的植物激素,在植物抗胁迫过程中起着重要的作用。已有的研究表明:ABA是植物交叉适应过程的关键性胁迫信号分子[2]。茉莉酸(JA)是一种植物生长调节物质,它影响植物的生长和发育,还能够启动植物抗病防御基因的表达,调控植物的一系列防御反应。而JA与ABA在功能上存在共同之处,且已有证据表明JA参与了诱导植物抗病性增强[3-6]。本文比较研究了SA、ABA和JA对黄瓜苗抗病性的作用,探讨了SA、ABA和JA在参与植物抗生物和非生物胁迫中的作用及其在植物诱导植物抗病性增强中的关系,为植物抗生物和非生物胁迫机理研究提供参考。
1 材料与方法
1.1 植物材料培养
黄瓜(Cucum is sativus L.)品种为对炭疽病敏感的‘津杂2号’和对白粉病敏感的‘长春密刺’。种子在55℃温水中浸泡30 m in,清水冲洗3次,于28℃光照培养箱中催芽1 d后,播于培养钵中,营养土中有机肥和壤土的体积比为1∶3,高温灭菌后,自然条件下栽培管理。
1.2 病原菌培养
炭疽病原菌接种于PDA培养基上,至菌丝体生长旺盛,转至豆角培养基上25℃暗培养,约1周后即可产生棕红色的孢子。白粉菌活体培养。
1.3 外源处理试验
‘长春密刺’三叶一心幼苗,子叶和第一叶已感染白粉病,有小块病斑,傍晚叶面分别喷施0.05 mmol/L SA、JA和ABA,每隔1 d喷1次,共处理5次。每处理5株,每株处理3片叶片,对照组喷清水。自然条件下栽培管理。处理后10 d,统计每株病斑数目,病斑直径。
‘津杂2号’五叶一心幼苗,傍晚叶面分别喷施0.05 mmol/L SA、JA和ABA,每隔1 d喷1次,共处理5次后叶面喷施105炭疽菌孢子悬浮液,保湿24 h。每处理5株,对照组喷清水。自然条件下栽培管理。处理后10 d,统计每株病斑数目、病斑直径,每株处理3片叶片。
1.4 室内抑菌试验
在炭疽菌培养基上添加上述浓度试剂,每处理3次重复。培养基18 m L/皿。试剂过滤灭菌加入,2 m L/皿过滤灭菌液。培养基凝固后接种直径4 mm的炭疽菌丝圆片(带培养基),25℃暗培养。待对照菌落直径达3.0~3.5 cm时,测量所有处理和对照的菌落直径。
2 结果与分析
2.1 SA、ABA和JA控制白粉病的扩展
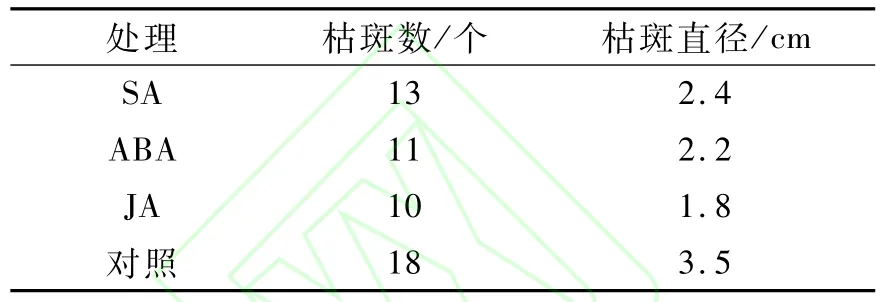
表1 外源SA、ABA和JA增强黄瓜叶片的抗白粉病特性
表1为外源SA、ABA和JA增强黄瓜叶片的抗白粉病特性,由表1可见:黄瓜幼苗分别经0.05 mmol/L SA、ABA和JA处理后,植株的病斑数目和病斑直径均较对照减少,其中,病斑数目依次降低了26.3%、42.5%和44.7%,病斑直径分别降低了31.4%、37.1%和48.6%。表明0.05 mmol/L外源SA、ABA和JA可以控制‘长春密刺’黄瓜白粉病的扩展。
2.2 SA、ABA和JA对减轻炭疽病发病率的影响

表2 外源SA、ABA和JA增强黄瓜叶片的抗炭疽病特性
表2为外源SA、ABA和JA增强黄瓜叶片的抗炭疽病特性。0.05 mmol/L SA、ABA和JA分别处理后,‘津杂2号’接种炭疽菌后发病时间延迟至4~5 d,而对照在3 d即开始出现病斑。接种10 d后,3种处理的病斑数目和病斑直径都比对照减少,其中,病斑数目依次降低了36.2%、 44.7%和22.7%,病斑直径分别降低了25.6%、48.7%和30.8%(见表2),即外源SA、ABA和JA处理可以减轻敏感品种‘津杂2号’黄瓜炭疽病的发生,但不能完全抑制其发病。
2.3 SA、ABA和JA的室内抑菌试验结果
表3为SA、ABA和MeJA对炭疽病菌生长的影响,从表3可见:10-4mol/L SA、ABA和JA加入培养基,接种炭疽菌后25℃培养12 h,处理组菌落直径为3.4 cm左右,对照组为3.5 cm左右,说明外源SA、ABA和JA本身对病原菌生长无明显影响。可见0.05 mmol/L SA、ABA和JA增强黄瓜对炭疽病的抗性并非由于其本身直接的抑菌作用,而是诱导了黄瓜自身的抗性增强。

表3 SA、ABA和Me JA对炭疽病菌生长的影响
3 讨论
前人的大量研究表明:外源SA可使多种双子叶植物和部分单子叶植物对细菌、真菌和病毒等病原物的抗性增强,并诱导PR基因表达[7]。例如,烟草和拟南芥经SA处理诱导表达的PR基因与TMV诱导的完全相同[8]。病原菌的侵染还可以诱发植物蛋白酶抑制剂(PIⅠ和Ⅱ)和植物营养贮藏蛋白(VSP)基因的表达和诱导植物抗毒素的合成,而外源JA或MeJA也有同样的效果;苯丙氨酸解氨酶(PAL)是SA和其他一些酚类化合物合成的关键酶,外源JA也能够促进大豆植株或悬浮培养细胞中PAL的合成及活性提高;并且,病原物诱导的植物防卫素和thionins基因也可以被外源茉莉酸类诱导表达[3]。如病原菌侵染能诱导大麦thionins的合成,从而对细菌和真菌产生毒害作用[4]。拟南芥遭到坏死型病原菌侵染或外施茉莉酸后,诱导植物防卫素基因PDF1.2和thionins基因Thi2.1在侵染点附近和整个植株中表达,而外施SA却不能诱导上述基因表达[5-6]。上述事实说明JA参与了诱导植物抗病性增强。
有关ABA与植物抗病性的研究报道较少。早期的研究表明:ABA明显减轻TMV引起的烟草和番茄的花叶症状[9],受TMV侵染的烟草内源ABA浓度升高[10],含Tm-1抗TMV基因的番茄品种内源ABA含量高于敏感品种[4];外源ABA增强敏感型菜豆(Phaseolus vulgaris)下胚轴对菜豆炭疽病菌(Colletotrichum lindemuthianum)的抗性,而ABA的生物合成抑制剂fluridone则导致抗性品种变得敏感,发病严重。ABA本身在处理浓度下对病原物生长无直接抑制作用[6]。进一步研究发现:ABA处理后的植物体内病程相关蛋白和植物抗毒素含量大大提高,并且苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(CA4H)、4-香豆酸CoA连接酶(4CL)和查尔酮合成酶(CSH)大量表达;并且ABA所诱导的基因(如:ABA17、ABA18等)产物与病程相关蛋白高度相似[11]。然而,对大豆与大豆疫霉(Phytophthora megasperma f.sp.Glycinea)互作的研究却发现侵染后ABA含量迅速下降[11];外源ABA处理马铃薯块茎切片抑制了其对真菌致病疫霉(Phytophthora infestans)和黄瓜黑心病(Cladosporium cucumerinum)的抗性和类萜植物抗毒素的积累[12]。这说明ABA对增强敏感品种的抗病性是有效的。
本文利用黄瓜苗得到的上述结果表明:外源SA、ABA和JA处理黄瓜后,分别不同程度地减轻了白粉病和炭疽病的发生。体外抑菌试验表明:试验所用浓度的上述激素对病原物无直接抑制作用,这说明上述激素处理后增强了黄瓜自身的抵抗能力。文献[13]发现:叶面喷施100 mg/L SA+10 mg/L ABA能显著增强豌豆(cv.VL Matar 1)对晚疫病菌Alternaria alternata.的抗性,表明SA与JA[14-15]和乙烯[16]以外的其他激素之间也可能存在某些协同或颉颃作用。有关ABA和JA与植物抗病性的关系以及SA和ABA或其他激素复配对植物抗病性的影响有待深入研究。
[1] 周燮.新发现的植物激素[M].南京:江苏科学技术出版社,2010.
[2] 张立军,刘新.植物生理学[M].北京:科学出版社,2011.
[3] Penninckx I A,Thomma B P,Buchala A,et al.Concomitant Activation of Jasmonate and Ethylene Response Pathways is Required for Induction of a Plant Defensin Gene in Arabidopsis[J].Plant Cell,1998,10:2103-2114.
[4] Kogel K H,Ortel B,Jarosch B,et al.Resistance in Barley Against the Powdery Mildew Fungus(Erysiphe graminis f.Sp.hordei)is not Associated with Enhanced Levels of Eendogenous Jasmonates[J].Eur JPlant Patho,1995,101:319-332.
[5] Penninckx I A,Eggermont K,Terras F R,et al.Pathogen-induced Systemic Activation of a Plant Defensin Gene in Arabidopsis Follows a Salicylic Acid-independent Pathway[J].Plant Cell,1996,8(12):2309-2323.
[6] Vignutelli A,Wasternack C,Apel K,et al.Systemic and Local Induction of an Arabidopsis Thionin Gene by Wounding and Pathogens[J].Plant J,1998,14(3):285-295.
[7] An C,Mou Z.Salicylic Acid and Its Function in Plant Immunity[J].Journal of Integrative Plant Biology,2011,53(6):412-428.
[8]Niki T,Mitsuhara I,Seo S,et al.Antagonistic Effect of Salicylic Acid and Jasmonic Acid on the Expression of Pathogenesisrelated(PR)Protein Genes in Wounded Mature Tobacco Leaves[J].Plant and Cell Physiology,1998,39(5):500-507.
[9] M iyuki K,M ichiko Y,Akiko K,et al.Suppressive Effect of Abscisic Acid on Systemic Acquired Resistance in Tobacco Plants[J].Journal of General Plant Pathology,2010,76(2):161-167.
[10]Whenham R J.Effect of Systemic and Local-lesion-forming Strains of Tobacco Mosaic Virus on Abscisic Acid Concentration in Tobacco Leaves:Consequences for the Control of Leaf Growth[J].Physiological Plant Pathology,1981,18(3):267-278.
[11] Cahill D N,Ward E W B.Rapid Localized Changes in Abscisic Acid Concentrations in Soybean in Interaction with Phytophthora megasperma f.sp.Glycinea or After Treatment with Elicitors[J].Physiol Mol Plant Path,1989,35(6):483-493.
[12] Henfling JW D M,Bostock R,Kug J.Effect of Abscisic Acid on Rishitin and Lubimin Accumulation and Resistance to Phytophthora infestans and Cladosporium cucumerinum in Potato Tuber Tissue Slices[J].Phytopathology,1980,70(11):1074-1078.
[13] Anita G,Pramod K,Bhatt J C,et al.Effect of Environmental Conditions,Salicylic Acid and Phytohormones on Pea Leaf Bblight[J].Indian Phytopathology,1999,52(3):270-273.
[14] Pamella M S,Hak S S,Jong T S.Salicylic Acid Signaling:Biosynthesis,Metabolism,and Crosstalk with Jasmonic Acid[J].Journal of the Korean Society for App lied Biological Chemistry,2011,54(4):501-506.
[15] Vaijayanti G,Willits M G,Glazebrook J,et al.Arabidopsis Thaliana EDS4 Contributes to Salicylic Acid(SA)-dependent Expression of Defense Responses:Evidence for Inhibition of Jasmonic Acid Signalling by SA[J].Molecular Plant M icrobe Interactions,2000,13:503-511.
[16] Greenberg J T,Silverman F P,Liang H.Uncoupling Salicylic Acid-dependent Cell Death and Defense-related Responses from Disease Resistance in the Arabidopsis Mutant Acd5[J].Genetics,2000,156(1):341-350.

