铜、水分胁迫下金属型植物海洲香薷水分代谢的变化
李民敬,余发新,丁建南,熊治廷
(1.江西省科学院生物资源研究所,江西 南昌330029;2.中国地质大学(武汉)环境学院,湖北 武汉430074; 3.武汉大学资源与环境学院,湖北 武汉430072)
0 前言
自然界有一类抗性植物,能生长在重金属严重污染的土壤(如矿脉露头和古矿遗址)而代代繁衍不息,被称为金属型植物[1]。在其原生土壤中,重金属(如Cu、Zn、Pb、Cd等)含量可达10 000 mg/kg或更高,是非污染土壤的100~1 000倍以上。依据生态分布特点,该类植物分为专性和兼性两类[1]。前者仅限于污染区;后者可分布于重金属污染区和非污染区,分别形成抗性和非抗性种群。
海洲香薷(Elsholtzia haichowensis Sun),唇型科一年生草本植物,俗称“铜草”或“铜花”,是铜矿区生长茂盛的优势种之一[2,3]。该植物对Cu有很好的蓄积和耐受性,是一种我国原生的金属型植物,可应用于铜污染土壤植物修复[3,4]。同时也是铜矿区的先锋植物,在铜矿区和其它铜污染区的植被恢复中具有重要作用。该植物在非污染区也有分布,但是并不常见,也不是优势种[4]。
金属型植物生长土壤大多土层薄,砂砾含量高,保水性和持水能力差,易造成重金属和干旱复合胁迫[5~7]。金属型植物在这种异常生境中能正常生长和繁殖,除对重金属有抗性外,对干旱可能也有较强的抵抗能力。但是目前金属型植物相关研究侧重于重金属蓄积性能及其抗性两个方面[8~10],在重金属、水分胁迫共同作用下其生理生化代谢的变化及其机理研究较少[6,7,11~13]。本项目选用污染区、非污染区海洲香薷为试材,以水培方法构成Cu、水分胁迫,研究植物蒸腾速率、水分利用效率、叶片相对含水量、根自然含水量的变化,揭示Cu、水分胁迫下污染区、非污染区金属型植物水分代谢的差异,为尾矿库复垦和矿山生态恢复提供科学依据。
1 材料和方法
1.1 植物材料的培养以及铜、PEG6000处理
污染区海洲香薷种子采自已有3000多年采矿历史的湖北大冶铜录山古铜矿遗址,土壤总铜含量6 303.6 mg/kg干土;非污染区海洲香薷种子采自湖北红安,土壤总铜含量51.6 mg/kg干土。
海洲香薷种子消毒、清洗后置于25℃、黑暗的条件下萌发。将刚萌发的幼苗温室自然光照下砂质培养,用1/2Hoagland营养液浇灌。待幼苗长出4对复叶时,转移至室内人工培养室内用1/ 2Hoagland营养液培养。培养室用钠灯和白炽灯提供光照,用空调调节温度使室温保持在25℃左右。水培恢复培养一周后加入氯化铜、PEG6000,分别形成Cu0.16 μM(Control)、Cu20 μM、5%(w/v) PEG6000(模拟水分胁迫)、Cu20 μM+5%PEG6000 (Cu+水分胁迫)处理,每个处理3个重复。每3 d更换一次营养液并重新染毒。
1.2 蒸腾速率和叶片水分利用效率的测定
按照LI-6400便携式光合仪的测定步骤,测定海洲香薷成熟叶片的蒸腾速率和净光合速率等。其中测定过程:植物幼苗在固定光源(高压钠灯)下进行,Tair 33.40~38.08℃,Tleaf 32.39~38.33℃,Tblock 33.21~37.97℃,CO2R 430.71~483.35 μmolCO2mol-1,H2OR 14.555~14.854 mmol H2Omol-1,RH_R%21.84~28.66,Flow499.2~501.1 μmol s-1,ParIn721~830 μmol m-2s-1,Press 100.8~100.9 kPa。如果叶片没有完全充满叶室,那么需用叶面积扫描仪(LC-2400P)扫描叶片,然后手动输入叶面积至光合仪软件重新计算相关参数。根据所获数据计算叶片水分利用效率。
叶片水分利用效率=净光合速率/蒸腾速率
1.3 叶片相对含水量和根自然含水量
取下植物叶片,电子天平(0.1 mg)称鲜重,然后浸入去离子水中,浸泡6 h;把叶片取出并吸干上面的水分,称饱和鲜重;然后在60℃的烘箱中烘48 h,称干重。此外,同时称量根的鲜重和干重。叶片的相对含水量和根的自然含水量采用下列公式:
叶片相对含水量=100×(叶片鲜重-叶片干重)/(叶片饱和鲜重-叶片干重)
根自然含水量=100×(根鲜重-根干重)/根鲜重
1.4 统计分析
实验结果均为平均值±标准偏差(n=3)。实验结果用SPSS10.0统计软件进行统计分析。运用多因素统计分析(Multi-way ANOVA)检验CS/NCS、Cu和水分胁迫的显著性差异。假如F值有显著性差异(P<0.05),那么对测定指标进行多重比较。多重比较采用Duncan新复极差法。图表中不同字母代表达到显著性差异(P<0.05)。
2 实验结果
2.1 蒸腾速率
图1表明,在对照下NCS蒸腾速率明显高于CS,说明NCS对水分的需求更为旺盛。20 μMCu处理下,分别与其对照相比,NCS的Tr下降了79.0%,CS的Tr上升了22.9%,并且均达到显著性差异,此外CS的Tr明显高于NCS;说明Cu明显抑制了NCS的蒸腾作用,但是对CS蒸腾作用有刺激作用。在水分胁迫以及Cu+水分胁迫下,CS和NCS的Tr均明显下降,且两者之间没有显著差异,但是下降的幅度不同。在水分胁迫下,分别与其对照相比,NCS的Tr下降了47.5%,CS的Tr下降了34.0%。在Cu+水分胁迫下,NCS的Tr下降了76.6%,CS的Tr下降了48.2%。
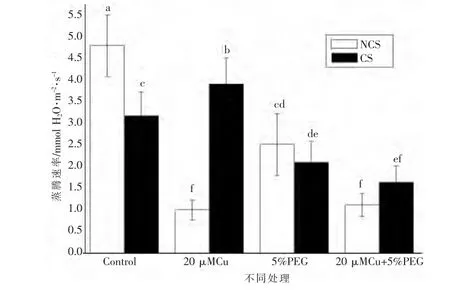
图1 铜、水分胁迫下铜污染和非污染海洲香薷蒸腾速率的差异
2.2 叶片水分利用效率
图2表明,与对照相比,NCS在Cu、水分胁迫以及Cu+水分胁迫下的叶片水分利用效率均明显增加,而CS仅在水分胁迫下的WUE明显增加,在Cu以及Cu+水分胁迫下无明显变化。此外,在Cu以及Cu+水分胁迫下,NCS的WUE显著高于CS,在其它处理下两者之间WUE没有明显差异。
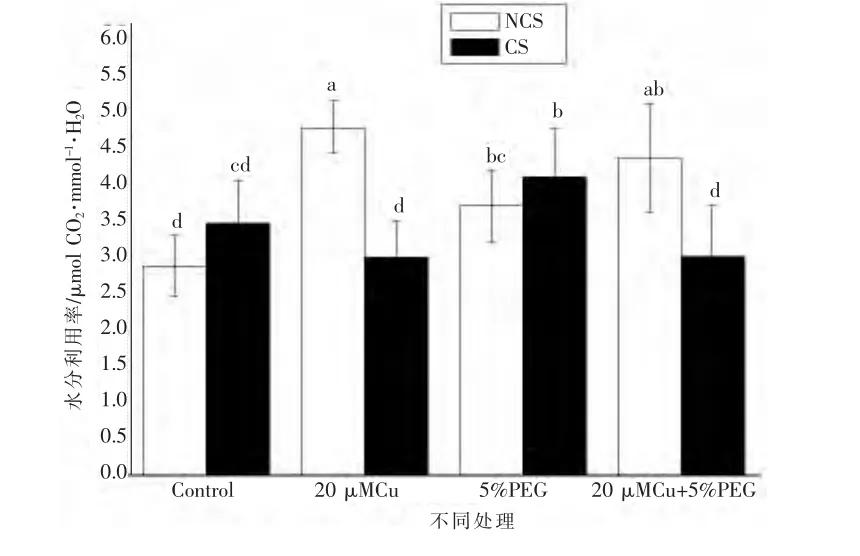
图2 铜、水分胁迫下铜污染和非污染海洲香薷叶片水分利用效率的差异
2.3 叶片相对含水量和根自然含水量
图3表明,在20 μM铜处理下,NCS和CS叶片相对含水量仅有轻微变化。在水分胁迫以及Cu+水分胁迫下,NCS的RWC高于CS,且NCS和CS的RWC均明显下降,但是下降的幅度不同。在水分胁迫下,分别与其对照相比,NCS的RWC下降了11.5%,CS的下降了39.1%。在Cu +水分胁迫下,NCS的下降了42.2%,CS的下降了47.5%。

图3 铜、水分胁迫下铜污染和非污染海洲香薷叶片相对含水量的差异
图4表明,与对照相比,NCS根自然含水量在20 μMCu处理以及Cu+水分胁迫下均明显下降,在水分胁迫下轻微下降;CS根NWC在Cu+水分胁迫下明显下降,但是在其它胁迫下仅有轻微变化。
3 讨论
蒸腾速率反映的是植物地上部分水分通过叶片等散失的速度,是反映植物地上部分失水快慢的指标。Tr直接影响着植物体内水分平衡的保持,进而影响着植物生理生化代谢的正常进行。20 μM铜处理下NCS的Tr明显降低但CS的Tr明显升高(图1),表明铜对NCS蒸腾作用有显著的抑制作用,而对CS蒸腾作用有一定的刺激作用,CS适宜于铜污染区生长。水分胁迫、铜+水分胁迫对NCS蒸腾作用的抑制作用明显强于CS (图1),说明对水分胁迫、铜和水分复合胁迫而言CS有强于NCS的适应能力,这与CS能耐短期干旱胁迫的结果是相一致的[6]。在干旱胁迫下,砷超蓄积植物蜈蚣草Tr也明显下降[12]。不同基因型西红柿的Tr对水分胁迫的反映也不同[14]。

图4 铜、水分胁迫下铜污染和非污染海洲香薷根自然含水量的差异
植物叶片水分利用效率是评价植物生长适宜程度的综合生理生态指标,它实质上反映了植物耗水与其干物质生产之间的关系。NCS的WUE在3种胁迫下均明显增加,但是CS的WUE仅在水分胁迫下明显增加,在其它处理下无明显变化(图2)。WUE反应差异表明NCS和CS对3种胁迫的敏感度不同,NCS更为敏感;NCS需要比CS消耗更多的水分才能产生同样的干物质积累。类似的是,金属型植物蜈蚣草的WUE在轻度干旱下也明显升高[12],橄榄WUE在水分胁迫下也上升[15]。
叶片相对含水量是植物水分状况的重要指标。在水分胁迫以及Cu+水分胁迫下,NCS和CS的RWC均明显下降,且CS下降的幅度大于NCS(图3)。这与进行土培干旱实验时观察到的现象相一致,即在同等干旱程度下,CS叶片发生萎蔫,而NCS没有萎蔫。CS和NCS对水分胁迫以及Cu+水分胁迫的反应方式不同,CS采取叶片萎蔫的方式自我保护(叶片萎蔫是植物在水分胁迫下自我保护的一种方式)。
4 结论
在Cu、水分胁迫以及Cu+水分胁迫下,铜污染区和非污染区海洲香薷水分代谢存在明显差异;与非污染区海洲香薷相比,铜污染区海洲香薷水分代谢受到的抑制作用偏轻。其结果可为尾矿库复垦以及矿山生态恢复提供科学依据。
[1] Ernst Who.Mine vegetation in Europe.In:Shaw AJ (Eds.)Heavy Metal Tolerance in Plants:Evolutionary Aspects[M].CRC Press,Boca Raton,1990,21-50.
[2] 柯文山,席红安,杨 毅,等.大治铜绿山矿区海州香薷(Elsholtzia haichowensis)植物地球化学特征分析[J].生态学报,2001,21(6):907-912.
[3] Tang S R,Wilke B M,Huang C Y.The uptake of copper by plants dominantly growing on copper mining spoils along the Yangtze River,the People's Republic of China[J].Plant and Soil,1999,209:225-232.
[4] Liu J,Xiong Z T.Differences in accumulation and physiological response to copper stress in three populations of Elsholtzia haichowensis S[J].Water Air and Soil Pollution,2005,168:5-16.
[5] 张军英,席 荣.金川镍尾矿库复垦的限制因子及植物适应性[J].甘肃冶金,2007,29(4):92-95.
[6] 李民敬,余发新,丁建南,等.铜、水分胁迫下金属型植物海洲香薷耐性和生长变化[J].江西科学,2013,31(1):26-30.
[7] Wierzbicka M,Panufnik D.The adaptation of Silene vulgaris to growth on a calamine waste heap(S.Poland)[J].Environmental Pollution,1998,101:415-426.
[8] Nicoletta Rascio,Flavia Navari-Izzo.Heavy metal hyperaccumulating plants:How and why do they do it And what makes them so interesting[J].Plant Science,2011,189:169-181.
[9] Yan Xia,Lv Yanyan,Yuan Yuxiang,et al.Cloning and characterization of a type 1 metallothionein gene from the copper-tolerant plant Elsholtzia haichowensis[J].Acta Physiologiae Plantarum,2012,34(5):1819-1826.
[10] Peng Hongyun,Kroneck Peter M H,Kuepper Hendrik.Toxicity and deficiency of copper in Elsholtzia splendens affect photosynthesis biophysics,pigments and metal accumulation[J].Environmental Science&Technology,2013,47(12):6120-6128.
[11] Bhatia Naveen P,Baker Alan J M,Walsh Kerry B,et al.A role for nickel in osmotic adjustment in droughtstressed plants of the nickel hyperaccumulator Stackhousia tryonii Bailey[J].Planta,2005,223:134-139.
[12] 陈 宏.光照和水分条件及套种东南景天对蜈蚣草生长及富集重金属的影响[D].南宁:广西大学,2010.
[13] Whiting S N,Neumann P M,Baker A J M.Nickel and zinc hyperaccumulation by Alyssum murale and Thlaspi caerulescens(Brassicaceae)do not enhance survival and whole-plant growth under drought stress[J].Plant Cell and Environment,2003,26:351-360.
[14] Alian Akram,Altman Arie,Heuer Bruria.Genotypic difference in salinity and water stress tolerance of fresh market tomato cultivars[J].Plant Science,2000,152:59-65.
[15] Bacelar E A,Moutinho-Pereira J M,Goncalves B C,et al.Changes in growth,gas exchange,xylem hydraulic properties and water use efficiency of three olive cultivars under contrasting water availability regimes[J].Environmental and Experimental Botany,2007,60: 183-192.

