小檗碱抗肿瘤作用机制的研究进展
张 娟(综述),李东霞(审校)
(内蒙古医科大学附属医院皮肤科,呼和浩特 010050)
小檗碱俗称黄连素,是从毛莨科黄连根状茎中提取的一种季胺类化合物,属于异喹啉生物碱,小檗碱具有多种药理作用,最初作为清热解毒药和抗菌药物应用于临床治疗胃肠道疾病,其疗效和安全性均得到普遍认可,小檗碱还有降血糖、降血脂、抗心力衰竭、抗消化性溃疡等药理作用。近年来随着对小檗碱药效作用的深入研究,其抗肿瘤作用成为研究的热点。小檗碱抗肿瘤活性的研究主要采用体外实验,小檗碱在非毒性剂量下即可抑制多种肿瘤细胞,并呈时间和剂量依赖性,在体内应用时,由于小檗碱难以被细胞吸收、摄取,其效果远不如体外显著。
1 小檗碱在肿瘤中的作用
1.1抑制多种致癌物质 小檗碱能够保护机体免受化学致癌物的损伤,临床常用其盐酸盐(分子式:C20H18NO4Cl,图1)[1]。
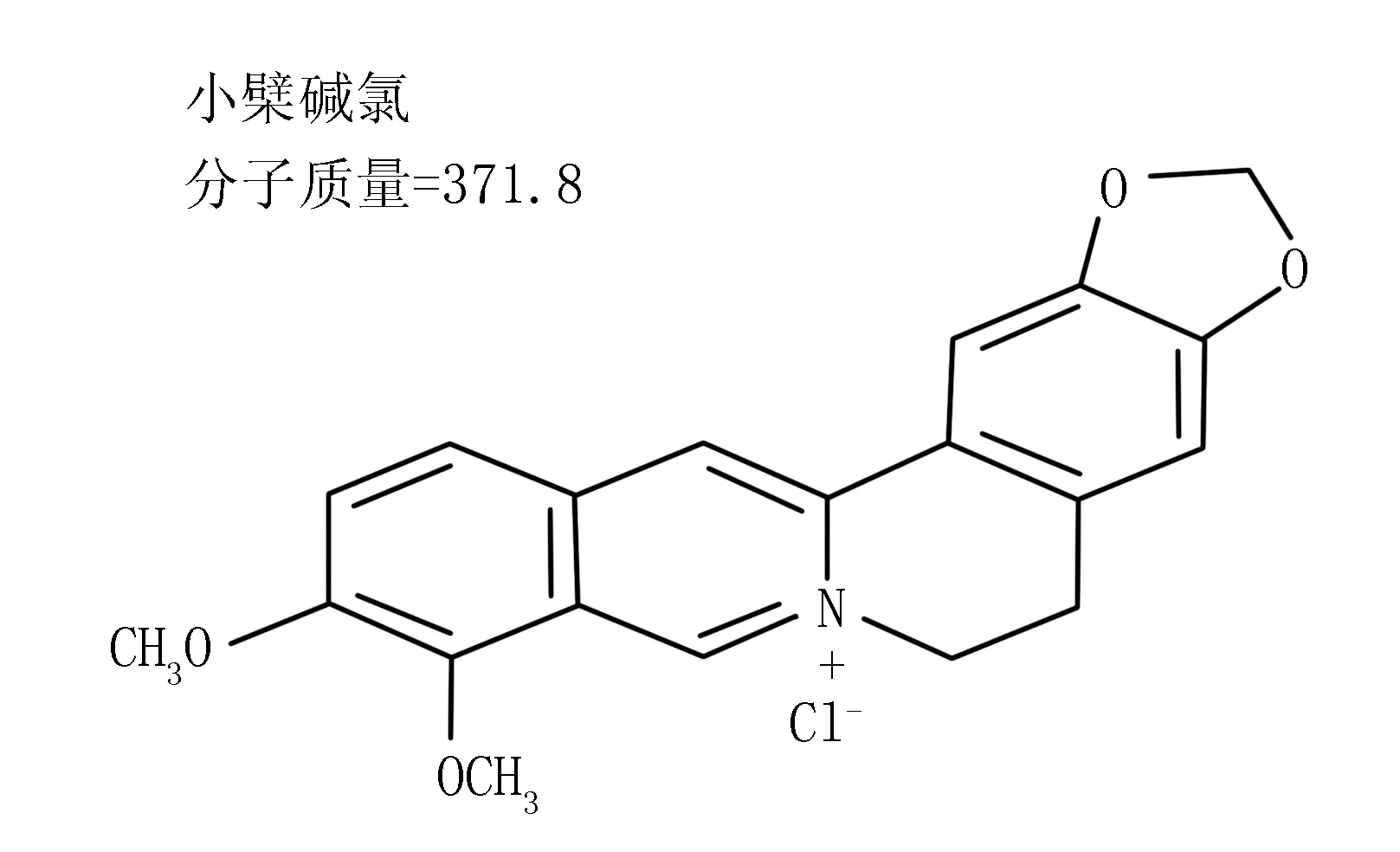
图1 盐酸小檗碱的化学结构及其分子质量
Anis等[2]研究发现,小檗碱可剂量依赖性地抑制20-甲基胆蒽和亚硝基胍所诱导的肝癌发生,Feng等[3]研究表明,小檗碱可以保护由四氯化碳引起的肝损伤,Nishino等[4]研究证明,小檗碱可以抑制12-0-十四烷酰佛波醋酸酯-13、杀鱼菌素、二甲苯蒽对鼠皮肤肿瘤的诱导作用。
1.2抑制N-乙酰化转移酶活性 N-乙酰化转移酶(N-acetyltransferase,NAT)广泛存在于各种细胞的细胞液中,能利用乙酰辅酶A提供的乙酰基使芳香胺类化合物产生致癌作用。NAT有两种同工酶NAT1和NAT2。小檗碱抑制NAT2降低机体对环境中的致变剂、化学致癌剂的易患性。Wang等[5]研究表明,小檗碱以浓度依赖性非竞争性地抑制人类恶性星形细胞瘤和脑胶质母细胞瘤细胞NAT活性、信使RNA NAT水平及2-氨基芴-DNA复合物形成。Lin等[6]报道,小檗碱能抑制人白血病细胞信使RNA NAT和NAT蛋白的表达。
2 小檗碱对肿瘤细胞增殖的抑制
2.1小檗碱影响肿瘤细胞生长周期 细胞周期分为静止期(G0)、DNA合成前期(G1)、DNA合成期(S)、有丝分裂前期(G2)、有丝分裂期(M),细胞在连续增殖过程中需要经过一些重要检测点,其中以G1/S和G2/M最为重要。细胞周期素、细胞周期素依赖激酶、细胞周期素依赖性蛋白激酶抑制因子是细胞周期调节的中心。多项研究结果提示,小檗碱能阻滞细胞周期于G0/G1期,可能与影响细胞周期相关蛋白,如p21、细胞周期素依赖性激酶2、细胞周期素依赖性激酶4、细胞周期素D1和细胞周期素E等[1,7-9];但也有研究表明,小檗碱通过影响p21蛋白表达,阻滞肿瘤细胞于G2/M期[10]。因此,小檗碱对不同细胞系细胞周期的影响亦不同。
2.2抑制DNA和蛋白质的合成 DNA和蛋白质是肿瘤细胞生长的物质基础。细胞周期阻滞细胞周期于G0/G1期,抑制DNA合成[1,7-9]。同时电泳迁移率变动分析的研究表明,在转录起始过程中,小檗碱能抑制TATA盒子和TBP结合,从而阻滞转录的进行,进而抑制DNA和蛋白质的合成[11]。
3 小檗碱可诱导肿瘤细胞凋亡
3.1线粒体/胱天蛋白酶(caspase)途径诱导凋亡 线粒体不仅是细胞凋亡信号转导、整合、放大的中继站,还可以作为凋亡信号的作用靶点。研究表明,小檗碱能诱导线粒体跨膜电位(Δψm)下降,线粒体膜通透性增大,激活大量核酸酶、蛋白酶的同时凋亡诱导因子和细胞色素C也被释放到细胞质,激活caspase级联反应,最终导致细胞凋亡。caspase-3是caspase级联反应中关键的效应酶。小檗碱能通过诱导Δψm下降激活caspase-3,使细胞选择坏死通路[1,7,10]。小檗碱诱导急性淋巴母细胞白血病细胞凋亡的研究发现,核因子κB参与了小檗碱诱导白血病细胞凋亡,推测小檗碱诱导白血病细胞凋亡可能是通过非线粒体依赖途径实现的,与常用化疗药物柔红霉素作用不同[12]。
3.2通过凋亡基因和凋亡抑制基因诱导凋亡 凋亡的发生与凋亡相关基因表达增强和抗凋亡相关基因表达减弱有关。近年来,Bcl-2家族成为研究热点,Bcl-2和Bax分别是Bcl-2家族中最有代表性的抑制凋亡和促进凋亡蛋白,Bcl-2/Bax比值决定细胞是否进入凋亡状态,在肿瘤细胞凋亡调控中具有重要的作用[7,10]。存活蛋白具有抑制凋亡、调节分化的双向作用,相关研究表明小檗碱能通过存活蛋白的表达而诱导细胞凋亡[10,13]。
3.3通过炎性因子诱导凋亡 炎性微环境在多种肿瘤进展、血管生成、侵袭和凋亡中发挥重要作用。在肿瘤相关炎性细胞所分泌的细胞因子中,肿瘤坏死因子α被认为是一个关键调节分子,小檗碱可协同肿瘤坏死因子相关凋亡诱导配体诱导急性淋巴母细胞白血病细胞凋亡,其分子机制可能涉及抑制核因子κB/p65的表达和caspase-3、caspase-8的剪切活化[14]。以往认为巨噬细胞能直接杀伤肿瘤细胞,或通过抗原呈递诱导机体免疫应答间接清除肿瘤细胞。肿瘤微环境内的巨噬细胞可分化为功能不同的两类,即M1和M2型。M2型巨噬细胞又称为肿瘤相关巨噬细胞,不但没有抗肿瘤作用,反而参与了肿瘤的增殖、凋亡、浸润及转移等过程。研究表明,肿瘤相关巨噬细胞可以促进人子宫内膜癌细胞增殖,小檗碱对体外共培养肿瘤相关巨噬细胞和人子宫内膜癌细胞有抑制作用;小檗碱通过干预肿瘤相关巨噬细胞形成而发挥抗肿瘤作用,并提示抗炎可能成为预防和治疗肿瘤的新途径[15-16]。
3.4通过断裂DNA诱导凋亡 聚腺苷二磷酸(adenosine diphosphate,ADP)核糖聚合酶是真核细胞(除酵母外)生物体内一类重要的DNA损伤修复酶家族,有DNA修复、细胞增殖、细胞死亡、端粒长度调节等作用。聚ADP核糖聚合酶在各种生物效应引起的DNA断裂的活化下,产生聚ADP核糖合成活性与聚ADP核糖转移活性,将ADP核糖单位转移至某些氨基酸残基上,对蛋白质进行修饰,继而产生各种不同的生物学效应。聚ADP核糖聚合酶高表达是由于凋亡过程中出现DNA的损伤诱发的,小檗碱能激活聚ADP核糖聚合酶诱导皮肤鳞癌A431细胞和结肠癌细胞凋亡[7,10]。
3.5通过环加氧酶诱导凋亡 环加氧酶是花生四烯酸代谢过程中的限速酶,有两种异构体:环加氧酶1和环加氧酶2,环加氧酶1在正常组织及癌组织中表达水平基本相似,环加氧酶2在正常组织中极少表达,而在各种癌组织中升高,同时癌组织中前列腺素E2水平亦升高,因此认为环加氧酶2增多及其诱导的前列腺素E2增多与结肠癌等肿瘤发病有关[9,17]。激活蛋白1是一种原癌基因,主要由c-Jun和c-Fos组成,可编码转录因子,引起下游基因(如环加氧酶2)的连锁反应,对细胞增生和肿瘤进展发挥重要作用。陆宁等[18]对人结肠癌细胞的研究发现,小檗碱可能通过下调激活蛋白1表达,进而使环加氧酶2表达降低。环加氧酶2可引发前列腺素E2及其受体参与的非黑色素性皮肤癌的发生和发展[19]。小檗碱能否阻滞环加氧酶2参与皮肤恶性肿瘤发生有待进一步研究。
4 诱导肿瘤细胞分化
诱导分化治疗避免了一般化疗药物对于肿瘤细胞及正常细胞的“双刃剑”杀伤作用,成为一种替代或补充传统化疗的新方法。小檗碱1~8 mg/L对人白血病细胞具有较显著的诱导分化作用,随着细胞的分化,其增殖能力亦随之下降[20];小檗碱可通过p38丝裂原激活蛋白激酶途径激活成骨特异性转录因子来促进成骨细胞分化[21]。鉴于小檗碱在抑制肿瘤细胞生长的同时能诱导恶性细胞分化而毒性却很小,因此诱导肿瘤细胞分化将成为肿瘤治疗的一条新思路。
5 抑制肿瘤转移
恶性肿瘤侵袭和转移的特点是患者死亡的主要原因。肿瘤侵袭和转移是一个复杂的过程,其中基膜的破坏和细胞外基质的降解是肿瘤细胞侵袭的关键步骤。
5.1抑制肿瘤血管形成 在肿瘤血管生成过程中,受血管生成刺激因子的作用,内皮细胞增殖速率远远大于凋亡速率,导致肿瘤新生血管的形成。新生血管为肿瘤生长提供充分营养,也为肿瘤转移提供有利条件。相关研究表明,小檗碱能明显抑制碱性成纤维细胞生长因子和活化人脐静脉内皮细胞的增殖,并使活化人脐静脉内皮细胞的细胞周期阻滞,从而抑制活化人脐静脉内皮细胞的增殖,抑制肿瘤新生血管的形成[9];小檗碱可通过抑制缺氧诱导因子的表达来抑制肿瘤血管形成[22]。
5.2阻断肿瘤转移相关信号转导通路 肿瘤细胞、血管内皮细胞及胞外基质之间的黏附与解离是通过细胞黏附分子的介导实现的。CD44v6是广泛分布在细胞表面的跨膜糖蛋白,属细胞黏附分子,它的高表达与肿瘤淋巴转移呈正相关。小檗碱作用于人胃癌MGC-803细胞呈浓度依赖性的降低其CD44v6的表达,从而抑制肿瘤转移[23]。细胞绒毛蛋白为膜-细胞骨架连接蛋白,活化的细胞绒毛蛋白参与调节肌动蛋白调控的多种生物学功能,而细胞绒毛蛋白的过表达能促进肿瘤的发展和转移。Huang等[24]通过小檗碱作用于鼻咽癌细胞系5-8F的研究发现,小檗碱能通过抑制磷酸化细胞绒毛蛋白的表达及细胞伪足形成发挥作用。基质金属蛋白酶可以降解细胞外基质骨架从而实现血管侵入肿瘤组织,为肿瘤细胞生长提供营养。Kim等[25]研究发现,小檗碱能抑制乳腺癌细胞蛋白激酶C-α通路中基质金属蛋白酶1和基质金属蛋白酶9的表达。
5.3抗恶病质 恶病质的发生是多种调节物质失衡所致,主要是细胞因子。白细胞介素6是由单核细胞、血管内皮细胞及肿瘤细胞分泌而来,可以促进B淋巴细胞增殖、分化和分泌抗体,也可以直接或间接增强自然杀伤细胞及细胞毒性T淋巴细胞的杀瘤活性,产生抗瘤效应。然而,白细胞介素6分泌过多也可能导致肿瘤患者发生恶液质。Iizuka等[26-27]研究发现,小檗碱可显著改善肿瘤患者的恶病质症状,并且这种作用与小檗碱下调肿瘤产生白细胞介素6的能力有关。
6 小檗碱辅助其他药物和放疗对肿瘤的作用
小檗碱不仅对肿瘤细胞有直接的杀伤作用,还可通过增强其他途径杀伤肿瘤细胞的能力,如关于小檗碱协同抗肿瘤作用的研究表明,小檗碱可调节胃肠道肿瘤对紫杉醇的反应,增强三氧化二砷诱导的人成神经细胞瘤SH-SY5Y细胞系的凋亡,治疗对柔红霉素耐药的白血病或者与柔红霉素联合治疗白血病[12,28-29];对于放疗敏感性影响的研究表明,增强乳腺癌细胞MDA-MB-231和MCF-7对放疗增敏性的机制可能与上调Bax和caspase-3,下调Bcl-2引起细胞周期阻滞等有关,而增强鼻咽癌放疗敏感性与下调同源重组修复蛋白RAD51的表达有关[30-31]。
7 展 望
小檗碱可通过多种机制发挥抗肿瘤作用,但目前有关小檗碱的抗肿瘤的研究主要采用体外实验,而体外实验条件的局限性以及肿瘤细胞株的生物学特性与体内肿瘤存在差异,因而进一步观察其对相应疾病模型的效应并最终走向临床将成为其今后的研究重点。目前有众多关于小檗碱抗肿瘤作用的研究,但其抗肿瘤作用的确切机制及具体通路仍不明确,有待于进一步探讨。小檗碱具有廉价低毒等特点,在充分发挥传统中药抗肿瘤作用方面的独特效用,为临床治疗肿瘤提供新思路。
[1] Mantena SK,Sharma SD,Katiyar SK.Berberine,a natural product,induces G1-phase cell cycle arrest and caspase-3-dependent apoptosis in human prostate carcinoma cells[J].Mol Cancer Ther,2006,5(2):296-308.
[2] Anis KV,Rajeshkumar NV,Kuttan R.Inhibition of chemical carcinogenesis by berberine in rats and mice[J].J Pharm Pharmacol,2001,53(5):763-768.
[3] Feng Y,Siu KY,Ye XS,etal.Hepatoprotective effects of berberine on carbon tetrachloride-induced acute hepatotoxicity in rats[J].Chin Med,2010,5:33.
[4] Nishino H,Kitagawa K,Fujiki H,etal.Berberine sulfate inhibits tumor-promoting activity of teleocidin in two-stage carcinogenesis on mouse skin[J].Oncology,1986,43(2):131-134.
[5] Wang DY,Yeh CC,Lee JH,etal.Berberine inhibited arylamine N-acetyltransferase activity and gene expression and DNA adduct formation in human malignant astrocytoma (G9T/VGH) and brain glioblastoma multiforms (GBM 8401) cells[J].Neurochem Res,2002,27(9):883-889.
[6] Lin CC,Kao ST,Chen GW,etal.Berberine decreased N-acetylation of 2-aminofluorene through inhibition of N-acetyltransferase gene expression in human leukemia HL-60 cells[J].Anticancer Res,2005,25(6B):4149-4155.
[7] Mantena SK,Sharma SD,Katiyar SK.Berberine inhibits growth,induces G1arrest and apoptosis in human epidermoid carcinoma A431 cells by regulating Cdki-Cdk-cyclin cascade,disruption of mitochondrial membrane potential and cleavage of caspase 3 and PARP[J].Carcinogenesis,2006,27(10):2018-2027.
[8] 陈刚,柯善栋,王清睿,等.小檗碱对胃癌AGS细胞增殖和凋亡影响的初步研究[J].中西医结合研究,2011,3(1):4-7.
[9] 娄金丽,邱全瑛,郝钰,等.小檗碱抗肿瘤新生血管形成作用机制的研究[J].中国免疫学杂志,2006,22(3):235-236,243.
[10] Chidambara Murthy KN,Jayaprakasha GK,Patil BS.The natural alkaloid berberine targets multiple pathways to induce cell death in cultured human colon cancer cells[J].Eur J Pharmacol,2012,688(1/3):14-21.
[11] Wang Y,Kheir MM,Chai Y,etal.Comprehensive study in the inhibitory effect of berberine on gene transcription,including TATA box[J].PLoS One,2011,6(8):e23495.
[12] 蒋艳,胡群,王业军,等.小檗碱诱导白血病Molt-4细胞株凋亡及对NF-κB/p65、Caspase-3表达的影响[J].白血病·淋巴瘤,2012,21(6):342-344.
[13] Pazhang Y,Ahmadian S,Javadifar N,etal.COX-2 and survivin reduction may play a role in berberine-induced apoptosis in human ductal breast epithelial tumor cell line[J].Tumour Biol,2012,33(1):207-214.
[14] 张小玲,胡群,宋艳清,等.小檗碱增强TRAIL诱导白血病细胞凋亡[J].中国医院药学杂志,2007,27(1):27-30.
[15] 李军,薛晓鸥,刘小丽,等.小檗碱对与肿瘤相关巨噬细胞共培养的人子宫内膜癌Ishikawa细胞株的作用[J].北京中医药大学学报,2011,34(7):448-452.
[16] 李健,郝钰,张玉丽,等.小檗碱对CT26皮下移植瘤组织中肿瘤相关巨噬细胞的影响[J].中国组织化学与细胞化学杂志,2011,20(3):203-206.
[17] Kuo CL,Chi CW,Liu TY.Modulation of apoptosis by berberine through inhibition of cyclooxygenase-2 and Mcl-1 expression in oral cancer cells[J].In Vivo,2005,19(1):247-252.
[18] 陆宁,王邦茂,黄迺侠,等.黄连素对脱氧胆酸诱导的人结肠癌细胞株增殖抑制作用及机制[J].中华消化杂志,2006,26(9):632-633.
[19] Rundhaug JE,Simper MS,Surh I,etal.The role of the EP receptors for prostaglandin E2 in skin and skin cancer[J].Cancer Metastasis Rev,2011,30(3/4):465-480.
[20] 王志红,林菁.盐酸小檗碱对HL-60细胞增殖与分化的影响[J].中国药理学通报,2004,20(11):1305-1308.
[21] Lee HW,Suh JH,Kim HN,etal.Berberine promotes osteoblast differentiation by Runx2 activation with p38 MAPK[J].J Bone Miner Res,2008,23(8):1227-1237.
[22] Lin S,Tsai SC,Lee CC,etal.Berberine inhibits HIF-1alpha expression via enhanced proteolysis[J].Mol Pharmacol,2004,66(3):612-619.
[23] 娄金丽,邱全瑛,林洪生,等.小檗碱对人胃癌细胞增殖、细胞周期及CD44v6表达的影响[J].中国免疫学杂志,2004,20(5):315-317.
[24] Huang D,Wang W,Feng Z,etal.Berberine inhibits the invasion and metastasis of nasopharyngeal carcinoma cells through Ezrin phosphorylation[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2011,36(7):616-623.
[25] Kim S,Han J,Lee SK.Berberine suppresses the TPA-induced MMP-1 and MMP-9 expressions through the inhibition of PKC-αin breast cancer cells[J].J Surg Res,2012,176(1):e21-e29.
[26] Iizuka N,Miyamoto K,Hazama S,etal.Anticachectic effects of Coptidis rhizoma,an anti-inflammatory herb,on esophageal cancer cells that produce interleukin 6[J].Cancer Lett,2000,158(1):35-41.
[27] Iizuka N,Hazama S,Yoshimura K,etal.Anticachectic effects of the natural herb Coptidis rhizoma and berberine on mice bearing colon 26/clone 20 adenocarcinoma[J].Int J Cancer,2002,99(2):286-291.
[28] Lin HL,Liu TY,Wu CW,etal.Berberine modulates expression of mdr1 gene productand the responses of digestive track cancer cells toPaclitaxel[J].Br J Cancer,1999,81(3):416-422.
[29] Kim DW,Ahan SH,Kim TY.Enhancement of arsenic trioxide (As(2)O(3))-Mdiated Apoptosis Using Berberine in Human Neuroblastoma SH-SY5Y Cells[J].J Korean Neurosurg Soc,2007,42(5):392-399.
[30] 赵超前,徐加英,焦旸,等.黄连素对乳腺癌细胞生长、迁移和放射敏感性的影响[J].中华放射医学与防护杂志,2012,32(1):25-30.
[31] Liu Q,Jiang H,Liu Z.Berberine radiosensitizes human esophageal cancer cells by downregulating homologous recombination repair protein RAD51[J].PLoS One,2011,6(8):e23427.

