内镜超声对早期胃癌内镜下治疗的指导价值
简玉华,胡辉歌
胃癌是常见的恶性肿瘤之一,进展期胃癌的治疗以手术为主,创伤大,严重影响患者的生存质量和预后。而早期胃癌(early gastric cancer,EGC)的5年存活率可达90%以上[1],胃癌的早期诊断和治疗对于提高胃癌患者生存率至关重要[2]。内镜超声(endoscopic ultrasonography,EUS)可以观察胃壁各层病变,对判断病变的深度、大小、形态具有重要的指导意义,对于EGC的诊断及TNM分期具有重要价值[3]。EGC的内镜下治疗主要包括内镜下黏膜切除术(endoscopic mucosal resection,EMR)及内镜黏膜下剥离术(endoscopic submucosal dissection,ESD),是内镜下治疗EGC安全、有效、微创的方法[4]。如何充分应用EUS的优势,指导EMR或ESD治疗EGC是值得研究和探讨的课题,为此,本研究分析了EUS对EMR或ESD治疗的56例EGC患者的指导价值。
1 资料与方法
1.1病例资料 2007年1~12月我院及第四军医大学西京医院内窥镜中心经EUS和病理学检查确诊的EGC患者56例作为研究组,对其事先行EUS检查,判断病灶浸润深度、大小、形态等,然后进行EMR或ESD治疗。其中男性38例,女性18例,年龄46~83(62.3±18.2)岁。2006年1~12月我院经普通胃镜及病理检查诊断的EGC患者32例患者作为对照组,其中男性20例,女性12例,年龄48~82(61.8±19.2)岁。对其仅进行普通胃镜检查,事先未进行EUS检查,然后行EMR或ESD治疗。两组病灶分布、大小及内镜下分型见表1。所有病例无EMR或ESD禁忌证。两组年龄、性别构成及病变部位、大小及分型无显著差异。所有患者均由相同仪器设备及同一经验丰富的内镜医师完成诊治,具有可比性。
1.2方法
1.2.1EUS 采用GF-UM2000电子超声胃镜及UM-25R微型探头(日本Olympus公司)。首先进行普通胃镜检查,发现病灶后,将高频超声探头经钳道插入,对病灶进行超声扫描,对病灶大小、性质、回声、边界、浸润深度等进行详细观察,并对周围淋巴结进行评价。EUS检查由经验丰富的内镜医师完成。EUS诊断EGC的标准[5]:病灶侵犯黏膜层或黏膜下层而未达肌层,无论有无淋巴结转移,分为黏膜层癌(m癌):黏膜层增厚、不规则,黏膜下层连续性好;黏膜下层癌(sm癌):黏膜下层局部狭窄及不规则,但无中断。
1.2.2EMR 采用Olympus GF-2000电子胃镜,德国ERBEICC200高频电凝电切仪及电切刀,日本Olympus圈套器、透明帽、活检钳、注射针。对病灶最大径≤2 cm的m癌采用EMR治疗。首先进镜观察病灶大小,根据病灶大小于病灶黏膜下层注入生理盐水约2~10 ml,使病灶隆起,负压吸引入透明帽内,圈套器圈套后给予高频电凝电切,切除标本以活检钳取出送病理检查。
1.2.3ESD 所用仪器设备同EMR。对病灶最大径>2 cm的m癌和sm癌采用ESD治疗。首先采用亚离子凝固术于病灶外缘0.5 cm左右进行标记,然后于病灶黏膜下注射含1∶10 000靛胭脂肾上腺素生理盐水,使病灶明显抬起。采用电刀切开病灶外侧缘黏膜,边注水,边逐步分离。病灶切除后对创面电凝止血,必要时给予钛夹止血。
1.3观察指标 统计EUS对病灶大小、浸润深度及淋巴结转移的检查结果,并与病理检查结果对比。比较两组手术并发症、病灶切除率。对所有患者进行门诊随访,比较两组5年复发率及生存率。病灶切除情况分为整块切除:内镜下一次性整块切除病变;完整切除:整块切除标本在病理学水平达到水平、垂直,切缘均为阴性;治愈性切除:无或低淋巴结转移风险的完整切除;可能治愈性切除:切缘可能存在异型细胞;非治愈性切除:整块一次性切除标本切缘和(或)基底有异型细胞或分块切除[6]。
1.4统计学方法 采用SPSS 12.0统计软件分析,计量资料采用t检验,计数资料采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1EUS对病灶深度及淋巴结转移的检查结果 研究组56例经EUS检查后,发现m癌36例,sm癌20例。与病理结果对照,m癌诊断符合34例,符合率94.4%;sm癌符合18例,符合率90.0%,总体符合率92.9%。52例无淋巴结转移,4例有淋巴结转移。
2.2两组内镜下治疗结果比较 研究组56例中,行EMR 36例,手术时间(48.6±16.8)min;ESD 20例,手术时间(58.3±21.6)min。对照组32例中,EMR 20例,手术时间(50.5±18.4)min;ESD 12例,手术时间(61.2±16.8)min。两组EMR或ESD手术时间相比均无显著差异(P>0.05)。无论是EMR还是ESD,研究组的整块切除率、完整切除率及治愈性切除率均显著高于对照组(χ2=4.689、6.373、6.373/4.400、4.544、6.968,P<0.05或P<0.01),非治愈性切除率显著低于对照组(χ2=4.689/6.400,P<0.05)。见表2。
表1 两组病灶部位、分型及大小
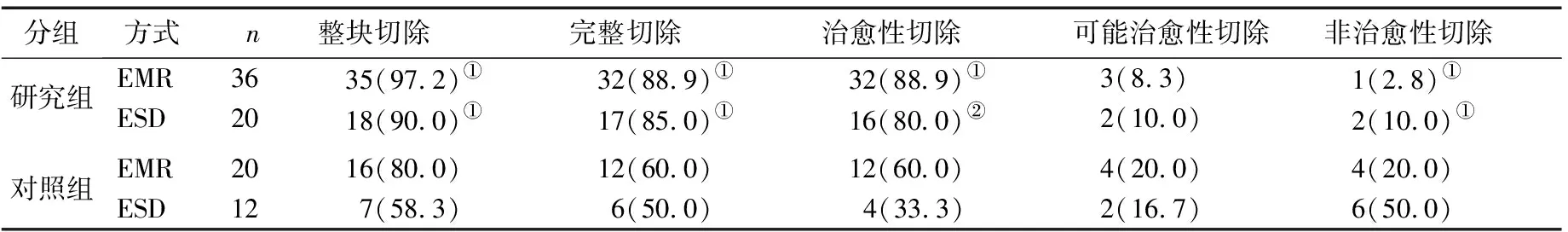
表2 两组内镜下黏膜切除情况对比[n(%)]
2.3两组内镜下治疗并发症及术后随访情况 研究组术后出现黏膜切除部位出血8例,对照组术后出血6例,两组出血发生率无显著差异,均给予内镜下电凝止血、钛夹止血及抑酸药物治疗后出血停止;研究组无穿孔病例,对照组出现1例穿孔,给予外科手术治愈;研究组术后出现不同程度上腹隐痛12例,对照组10例,两组并发症发生率比较均无显著差异(P>0.05)。术后1个月复查胃镜,所有患者创面均愈合。研究组术后5年内复发2例,对照组复发6例,术后复发率研究组(3.57%)显著低于对照组(18.75%)(χ2=5.676,P<0.05);研究组5年存活率98.21%,显著高于对照组(87.50%)(χ2=4.362,P<0.05)。
3 讨论
EGC是指病灶局限于黏膜下层而无论有无淋巴结转移的胃癌,其5年存活率高达90%左右,因此,早期胃癌的发现是提高胃癌患者预后的关键。普通胃镜不能判断EGC的浸润深度,对EGC的判断存在一定的局限性。EUS将超声微探头与电子胃镜相结合,能够显示胃黏膜的分层,可判断病灶的浸润深度,有利于早期胃癌的内镜下诊断[3,7]。本组资料显示,EUS能够显示EGC的浸润深度及淋巴结转移情况,能够区分m癌或sm癌,与病理结果的符合率在90%左右。
EMR/ESD是内镜下治疗EGC的主要方法,具有创伤小、疗效显著的优势,目前成为早期胃癌的首选治疗方式[8-10]。EUS在判断病灶深度的同时,对EGC内镜下治疗具有指导价值,主要体现在以下几个方面:(1)有助于EMR或ESD适应证的选择。EMR的适应证之一是EGC局限于黏膜层,病灶直径小于2 cm。但其无法整块切除大面积病灶;ESD弥补了EMR的不足,能够一次性完整切除较大面积胃黏膜,但其操作复杂、并发症多[11]。因此,对EGC患者选择EMR或ESD必须慎重,EUS能够观察病灶的浸润深度,并且能够观察病灶的大小及形态,有助于对ESD或EMR的选择。(2)EUS提高了病灶的切除效果。EMR或ESD切除效果的评价不仅仅是切除病灶的完整性,还需要满足组织病理学上的治愈性,即达到病理学治愈的效果。普通胃镜下只能观察EGC的平面表现,而EUS能够立体性观察,因此保证了切除的效果。研究组事先经EUS检查,了解EGC侵犯的水平和垂直程度,提高了EMR或ESD的整块切除率、完整切除率及治愈性切除率,同时降低了非治愈性切除率(表2)。(3)EUS保证了ESD或EMR的安全性。EMR或ESD最严重的并发症是胃黏膜穿孔。EUS检查可事先了解EGC的深度和范围,使术者对切除范围术前做到心中有数,减少了盲目性,从而减少了穿孔的发生。本试验研究组无穿孔病例发生,而对照组有1例出现穿孔。虽然两组患者穿孔率并无显著差异,可能是由于病例数较少的原因,有待于大样本多中心对照分析。(4)EUS减少术后复发率,增加了存活率。EUS在保证切除效果的同时,使EGC的5年存活率增加,同时复发率减少。
总之,EUS有助于EGC患者EMR或ESD适应证的选择,能指导术者对切除范围的了解,保证切除效果和安全性,提高了EGC内镜下治疗效果。因此,有条件的医院对EGC患者应在EUS的指导下对EGC实施内镜下治疗。
【参考文献】
[1] Degiuli M,Calvo F.Survival of early gastric cancer in a specialized European center.Which lymphadenectomy is necessary[J]?World J Surg,2006,30(12):2193-2203.
[2] Saragoni L,Morgagni P,Gardini A,et al.Early gastric cancer:diagnosis,staging,and clinical impact.Evaluation of 530 patients.New elements for an updated definition and classification[J].Gastric Cancer,2013,16(4):549-554.
[3] Cho JW.The role of endoscopic ultrasonography in T staging:early gastric cancer and esophageal cancer[J].Clin Endosc,2013,46(3):239-242.
[4] Gotoda T,Jung HY.Endoscopic resection(endoscopic mucosal resection/ endoscopic submucosal dissection)for early gastric cancer[J].Dig Endosc,2013,25(Suppl 1):55-63.
[5] 董光宏,邹晓平,李兆申.内镜超声检查对胃及食管早期癌的诊断价值[J].中华消化内镜杂志,2005,22(3):185-187.
[6] 周平红,蔡明琰,姚礼庆.消化道黏膜病变内镜黏膜下剥离术的专家共识意见[J].诊断学理论与实践,2012,11(5):531-535.
[7] Choi J,Kim SG,Im JP,et al.Comparison of endoscopic ultrasono-graphy and conventional endoscopy for prediction of depth of tumor invasion in early gastric cancer[J].Endoscopy,2010,42(9):705-713.
[8] Lian J,Chen S,Zhang Y,et al.A meta-analysis of endoscopic submucosal dissection and EMR for early gastric cancer[J].Gastrointest Endosc,2012,76(4):763-770.
[9] Min BH,Lee JH,Kim JJ,et al.Clinical outcomes of endoscopic submucosal dissection(ESD)for treating early gastric cancer:comparison with endoscopic mucosal resection after circumferential precutting(EMR-P)[J].Dig Liver Dis,2009,41(3):201-209.
[10] Ishikawa S,Togashi A,Inoue M,et al.Indications for EMR/ESD in cases of early gastric cancer:relationship between histological type,depth of wall invasion,and lymph node metastasis[J].Gastric Cancer,2007,10(1):35-38.
[11] Chavez RM.Endoscopic treatment of early gastric cancer:from endoscopic mucosal resection(EMR)to endoscopic submucosal dissection(ESD)][J].Rev Gastroenterol Peru,2005,25(1):76-92.

