野生地木耳中次生代谢产物含量测定与分析
张士振, 季添英, 冯小妹, 朱晨曦, 尹华宝, 黄训端, 尤硕愚
(安徽大学 生命科学学院, 安徽 合肥 230601)
地木耳(NostoccommuneVauch.)是蓝藻门蓝藻纲念珠藻科(nostocaceae)念珠藻属植物,平时所见的片状藻体是地木耳的原植体(thallus)[1]。地木耳富含人体必需的氨基酸、多种微量元素和维生素等,还含有一定的粗脂肪和粗纤维,是典型的绿色食品[2]。地木耳也可入药,在《本草纲目》和《中国药典》中均有记载,有清热明目,收敛益气之功效。过去对地木耳的研究多集中于其生态分布、生理生化、营养成分和人工培养等方面[3],近年来对地木耳多糖的提取及活性研究较多,特别是对其细胞外多糖的研究更为深入[4]。国外也有对地木耳细胞形态学、分子遗传学和化学分类学特征的研究[5],但目前国内外对地木耳的化学成分及其生物活性研究仍处于起步阶段[6]。
植物次生代谢产物(plant secondary metabolites,PSMs)是指植物体中一大类并非生长发育所必需的小分子有机化合物[7]。近年来对地木耳次生代谢产物很少有研究,只有针对地木耳中单一种类次生代谢产物的报道,没有一个较为全面的研究[8]。为此,本研究对地木耳中总酚、总黄酮、总生物碱和缩合单宁这几类次生代谢产物作了初步的测定与分析,并与黑木耳、银耳、紫菜、海带这4种日常食用的菌藻进行了比较与分析,为地木耳中活性成分及生物活性的深入研究提供一定的参考。
1 材料与方法
1.1 材料与试剂
野生地木耳样品分别来自安徽合肥、湖北十堰、山西朔州。选新鲜、质感好的地木耳,除净杂草和附着物,洗净,自然晾干,将晾干的野生地木耳用粉碎机打碎,干燥保存备用。黑木耳、银耳、紫菜、海带均购于农副产品批发市场,处理方法同上。
香草醛(分析纯)、儿茶素(纯度97.2%)、没食子酸(纯度90.1%)、芦丁(纯度92.5%,UV测定)、盐酸小檗碱(纯度86.8%)均购自中国食品药品检定研究院。
1.2 仪器与设备
L-2000型高效液相色谱仪(HITACHI)、紫外分光光度计(UNICO7200)、KQ5200B超声波清洗器、电子分析天平(精度:0.1 mg)、KDC-40低速离心机、DK-S42型电热恒温水浴锅、Eppendorf 5424型高速离心机。
1.3 次生代谢产物含量测定方法
采用分光光度法测定野生地木耳及几种菌藻中的总酚、总黄酮和缩合单宁含量;采用HPLC法测定总生物碱含量。
总酚测定方法参照李巨秀等[9],标准品为没食子酸,回归方程:y= 0.4001x+0.0001,R2= 0.9991。式中y为吸光度,x为没食子酸浓度(mg/mL),R为相关系数,线性范围为:0~1.08 mg/mL。
总黄酮测定方法参照厉荣玉等[10],标准品为芦丁,回归方程:y=0.2176x+0.0005,R2= 0.9998。式中y为吸光度,x为芦丁浓度(mg/mL),R为相关系数,线性范围为:0~0.46 mg/mL。
缩合单宁测定方法为“香草醛-盐酸”法[11],标准品为儿茶素,回归方程:y=0.5082x-0.0009,R2=0.9991。式中y为吸光度,x为儿茶素浓度(mg/mL),R为相关系数,线性范围为:0~0.68 mg/mL。
生物碱测定方法参考秦彦杰等[12],样品以63%乙醇为溶剂,在41℃条件下超声提取64 min,使用日立L-2000型高效液相色谱仪(HPLC)测定,标准品为盐酸小檗碱。检测条件:色谱柱为HITACHI LaChrom C18柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.1%磷酸溶液(60∶40),流速:0.5 mL/min,进样量10 μL,检测波长为345 nm,柱温:30 ℃。
回归方程:y= 1E-07x+ 0.037,R2= 0.9995。式中y为吸光度,x为盐酸小檗碱浓度(mg/mL),R为相关系数,线性范围为:0~0.52 mg/mL。
1.4 数据处理
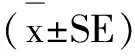
2 结果与分析
2.1 野生地木耳中次生代谢产物含量
我们对3个不同产地的野生地木耳样品中的次生代谢产物含量进行了测定,数据经方差分析检验,结果显示,3个产地的野生地木耳中的4种次生代谢产物的含量无显著性差异(总酚:F=1.640,P=0.270>0.05;总黄酮:F=0.361,P=0.711>0.05;总生物碱:F=0.380,P=0.699>0.05;缩合单宁:F=0.161,P=0.855>0.05)(表1)。从表1中的含量均值可看出,野生地木耳中总酚含量最为丰富,是野生地木耳次生代谢产物中的主要物质,其次是总黄酮,以及微量的总生物碱与缩合单宁。

表1 不同产地野生地木耳中次生代谢产物含量
2.2 野生地木耳与4种常见食用菌藻中次生代谢产物含量比较分析
野生地木耳作为一种营养价值较高的食用藻类,在与日常食用的藻类-紫菜和海带营养价值的比较研究中,其蛋白质和氨基酸含量高,矿质元素种类丰富。对其次生代谢产物方面,本研究对野生地木耳与4种常见食用菌藻类(黑木耳、银耳、紫菜、海带)做了相关比较研究。野生地木耳与4中常见食用菌藻中次生代谢产物含量均值差见表2。

表2 野生地木耳与4种常见食用菌藻中次生代谢产物含量均值差
注:表中负值表示地木耳中某类次生代谢产物含量低于常见食用菌藻;*:P<0.05。
由表2可知,野生地木耳总酚与样品中其他4种常见食用菌藻均有显著性差异(P<0.05),实验测得野生地木耳中总酚含量均高于黑木耳、银耳和紫菜,低于海带中总酚含量;野生地木耳黄酮与样品中其它4种常见食用菌藻均有显著性差异(P<0.05),实验测得野生地木耳中黄酮含量高于黑木耳和银耳,约为黑木耳的7倍,银耳的3倍,略低于紫菜中的黄酮含量;野生地木耳生物碱与样品中其他菌藻类均有显著性差异(P<0.05),实验测得野生地木耳中总生物碱含量略高于黑木耳、银耳和海带,远低于紫菜;野生地木耳缩合单宁与黑木耳的缩合单宁含量无显著性差异(P>0.05),与银耳、紫菜、海带差异显著(P<0.05),实验测得银耳、紫菜、海带的单宁含量均是野生地木耳的2倍以上。
3 结论与讨论
1)野生地木耳中总酚含量为24.255 mg/g±1.631 mg/g,与其它植物果实相比,其含量明显高于猕猴桃果肉(约3.19 mg/g)和新疆洛浦县沙枣果肉(6.16 mg/g)[13-14]。由此可见野生地木耳中总酚含量丰富,酚类物质具有高效的降血压、降血脂、防治心血管疾病、抗菌消炎等功效,因此野生地木耳具有很高的食用和保健价值。
2)野生地木耳中总黄酮含量为5.741 mg/g±0.239 mg/g,与其它植物相比,约为生姜(12.50 mg/g)中含量的一半,高于山楂果(0.933 mg/g)中的含量[15, 16]。可见野生地木耳中总黄酮含量比较丰富,食用野生地木耳对人体有很好的保健作用,有研究发现黄酮类化合物对治疗糖尿病具有一定的作用[17]。
3)野生地木耳中总生物碱的含量为0.768 mg/g±0.073 mg/g,与一些中药材相比,远低于中药材半夏(4.006 mg/g)中的含量,略高于云南省人工栽培的铁皮石斛总生物碱含量(0.190 mg/g~0.430 mg/g)[18]。野生地木耳中所含生物碱种类尚不明确,但其含量较少,对于野生地木耳的食用和药用价值几乎不会产生影响。
4)缩合单宁广泛存在于植物和日常的食物中,食物中缩合单宁过量会产生一些抗营养作用,影响人体对蛋白质、维生素和矿物质的吸收利用,并且对人体健康也有一定的危害。例如人若摄食超过1.5 mg/g缩合单宁的蚕豆,就会显著降低铁的吸收;远东地区的槟榔含缩合单宁达110 mg/g~260 mg/g,导致嗜食槟榔者的食管癌、口腔癌患病率高发[19]。过量的缩合单宁往往也给食品带来较重的涩味。野生地木耳本身蛋白质、维生素和矿物质含量丰富,本实验结果显示,野生地木耳中含有极微量的缩合单宁,仅为0.069 mg/g±0.009 mg/g,几乎不会影响其自身的营养价值和口感,也不会对其它食物中蛋白质、维生素和矿物质的吸收产生影响。
本文综合比较野生地木耳与4种日常食用菌藻,野生地木耳的总酚和总黄酮的含量处于较高水平,且总酚是野生地木耳中的主要次生代谢产物,野生地木耳中的单宁与总生物碱含量均低于样品中其它菌藻或与个别菌藻含量相差不多。总酚和总黄酮类物质中,有许多是对人体有益的物质,如茶多酚、类黄酮、异黄酮等。因此,野生地木耳中对人体有益的的天然活性物质的含量高于这些日常食用的菌藻,具有较高的食用和保健价值,对野生地木耳中总酚和总黄酮类物质也有一定的开发利用前景。
参考文献:
[1]王 捷. 念珠藻属(蓝藻)的分类及分子系统研究[D]. 太原:山西大学. 2011.
[2]鄢贵龙, 纪丽莲, 韩铭海, 等. 地皮菜营养成分分析与评价[J].营养学报, 2010, 32(1): 97-98.
[3]李敦海, 刘永定. 近十年中国地木耳研究概况[J]. 水生生物学报. 2003, 27(4): 408-412.
[4]Sakamoto T, Yoshida T, Arima H, et al. Accumulation of trehalose in response to desiccation and salt stress in the terrestrial cyanobacteriumNostoccommune[J]. Phycological Research, 2009, 57: 66-73.
[5]Arima H, Horiguchi N, Takaichi S, et al. Molecular genetic and chemotaxonomic characterization of the terrestrial cyanobacteriumNostoccommuneand its neighboring species[J]. FEMS Microbiol Ecol, 2012, 79(1): 34-45.
[6]Ninomiya M, Satoh H, Yamaguchi Y, et al. Antioxidative activity and chemical constituents of edible terrestrial algaNostoccommuneVauch.[J]. Biosci Biotechnol Biochem, 2011, 75(11), 2175-2177.
[7]董妍玲, 潘学武. 植物次生代谢产物简介[J]. 生物学通报, 2002, 37(11): 17-18.
[8]张 威. 地木耳天然活性物质的筛选及活性研究[D]. 兰州:兰州大学, 2007.
[9]李巨秀, 王柏玉. 福林-酚比色法测定桑椹中总多酚[J].食品科学, 2009, 30(18): 292-295.
[10]厉荣玉, 钱森和, 董 群, 等. 地木耳总黄酮提取及抑菌作用[J].皖南医学院学报, 2012, 31(3): 186-190.
[11]秦彦杰, 张玉红, 王 洋, 等. 黄檗中生物碱含量的高效液相色谱分析[J]. 林产化学与工业, 2004, 24(S1): 115-118.
[12]中国科学院上海植物生理研究所, 上海市植物生理学会.现代植物生理学实验指南[M].北京: 科学出版社, 2004: 224-225.
[13]王 华, 曹 婧, 翟丽娟, 等. 猕猴桃果肉提取物抗氧化活性研究[J]. 华北农学报, 2013, 28(2): 144-149.
[14]胡君萍, 杨建华, 王新玲. 新疆沙枣果实不同部位总酚的含量测定[J].食品科学, 2010, 31(6): 220-222.
[15]莫开菊, 程 超, 黄 鹏.生姜黄酮提取纯化及结构的初步鉴定[J]. 食品科学, 2005, 26(9): 229-233.
[16]回瑞华, 侯冬岩, 刘晓媛, 等. 山楂果中黄酮化合物的光谱分析及抗氧化性能测定[J].食品科学, 2006, 27(1): 199-202.
[17]程丽艳, 史 红. 10种黄酮类化合物对糖尿病致病机制中重要通路的抑制作用[J]. 中国新药杂志, 2010, 19(9): 793-796.
[18]邬浩杰. 半夏总生物碱的含量测定[J]. 海峡药学, 2010, 22(3): 69-71.
[19]阮志平. 植物单宁与健康[J]. 中国食物与营养, 2006(8): 48-50.
——“单宁”

