胶红酵母利用番茄渣和豆粕为原料发酵生产类胡萝卜素的研究
俞国伟, 魏 春, 张艳丽, 汪 钊
(浙江工业大学 生物与环境工程学院, 杭州 310000)
类胡萝卜素(Carotenoids)是广泛存在于自然界中的不溶于水的多烯色素,颜色呈黄色、橙红色或红色,由绿色植物和某些真菌、酵母、细菌等产生。其中大多数为 40 个碳原子左右近似对称萜烯,主体结构单元是异戊二烯。饮食研究结果表明:类胡萝卜素除具有转化为维生素A的生物活性外,还具有预防癌症和心血管疾病等多种生理功能[1-2]。2005年世界市场用于食品、化妆品、医药方面的类胡萝卜素就达1.3亿美元,其纯的天然制品售价已达2000美元/kg[3]。
由于当今社会的消费者对于食品、药品天然、无毒无害的品质的追求,化学法生产的类胡萝卜素逐渐受到质疑,微生物发酵法生产类胡萝卜素是该产品生产工艺的发展趋势。然而,微生物体内的类胡萝卜素积累量有其自身的代谢限制,且普遍偏低。因此,寻求廉价的农产品或其废弃物作为微生物发酵的原料是非常重要的。
番茄渣是番茄酱生产工业的下脚料,主要由番茄皮和少量的番茄籽组成,其化学成分主要为原果胶。原果胶是果胶与纤维素形成的高聚物。若能用纤维素酶将番茄渣水解,则不仅能得到低分子糖类物质,还能得到游离果胶。
番茄渣作为发酵原料方面的可行性,前人做过许多探索,Avelino等人考查了不同浓度的纤维素酶添加量对番茄渣糖化效率的影响,发现番茄渣经过适当浓度的纤维素酶酶促水解后可以产生葡萄糖、果糖、木糖、纤维二塘等寡糖,其后利用番茄渣水解得到的浆液培养白地霉,得到了理想的效果[4]。Haddadin等人运用两步发酵法,先将里氏木霉接种于番茄渣中,利用其生长过程中产生的纤维素酶水解番茄渣,使之糖化,而后再接种谢氏丙酸杆菌,发酵生产维生素B12,并对涉及发酵的多个因素做了组合优化[5]。Hidalgo等人考查了巴斯德梭菌在番茄酱中生长并水解其中的尿苷生产尿嘧啶的相关特性[6]。Freixo等人考查了采绒革盖菌直接利用番茄渣作为唯一碳源生长,并且同时生产漆酶和木聚糖酶。经过酶的分离纯化与酶活性质研究,发现二者的比酶活和催化性能都很令人满意[7]。
研究表明,番茄的果肉、果皮具有被微生物利用的潜在价值,尤其本研究所采用的菌种——胶红酵母,具有同化果胶的能力,番茄渣经过纤维素酶酶促水解所得到的寡糖、果胶对于胶红酵母而言都是很好的碳源。本研究拟采用番茄渣、豆粕作为胶红酵母的碳源、氮源。将原材料预先用纤维素酶水解,目的在于将番茄渣、豆粕中的高分子原果胶、纤维素水解成为可被胶红酵母利用营养物质,尤其对豆粕而言,其蛋白质会在纤维素结构破坏之后大量释放出来,这样可以提高胶红酵母对豆粕氮源的利用率。
1 材料与方法
1.1 菌种
胶红酵母野生型菌株RhodotorulamucilaginosaWZW003是本实验室保藏的菌株。
1.2 试剂
蛋白胨的规格为BR,MgSO4·7H2O,NaOH,HCl,二甲基亚砜以及乙醚的规格皆为AR。
纤维素酶购自浙大百川生物食品技术有限公司。
豆粕购自浙江省衢州市柯城宏源饲料厂。
番茄渣由市售番茄自制得到,市售番茄购自杭州市下城区德胜农贸市场。
1.3 农产品原料酶解方法
称取一定量的番茄渣和豆粕,再加入一定量的纤维素酶和50 mL水,将体系置于60℃下搅拌。
1.4 培养基与培养方法
胶红酵母液态培养的种子培养基成分为:葡萄糖,45 g/L;蛋白胨,15 g/L;MgSO4·7H2O,6 g/L;用1 mol/L的NaOH溶液将pH值调整至5.0±0.1;装入250 mL三角瓶,装液量40 mL。
发酵培养基以农产品原料的酶解液为主,用1 mol/L的NaOH溶液或HCl溶液将pH调整至一定的数值;装入250 mL三角瓶,装液量50 mL。
各种培养基在接种前皆采用高压蒸汽灭菌,121℃持续20 min。
先将胶红酵母的试管斜面菌落接种至种子培养基,并将其置于摇床上,以30℃、150 r/min培养2 d;而后将种子培养基以10%(V)的接种量接种至发酵培养基,以相同的培养条件培养3 d。
1.5 发酵液预处理方法
将发酵液倒入50 mL离心管中,以10000 r/min离心10 min,弃去上清液,将剩下的沉淀与离心管一同放入-18℃冰箱预冻,待其结冰后再放入-30℃冻干机中进行冷冻干燥,时间持续3 d。
1.6 类胡萝卜素提取方法
取出冻干后的发酵液固形物(菌体与残余的番茄渣、豆粕),称重并记录。
色素提取方法参照文献[8],将发酵液固形物研磨成粉末,加入100 mL二甲基亚砜,60℃下搅拌提取色素,时间持续1 h。
色素萃取方法参照文献[9],量取30 mL色素-二甲基亚砜-固形物混合液,以10000 r/min离心10 min,而后,从中量取20 mL上清液,装入分液漏斗中,再向其中加入40 mL乙醚,将漏斗上下颠倒数次,以促进传质;而后静置,待其分层,排出下层二甲基亚砜相,收集乙醚相;该萃取步骤需要重复数次,直至乙醚相在448 nm处的OD值在±0.005之内;对于特定的固形物样品,汇集其所有的乙醚萃取液,用于下一步的分析。
1.7 总类胡萝卜素分析方法
将紫外-可见分光光度计的波长调至448 nm,用纯的乙醚调零,而后测定色素-乙醚混合液的OD值,并记录。单位质量的固形物中的总类胡萝卜素含量按如下公式计算:
其中,OD448nm为乙醚相在448 nm处的吸光值,V表示萃取结束后的乙醚相的总体积,A表示总类胡萝卜素(近似当作反式β-胡萝卜素作计算,如文献[9]所述)在448 nm处的摩尔消光系数,取值为2659,P表示用于提取色素的固形物重量;n为换算因子,在本研究中,100 mL二甲基亚砜提取液中仅有20 mL用于下一步的色素萃取操作,因此换算因子取值为5。
单位体积发酵液中的总类胡萝卜素产量和总类胡萝卜素增量按如下两个公式计算:
总类胡萝卜素产量(mg/L)=发酵产物总类胡萝卜素含量(mg/g固形物)×发酵产物固形物浓度(g/L)
总类胡萝卜素增量(mg/L)=总类胡萝卜素产量-番茄渣的总类胡萝卜素含量(mg/g固形物)×番茄渣添加量(g/L)
2 结果与讨论
2.1 逐步单因素优化的结果
2.1.1 纤维素酶添加量的优化
将番茄渣添加量、豆粕添加量、酶解时间、培养基初始pH值分别设定为30 g/L,10 g/L,24 h,5.0;不同批次的实验中的纤维素酶添加量分别调整为2、4、6、8和10 g/L。
结果发现,当纤维素酶添加量为8 g/L时,总类胡萝卜素的产量与增量皆最大,分别为2.32 mg/L和1.12 mg/L。如图1所示。
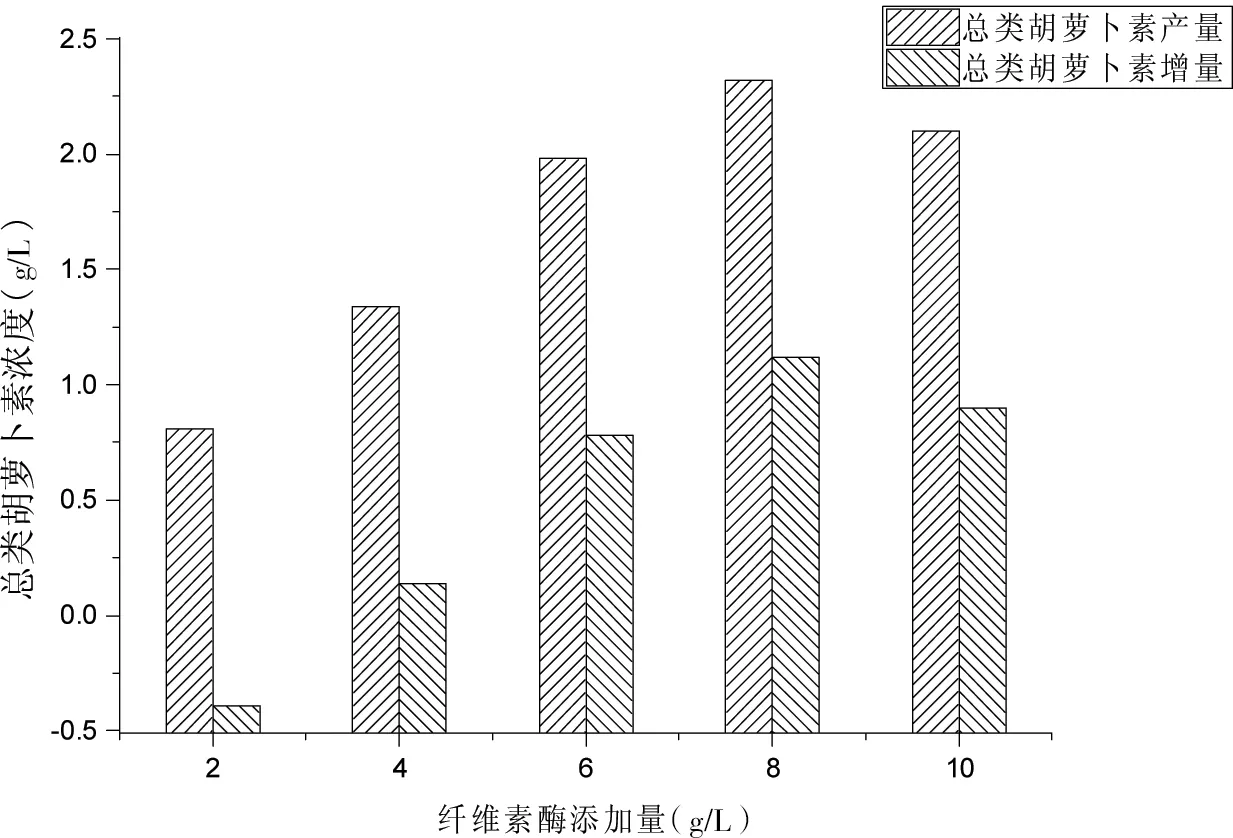
图1 纤维素酶添加量对胶红酵母发酵液中的总类胡萝卜素浓度的影响Fig 1 Effect of additive amount of cellulase on the total carotenoids concentration in the fermentation broth of Rhodotorula mucilaginosa
2.1.2 酶解时间的优化
将番茄渣添加量、豆粕添加量、纤维素酶添加量、培养基初始pH值分别设定为30 g/L,10 g/L,8 g/L,5.0;不同批次的实验中的酶解时间分别调整为12、24、36、48和60 h。
结果发现,当纤维素酶酶解时间为48 h时,总类胡萝卜素的产量与增量皆最大,分别为3.44 mg/L和2.24 mg/L。如图2所示。
2.1.3 番茄渣添加量的优化
将豆粕添加量、纤维素酶添加量、酶解时间、培养基初始pH值分别设定为10 g/L,8 g/L,48 h,5.0;不同批次实验中的番茄渣添加量分别为10、20、30、40和50 g/L。
结果发现,当番茄渣添加量为40 g/L时,总类胡萝卜素的产量与增量皆最大,分别为4.54 mg/L和2.94 mg/L。如图3所示。
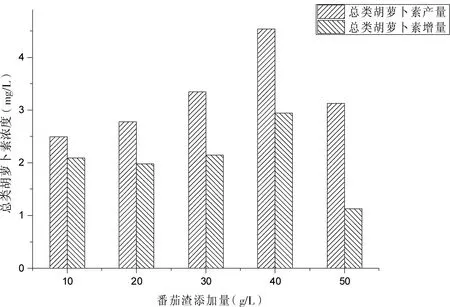
图3 酶解反应中的番茄渣添加量对胶红酵母发酵液中的总类胡萝卜素浓度的影响Fig 3 Effect of additive amount of tomato pomace in enzymatic hydrolysis reactions on the total carotenoids concentration in the fermentation broth of Rhodotorula mucilaginosa

图4 酶解反应中的豆粕添加量对胶红酵母发酵液中的总类胡萝卜素浓度的影响Fig 4 Effect of additive amount of soybean meal in enzymatic hydrolysis reactions on the total carotenoids concentration in the fermentation broth of Rhodotorula mucilaginosa
2.1.4 豆粕添加量的优化
将番茄渣添加量、纤维素酶添加量、酶解时间、培养基初始pH值分别设定为40 g/L,8 g/L,48 h,5.0;不同批次实验中的豆粕添加量分别为10、20、30、40和50 g/L。
结果发现,当豆粕添加量为30 g/L时,总类胡萝卜素的产量与增量皆最大,分别为4.34 mg/L和2.74 mg/L。如图4所示。
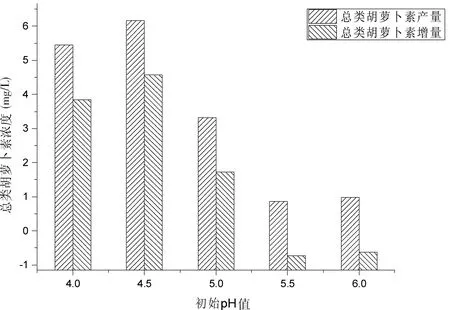
图5 发酵培养基的初始pH值对胶红酵母发酵液中的总类胡萝卜素浓度的影响Fig 5 Effect of initial pH of fermentation media on the total carotenoids concentration in the fermentation broth of Rhodotorula mucilaginosa
2.1.5 培养基初始pH的优化
将番茄渣添加量、豆粕添加量、纤维素酶添加量、酶解时间分别设定为40 g/L,30 g/L,8 g/L,48 h;不同批次实验中的初始pH值分别为4.0、4.5、5.0、5.5和6.0。
结果发现,当培养基初始pH值被调整为4.5时,总类胡萝卜素的产量与增量皆最大,分别为6.17 mg/L和4.57 mg/L。如图5所示。
2.2 均匀设计及其结果
在上一阶段的单因素实验中,总共5个与发酵培养基总类胡萝卜素产量和增量有重要关系因素,即番茄渣添加量、豆粕添加量、纤维素酶添加量、酶解时间以及发酵培养基的初始pH分别得到了优化,至此,总类胡萝卜素产量和增量都得到了很大提升;然而,单因素实验忽略了各个因素之间的交互影响,若选用合适的组合优化方法,则可以进一步考查在各因素同时变动的情况下的目标产量与因素之间的关系,并且使目标产量进一步提升。考虑到胶红酵母所适用的pH范围很窄,不便于在组合优化中设置多个水平,因此,在下一步的实验中选择其它4个因素作为组合优化的项目,将pH固定在单因素优化得到最佳值,即4.5。
均匀设计[10]是部分因子设计的主要方法之一,它是中国数理统计学家方开泰和数学家王元结合数论与多元统计理论而建立起来的一种实验方法,它可以大大减少组合优化中的实验次数,提高效率;相比于正交设计,它尤其适用于因素少、水平多的实验设计。
此处选用四因素九水平的均匀设计(U9*(94)),将番茄渣添加量40 g/L,豆粕添加量30 g/L,纤维素酶添加量8 g/L,酶解时间48 h作为9个水平中的中心水平,即第5水平;各因素的真实值变化步长分别为5、5、1、6。U9*(94)均匀设计表、各因素的真实值与水平值的对应关系以及相应的实验结果如表1所示。
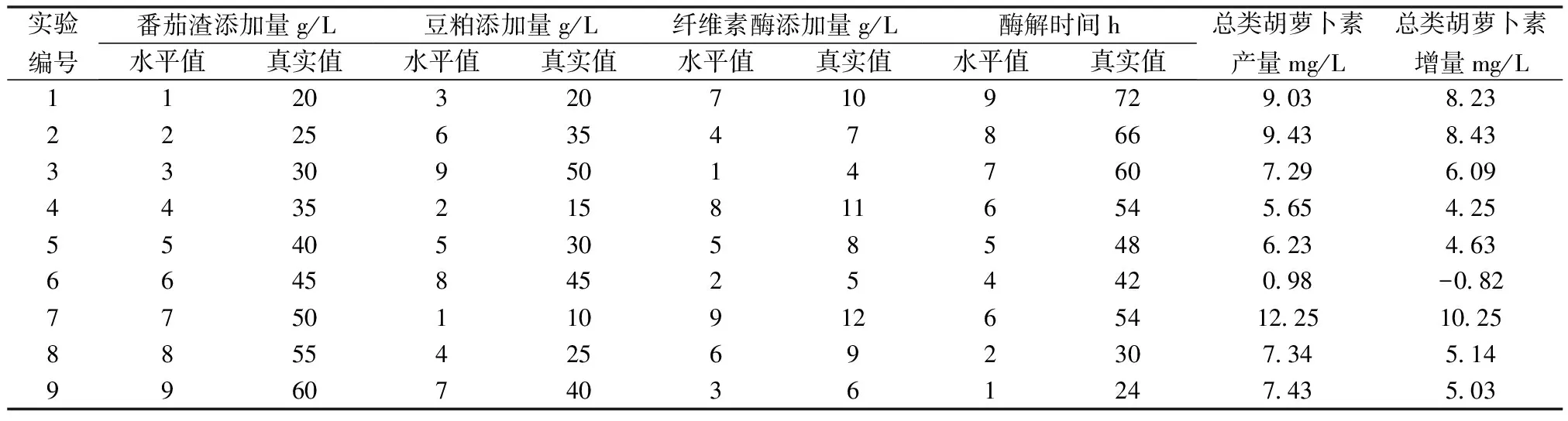
表1 均匀设计表与实验结果
结果发现,当番茄渣添加量为50 g/L,豆粕添加量为10 g/L,纤维素酶添加量为12 g/L,酶解时间为54 h时,总类胡萝卜素产量和增量分别为12.25 mg/L、10.25 mg/L,分别为本研究中所有的相应实验结果中的最大值。
3 讨论
为了寻求适用于类胡萝卜素发酵生产的低成本原料,近10年来,人们做过多方面尝试和努力。Buzzini等人在摇瓶规模上用葡萄汁、葡萄糖浆、甜菜糖浆、豆粉提取物、玉米粉提取物分别培养粘红酵母、胶红酵母、深红酵母,对它们所产的类胡萝卜素做了定量分析。最终发现,粘红酵母用葡萄汁作为唯一碳源培养粘红酵母,经过120 h的分批发酵后可获得最大的总类胡萝卜素产量为5.95 mg/L发酵液[11]。Tinoi等人用粉丝工厂的两种常见废弃物——绿豆粉、甘薯粉的硫酸水解产物分别作为粘红酵母的氮源、碳源,并优化了摇瓶培养过程的重要参数,发现在最优条件下得到的总类胡萝卜素浓度为(3.48±0.02) mg/L[9]。Aksu等人在2005年、2007年分别报道了胶红酵母、粘红酵母在摇瓶规模上发酵生产类胡萝卜素的过程受pH值、温度、初始碳源(葡萄糖、糖蜜蔗糖、乳清乳糖,3种不同碳源)浓度、初始硫酸铵浓度、表面活性剂(棉籽油和吐温-80)浓度的影响。结果发现,吐温-80对胶红酵母的总类胡萝卜素产量没有促进作用,棉籽油只有在葡萄糖作为碳源且浓度较低的情况下才对产量有轻微的促进作用。实验过程中胶红酵母的最高的类胡萝卜素产量为89.0 mg/L[12]。粘红酵母受表面活性剂和棉籽油的影响与胶红酵母非常相似。实验可获得的胶红酵母的总类胡萝卜素最大产量为125 mg/L[13]。 Valduga等人在摇瓶水平上采用完全二阶设计优化掷孢酵母利用工业废弃物甘蔗糖蜜、玉米浆、酵母膏(预先用硫酸水解)为营养源,生产类胡萝卜素的产量。发现在最优条件下可获取总类胡萝卜素最大产量541.5 μg/L[14]。Malisorn等人在2008年、2009年分别考查了粘红酵母利用萝卜泡菜工厂的废弃卤水作为唯一营养源进行分批发酵、连续发酵生产β-胡萝卜素的特性,并做了相应的优化。发现在分批发酵下所获得的最大β-胡萝卜素产量为201 μg/L[15];在连续发酵下所获得的最大β-胡萝卜素产量为186 μg/L[16]。Saenge等人用含有50%甘油的生物柴油工厂废水作为粘红酵母的唯一碳源,采用响应面法分析各个主要因素对胞内油脂和类胡萝卜素含量的影响,发现碳氮比和甘油浓度有较大影响。实验过程中获得的最高脂质产量和最高总类胡萝卜素产量分别为6.05 g/L和135.25 mg/L[17]。Marova等人考查了酵母膏、乳清、马铃薯浸膏、无机盐、过氧化物等物质对多种红酵母的生长和β-胡萝卜素产量的影响。最终发现,粘红酵母在乳清培养基中可获得46 mg/L β-胡萝卜素;胶红酵母在含有马铃薯浸膏和5%无机盐的培养基中可获得56 mg/L β-胡萝卜素[18]。
在本研究中,经过一系列的优化,胶红酵母利用番茄渣和豆粕的酶解产物发酵得到的总类胡萝卜素产量以及扣除了番茄渣中总类胡萝卜素之后计算得到的总类胡萝卜素增量分别达到了12.25 mg/L和10.25 mg/L,相比于前人利用废弃资源培养红酵母属菌种生产类胡萝卜素的产量,这个结果比较理想,并且有希望在发酵罐规模上借助于溶氧条件的改善而进一步提高总类胡萝卜素产量。本研究为胶红酵母利用番茄渣和豆粕的酶解产物生产富含类胡萝卜素的单细胞蛋白的可行性奠定了基础,并且为微生物利用农产品废弃物的水解液发酵生产高附加值食品添加剂的路线选择提供了参考。
参考文献:
[1]王伟杰,徐昌杰. 天然类胡萝卜素生物合成与生物技术应用[J]. 细胞生物学杂志, 2006, 28: 839-843.
[2]Rock C L. Carotenoids: biology and treatment[J]. Pharmacol Therapeut, 1997, 75:185-197.
[3]Cheon L P, Claudia S D. Metabolic engineering towards biotechnological production of carotenoids in microorganisms[J]. Appl Biochem Biotech, 2002, 60:1-11.
[4]Avelino A, Avelino H T, Roseiro J C, et al. Saccharification of tomato pomace for the production of biomass[J]. Bioresource Technol, 1997, 61:159-162.
[5]Haddadin M S Y, Abu-Reesh I M, Haddadin F A S, et al. Utilisation of tomato pomace as a substrate for the production of vitamin B12-a preliminary appraisal[J]. Bioresource Technol, 2001, 78:225-230.
[6]Hidalgo A, Pompei C, Galli A. Uracil evolution in tomato pulp inoculated with different microbial strains during a long incubation time[J]. Food Chem, 2007, 104:1327-1332.
[7]Freixo M R, Karmali A, Frazǎo C, et al. Production of laccase and xylanase fromCoriolusversicolorgrown on tomato pomace and their chromatographic behaviour on immobilized metal chelates[J]. Process Biochem, 2008, 43:1265-1274.
[8]Chandi G K, Singh S P. Optimization of carotenoids byRhodotorulaglutinis[J]. Food Sci Biotechnol, 2010, 19(4): 881-887.
[9]Tinoi J, Rakariyatham N, Deming R L. Simplex optimization of carotenoid production byRhodotorulaglutinisusing hydrolyzed mung bean waste flour as substrate[J]. Process Biochem, 2005, 40:2551-2557.
[10]方开泰, 马长兴. 正交与均匀实验设计[M]. 北京:科学出版社, 2001.
[11]Buzzini P, Martini A. Production of carotenoids by strains ofRhodotorulaglutiniscultured in raw materials of agro-industrial origin[J]. Bioresource Technol, 1999, 71:41-44.
[12]Aksu Z, Eren A T. Carotenoids production by the yeastRhodotorulamucilaginosa: use of agricultural wastes as a carbon source[J]. Process Biochem, 2005, 40:2985-2991.
[13]Aksu Z, Eren A T . Production of carotenoids by the isolated yeast ofRhodotorulaglutinis[J]. Biochem Eng J, 2007, 35:107-113.
[14]Valduga E, Valério A, Treichel H, et al. Study of the bio-production of carotenoids bySporidiobolussalmonicolor(CBS 2636) using pre-treated agro-industrial substrates[J]. J Chem Technol Biotechnol, 2008, 83:1267-1274.
[15]Malisorn C, Suntornsuk W. Optimization of b-carotene production byRhodotorulaglutinisDM28 in fermented radish brine[J]. Bioresource Technol, 2008, 99:2281-2287.
[16]Malisorn C, Suntornsuk W. Improved β-carotene production ofRhodotorulaglutinisin fermented radish brine by continuous cultivation[J]. Biochem Eng J, 2009, 43:27-32.
[17]Saenge C, Cheirsilp B, Suksaroge T T, et al. Potential use of oleaginous red yeastRhodotorulaglutinisfor the bioconversion of crude glycerol from biodiesel plant to lipids and carotenoids[J]. Process Biochem, 2011, 46:210-218.
[18]Marova I, Carnecka M, Halienova A, et al. Use of several waste substrates for carotenoid-rich yeast biomass production[J]. J Environ Manage, 2012, 95:S338-S342.

