明胶纳米银的一锅式合成及其高效催化性能的研究
孙宗招,李帅,张宁,董敏敏,冯路平,许玉娇,王桦
(曲阜师范大学化学与化工学院,山东省生命有机分析重点实验室,山东曲阜273165)
0 引言
由于过氧化物酶具有高效、专一的催化性能和温和的反应条件[1],一直被广泛应用于多种有机底物的酶促反应体系和生化检测领域[2]。然而,常见的蛋白类过氧化物酶,如辣根过氧化物酶(HRP),在生物标记和酶联免疫分析过程中,存在易受外界环境条件的影响而失去活性问题,加之其昂贵的价格以及苛刻的储存条件,大大限制了其在催化以及传感检测领域的广泛应用。因此,寻找探索能够替代蛋白酶的模拟酶和高效的酶促反应体系以拓展其潜在的应用前景仍然是当今酶催化反应领域的研究热点[3~14]。
随着纳米技术的高速发展,纳米材料在催化研究领域的应用取得了一系列的研究成果[3~4]。许多具有类过氧化物酶活性的纳米粒子不仅拥有纳米小尺寸效应,巨大比表面积,表面活性中心多等诸多特性,而且具有极强的酶催化反应活性与催化效率。例如,中科院生物物理研究所阎锡蕴研究小组首次报道了具有内在过氧化物模拟酶活性的磁性氧化铁纳米粒子[5]。其后,各种各样类酶催化活性的纳米功能材料的研究雨后春笋般涌现,包括:碳纳米管[6],碳点[7],氧化石墨烯[8],双金属合金纳米结构材料[9],二氧化铈纳米粒子[10],片状和球状FeS纳米结构材料[11],小尺寸金纳米粒子[12],血红素-石墨烯杂交纳米复合物[13],以及牛血清白蛋白稳定化的金纳米簇[14]等。这些类过氧化物酶不仅制备简单、廉价、稳定性高,而且具有抗变性和酶解特性,使其在酶催化应用中比天然酶更具优势。
明胶是一种最常用的天然生物高分子,主要成分是胶原蛋白,已广泛应用于食品和药品[15~16]。明胶具有可生物降解、无毒、和高生物相容性,特别是具有独特的溶胶-凝胶转换(临界转换温度35℃)特性。以明胶作为稳定剂和保护剂合成纳米颗粒已有报道[17~19]。例如,Oluwatobi等[17]和Mahmoud等[18]分别利用明胶结合麦芽糖和柠檬酸钠合成了小粒径的纳米银。Kim研究组[19]结合电浆过程合成了抗白念珠菌的明胶纳米银。然而,这些方法大多需另加入还原剂,同时所合成的纳米银均未提及具有类过氧化物酶的催化特性。
研究工作以明胶为稳定剂和还原剂,直接一锅式反应合成了具有过氧化物酶催化活性和高储藏稳定性的明胶纳米银。该纳米银模拟酶能在常温下处于凝固状态,可克服常规银合成法中存在的纳米银颗粒物催化活性以及稳定性差等难题。同时,通过应用于常见酶促反应体系系统地考察了其过氧化物酶催化性能,并测定了其催化反应动力学米氏常数,为纳米银模拟酶的催化应用提供了新的理论依据。
1 实验部分
1.1 试剂和仪器
DF-101S集热式恒温加热磁力搅拌器(巩义市科瑞仪器有限公司),FA2004N电子分析天平(上海菁海仪器有限公司),Infinite M 200 PRO酶标仪(瑞士TECAN公司),UV-3600紫外可见光分析仪(日本岛津公司)。
明胶,硝酸银(AgNO3),3,3’,5,5’四甲基联苯胺(TMB),二甲基亚砜(DMSO),柠檬酸(C6H8O7),十二水合磷酸二氢钠(NaH2PO4·12H2O),过氧化氢(H2O2)均购自Sigma公司;实验过程中使用的其它试剂均为分析纯,所用水均为二次蒸馏水。
1.2 纳米银的制备
一定量的AgNO3溶液与不同浓度的明胶水溶液混合,37℃下温育搅拌并避光反应8 h。反应结束后进行产物分离纯化,于4℃冰箱或常温下避光保存备用。
1.3 纳米银的过氧化物酶活性的测试
不同条件下制备的一定量(例如,72 μmol/L)纳米银加入到按一定比例配置的不同浓度的TMB和H2O2酶促反应混合液中,于室温下反应不同时间(例如,20 min),然后在波长652 nm处测量其相应吸光度值。
2 结果与讨论
为探究合成明胶纳米银的最适反应条件,该实验分别考察了不同硝酸银的用量,明胶的用量,反应温度,反应pH值以及反应时间的影响,通过将各种纳米银产物应用于TMB-H2O2酶促反应体系并测定其催化产物的吸光度值,系统地研究了纳米银最优的合成反应条件。
2.1 不同明胶用量对合成纳米银的影响
采用固定量的AgNO3(20 mmol/L,0.2 mL)分别与不同质量分数(1%,2%,3%,4%,5%)明胶进行反应,并测定了合成的纳米银产物的UV光谱,结果如图1所示。由此可知,以不同浓度明胶合成的纳米银的最大UV吸收峰的位置基本一致(450 nm),表明制得的纳米银颗粒尺寸大小相近,但以4%明胶合成的纳米银其UV吸收峰值最大,即反应获得的纳米银的产率最高。此外,将所合成的纳米银分别用于TMB-H2O2酶促反应体系,并测量催化反应产物的吸光度值(图2),结果表明,以4%明胶用量合成的纳米银催化产物的吸光度值最大,证明其催化H2O2氧化TMB的能力最大。因此,纳米银合成反应中最佳明胶的用量为4%。
2.2 不同的AgNO3用量对合成纳米银的影响
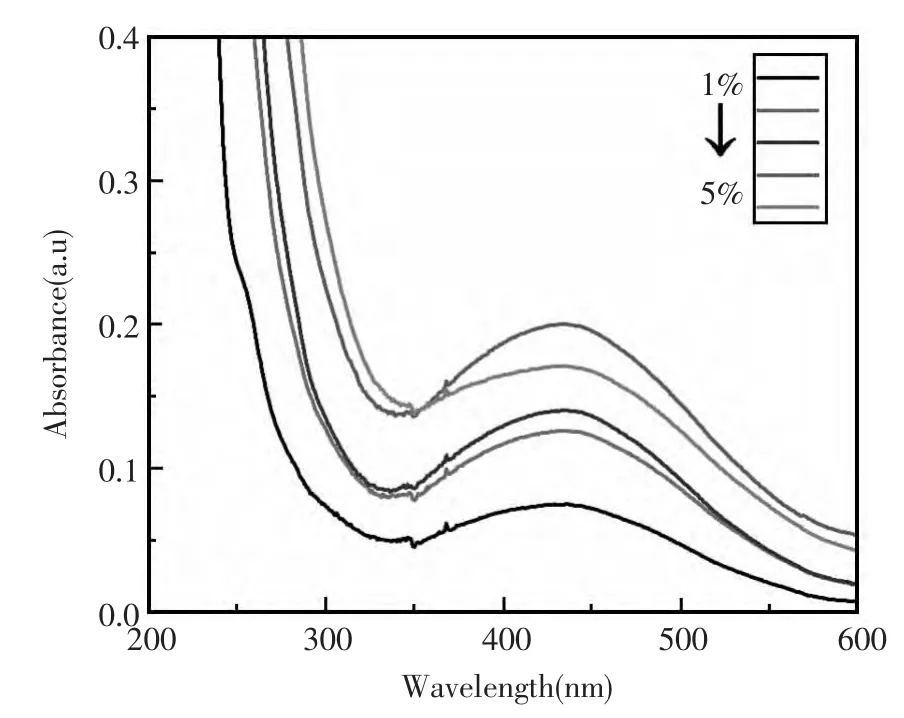
图1 不同用量的明胶合成的纳米银的紫外可见光谱反应条件:20 mmol/L AgNO3分别与1%,2%,3%,4%,5%明胶混合,于37℃下温育搅拌,避光反应8 hFig.1 UV-vis spectraums of silver nanoparticles synthesised by different dosage of gelatin Reaction conditions:AgNO3(20 mmol/L)to be sepatrately mixed with 1%,2%,3%,4%,5%gelatin,incubated and stirred for 8 h at 37℃under the light-shaded condition
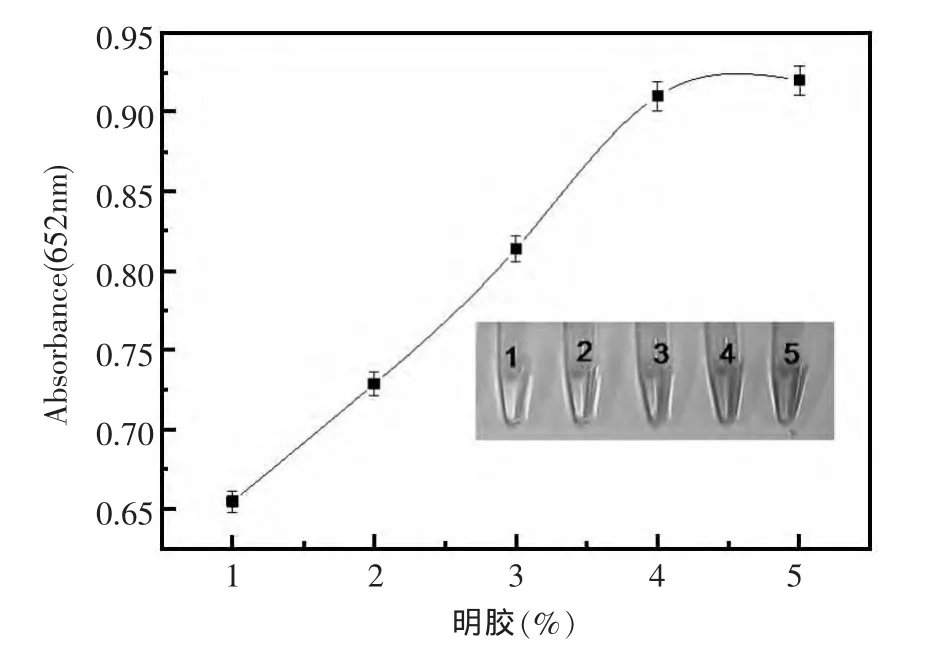
图2 不同的明胶用量合成的纳米银的催化性能反应条件:72 μmol/L不同纳米银,4.0×10-4mol/L TMB和9.0 mmol/L H2O2,室温下反应20 minFig.2 The catalytic activities of silver nanoparticles synthesised by different dosage of gelatin.(Inset shows the color changes of TMB-H2O2reactions catalyzed by silver nanoparticles)Reaction conditions:72 μmol/L silver nanoparticles,4.0×10-4mol/L TMB,9.0mmol/L H2O2,mixed at room temperature for 20 min
实验采用固定量的4%明胶与不同量的AgNO3反应,并对获得的纳米银产物进行UV光谱分析(图3)和催化反应产物的检测(图4)。首先,由图3可知,以不同浓度AgNO3合成的纳米银其UV吸收峰的形状以及最大吸收峰的位置与面积有一定差别,反映对应的纳米银颗粒的大小、形成量和光学性质的差异性,其中,以6.67 mmol/L AgNO3合成的纳米银的UV吸收峰面积较大,而以5.71 mmol/L AgNO3制备的纳米银的吸收峰最高。其次,由图4可知,不同条件下合成的纳米银对TMB-H2O2体系的催化反应能力的差别也较大,当AgNO3的使用浓度达5.71 mmol/L后,其催化能力趋于最大,继续增加AgNO3的使用浓度,产物对TMB-H2O2体系催化反应的能力变化不大。鉴此,实验选择5.71 mmol/L AgNO3为合成纳米银的最优浓度。
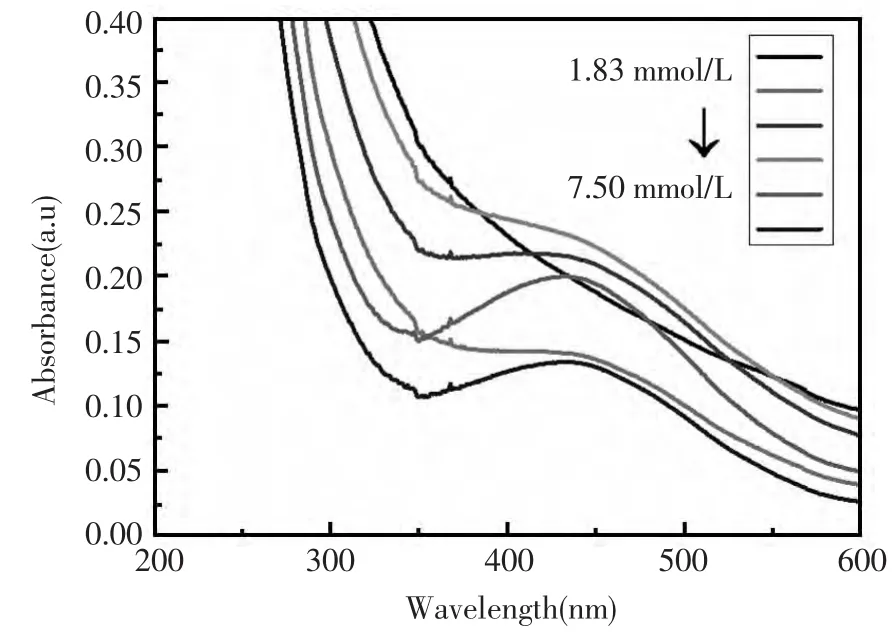
图3 不同用量AgNO3合成的纳米银的紫外可见光谱反应条件:4%明胶分别与1.82 mmol/L,3.33 mmol/L,4.62 mmol/L,5.71 mmol/L,6.67mmol/L,7.50 mmol/L AgNO3混合,于37℃下温育搅拌并避光反应8 hFig.3 UV-vis spectraums of silver nanoparticles synthesized by different dosage of AgNO3 Reaction conditions:4%gelatin separately mixed with 1.82 mmol/L,3.33 mmol/L,4.62 mmol/L,5.71 mmol/L,6.67 mmol/L and 7.50 mmol/L AgNO3,incubated and stirred for 8 h.at 37℃under the light-shaded condition
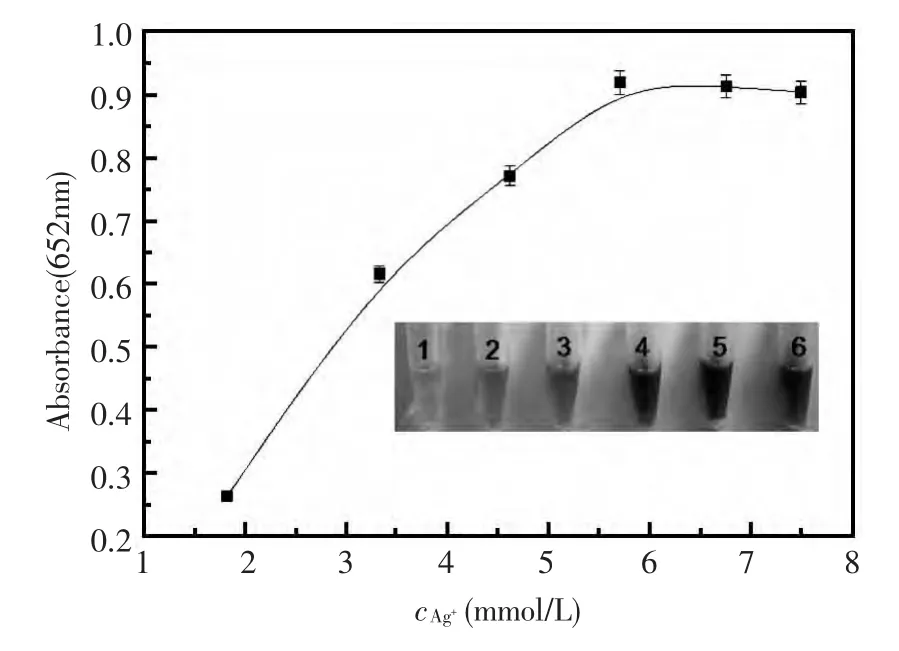
图4 不同AgNO3用量合成的纳米银的催化性能反应条件:同图2Fig.4 The catalytic activities of silver nanoparticles synthesised by different dosage of AgNO3.(Inset shows the color changes of TMB-H2O2reactions catalyzed by silvernanoparticles)Reaction conditions:the same as in Fig.2
2.3 其它反应条件(温度、pH、时间)对合成纳米银的影响
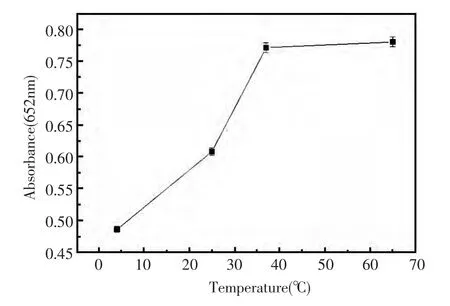
图5 不同温度下合成的纳米银的催化性能反应条件:合成时,4%明胶与5.71 mmol/L AgNO3混合,于不同温度(4℃,25℃,37℃,65℃)下温育搅拌并避光反应8 h;催化反应条件同图2Fig.5 The catalytic activities of silver nanoparticles synthesised under different temperatures Reaction conditions:4%gelatin mixed with 5.71 mmol/L AgNO3,incubated at different temperature(4℃,25℃,37℃,65℃)under the light-protected condition and stired for 8 h;the catalytic reaction conditions as in Fig.2
实验考察了温度、pH、时间等反应条件对合成纳米银的影响。首先,采用在不同温度(4℃,25℃,37℃,65℃)下反应合成纳米银,并考察了其对TMB-H2O2体系的催化能力,结果如图5所示。由图5可知,纳米银的最佳合成反应温度以37℃最佳并与人生理体温一致。其次,实验研究了在不同pH下合成的纳米银对TMB-H2O2体系的催化反应情况(图6),结果表明,以中性或弱酸/弱碱的反应条件较优。最后,实验进一步考察了不同的反应时间对合成纳米银的影响。图7显示了制得的纳米银对TMB-H2O2催化反应体系催化结果,由此可知,合成反应进行8 h后合成反应即可完成,所得到的纳米银产物的催化效率达到最大化。
综上所述,根据酶催化效率最大化的标准,合成明胶纳米银的最优反应条件为:4%明胶,5.71 mmol/L AgNO3,于中性或弱酸弱碱条件下,在37℃避光反应8 h。
2.4 纳米银的储藏稳定性考察
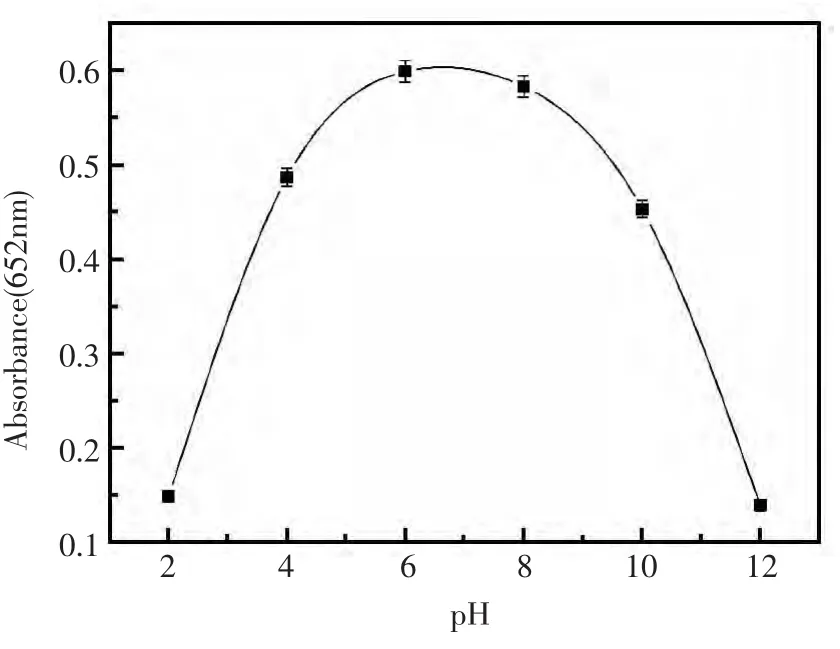
图6 不同pH值下合成的纳米银的催化性能反应条件:合成时,4%明胶与5.71 mmol/LAgNO3混合,于37℃和不同pH值(2.0,4.0,6.0,8.0,10.0,12.0)下温育搅拌并避光反应8 h;催化反应条件同图2Fig.6 The catalytic activities of silver nanoparticles synthesised at different pH values Reaction conditions:4%gelatin mixed with 5.71 mmol/L AgNO3,incubated at 37℃and different pH values(2.0,4.0,6.0,8.0,10.0,12.0);the catalytic reaction conditions as in Fig.2

图7 不同反应时间下合成的纳米银的催化性能反应条件:合成时,4%明胶与5.71 mmol/L AgNO3混合,于37℃和pH7.0以及不同反应时间(4,6,8,10,12 h)下温育搅拌并避光反应8 h;催化反应条件同图2Fig.7 The catalytic activities of silver nanoparticles synthesised at different reaction time Reaction conditions:4%gelatin mixed with 5.71 mmol/L AgNO3,incubated at 37℃,pH7.0 and different time(4,6,8,10,12 h);the catalytic reaction conditions as in Fig.2
目前,蛋白类过氧化物酶虽然催化活性高,但易于受环境条件干扰而失活。此外,常见方法合成的纳米银尚存在稳定性较差的问题。该文考察了所制得的纳米银的稳定性。将纳米银置放于室温或4℃冰箱避光保存,每隔一段时间(2个月)取出一定量纳米银,并采用TMB-H2O2酶促反应体系考察其催化活性,结果如图8所示。由此可知,纳米银经储藏12个月,其催化活性仍变化不大,呈现极高的稳定性。

图8 明胶纳米银催化活性的稳定性反应条件:72 μmol/L纳米银(每隔2个月取出),其它条件同图2Fig.8 The catalytic activities of silver nanoparticles stored at different months Reaction conditions:72 μmol/L silver nanoparticles(taken out every two months),the rest as in Fig.2
众所周知,酶催化反应的表观稳态常数Km值是酶的特征性常数,只与酶的性质、酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,而与酶的浓度无关。一般地,催化反应的Km值愈大,酶与底物的亲和力愈小,反之则亲和力愈大,而酶与底物亲和力大,表示不需要很高的底物浓度,便可容易地达到最大反应速度[20]。为了更进一步阐明该纳米银模拟酶的催化性能和反应动力学,研究了纳米银模拟酶对催化反应底物的表观稳态动力学,并采用米氏方程的双倒数作图法,对其Km值进行了测定分析(即Lineweaver-Burk plot,也可称为双倒数方程)。将1/V对l/[c]作图得到一条直线,该直线在Y轴的截距即为1/Vmax,在X轴上的截距即为1/Km的绝对值[21]。其中V是反应速率,c是底物浓度。由此获得的测定结果如图9所示。
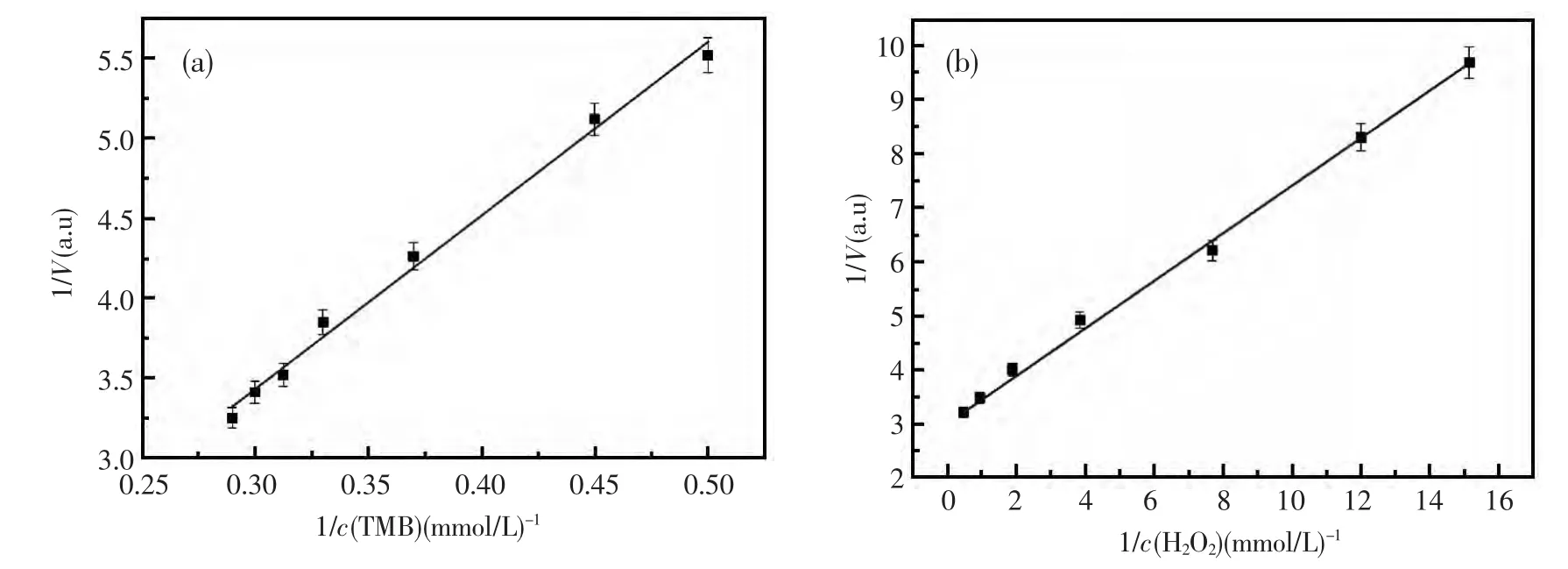
图9 明胶纳米银的催化反应动力学的考察(a)TMB;(b)H2O2Fig.9 Investigation of Michaelis reaction dynamics of(a)TMB and(b)H2O2catalysized by silver nanoparticles
根据图9求得的纳米银模拟酶对各底物的Km值,发现当以H2O2为底物时,纳米银对应的Km为50.12 mmol/L,而以TMB为底物时,纳米银对应的Km为0.15 mmol/L。将之与文献[5]中HRP对H2O2的Km值(3.7 mmol/L)和TMB的Km值(0.43 mmol/L)作比较,发现纳米银对H2O2底物Km比HRP的高,表明需要较高浓度H2O2以获得最大反应速度;而纳米银对TMB底物的对应Km比文献[5]报道的HRP的要低,表明相对于HRP该纳米银对底物TMB具有更高的亲和力,即需要较低的TMB浓度以达到最大反应速度。以上结果表明,该明胶纳米银具有与常规过氧化物酶(如HRP)相比拟的催化性能。
3 结论
该文利用明胶的稳定性和还原性、特别是其独特的溶胶-凝胶的转换(温度35℃)特性,发展了绿色的一锅式反应合成具有类过氧化物酶催化性能的纳米银模拟酶。通过采用TMB-H2O2体系对其反应催化底物的动力学米氏常数的测定,表明了纳米银在过氧化氢检测方面较常见蛋白酶(如HRP)的优越性。此外,由于明胶常温下处于凝固态,大于35℃才溶解成溶胶的奇异特性,使得制备的纳米银模拟酶具有更好的稳定性(如便于保存,不易变质等)。最重要的是,由于明胶外壳含有较多的羧基和氨基等功能基团,不仅可提高纳米银的生物亲和性,而且便于通过这些功能团进行各种化学修饰,从而使其在酶催化体系以及酶传感检测分析方面具有非常广泛的应用前景。
[1]Garrett R H,Grisham C M.In:Biochemistry[M].Philadelphia:Saunders College Publishing,1999.426~427.
[2]刘稳,李杨,高培基,等.过氧化物酶研究进展[J].纤维素科学与技术,2000,8(2):50~64.
[3]Hu X N,Liu J B,Hou S,et al.Research progress of nanoparticles as enzyme mimetics[J].Science China,2011,54(10):1 749~1 756.
[4]Song Y J,Wei W L,Qu X G.Colorimetric biosensing using smart materials[J].Advanced Materials,2011,23(37):4 215~4 236.
[5]Gao L Z,Zhuang J,Nie L,et al.Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J].Nature Nanotechnology,2007,2(9):577~583.
[6]Song Y J,Wang X H,Zhao C,et al.Label-free colorimetric detection of single nucleotide polymorphism by using single-walled carbon nanotube intrinsic peroxidase-like activity[J].Chemistry A European Journal,2010,16:3 617~3 621.
[7]Shi W B,Wang Q L,Long Y J,et al.Carbon nanodots as peroxidase mimeticsandtheir applicationstoglucose detection[J].Chemical Communications,2011,47:6 695~6 697.
[8]Song Y J,Qu K G,Zhao C,et al.Graphene Oxide:Intrinsic Peroxidase Catalytic Activity and Its Application to GlucoseDetection[J].Advanced Materials,2010,22:2 206~2 210.
[9]He W W,Wu X C,Liu J B,et al.Design of AgM bimetallic alloy nanostructures(M=Au,Pd,Pt)with tunable morphology and peroxidase-like activity[J].Chemistry of Materials,2010,22:2 988~2 994.
[10]Pirmohamed T,Dowding J M,Singh S,et al.Nanoceria exhibit redox state-dependent catalase mimetic activity[J].Chemical Communications,2010,46:2 736~2 738.
[11]Dai Z H,Liu S H,Bao J C,et al.Nanostructured FeS as a mimic peroxidase for biocatalysis and biosensing[J].Chemistry A European Journal,2009,15:4 321~4 326.
[12]Jv Y,Li B X,Cao R.Positively-charged gold nanoparticles as peroxidase mimic and their application in hydrogen peroxide and glucose detection[J].Chemical Communications,2010,46:8 017~8 019.
[13]Guo Y J,Deng L,Li J,et al.Hemin-graphene hybrid nanosheets with intrinsic peroxidase-like activity for label-free colorimetric detection of single-nucleotide polymorphism[J].ACS Nano,2011,5:1 282~1 290.
[14]Wang X X,Wu Q,Shan Z,et al.BSA-Stabilized Au Clusters as Peroxidase Mimetics for use in Xanthine Detection[J].Biosensors and Bioelectronics,2011,26:3 614~3 619.
[15]Vonhippel P H,Wong K Y.Neutral Salts:The Generality of Their Effects on the Stability of Macromolecular Conformations[J].Science,1964,145(3632):577~580.
[16]Veis A.The physical chemistry of gelatin[J].International Reviews Connect Tissue Res.1965,3:113~200.
[17]Oluwatobi S Oluwafemi,Yolisa Lucwaba,Akhona Gura,et al.A facile completely‘green’size tunable synthesis of maltose-reduced silver nanoparticles without the use of any accelerator[J].Colloids and Surfaces B:Biointerfaces,2013,102:718~723.
[18]Mahmoud K H,Abbo M.Synthesis.characterization and optical properties of gelatin doped with silver nanoparticles[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2013,116:610~615.
[19]Kim SeongCheol,Kim JungWan,Yoon GookJin,et al.Antifungal effects of 3D scaffold type gelatin/Ag nanoparticles biocomposite prepared by solution plasma processing[J].Current Applied Physics,2013,13:48~53.
[20]Murphy Catherine J,Sau Tapan K,Gole Anand M,et al.Anisotropic Metal Nanoparticles:Synthesis,Assembly,and Optical Applications[J].Journal of Physical Chemistry B,2005,109:13 857~13 870.
[21]Huang Lan,Wang Meng,Zhang Yu,et al.Synthesis of Gold Nanotadpoles by a Temperature-Reducing Seed Approach and the Dielectrophoretic Manipulation[J].Journal ofPhysicalChemistry C,2007,111:16 154~16 160.

