甲基睾酮(MT)和加氢甲基睾酮(MDHT)浸泡法诱导尼罗罗非鱼仔鱼雄性化的对比研究*
陈兴汉,李 波,叶 卫,张 勇
(1.阳江职业技术学院生命科学与技术系,广东 阳江 529566;2.中山大学水生经济动物研究所,广东 广州 510275;3.番禺国家级罗非鱼良种场,广东 广州 511453)
罗非鱼属于鲈形目(Perciformes)、丽鱼科(Cichidae)、罗非鱼属(Oreochromis),具有肉质好、生长快、抗逆性强、养殖成本低以及加工出肉率高等优点,养殖区域已遍布世界 70 多个国家和地区。近年来我国罗非鱼产量和出口量一直稳居世界第1位[1],罗非鱼是我国主要的产业化养殖和世界大宗贸易对象[2]。但制约罗非鱼产业化养殖推广最突出的问题是繁殖泛滥,其性成熟早,一年可繁殖好几代,大大降低了商品鱼的规格,严重浪费养殖资源,而且造成品种混杂,对生态安全有较大威胁[3]。罗非鱼是雄性优势生长种类,雄鱼比雌鱼生长快 40%~50%[4],因此,以单雄性的方式进行推广养殖是稳定高产的前提,其关键技术是“通过性别控制手段以获得雄性化鱼苗”,生产上最常用的是通过雄激素定向诱导。
用激素控制鱼类的性别,在美国、日本、菲律宾,以色列以及我国台湾等国家和地区进行了广泛研究。到目前为止,至少有31种激素在50种鱼类中成功进行定向诱导或诱导性逆转,其中有大约16种雄激素,成功进行雄性化诱导的鱼类有35种[5],应用最广泛的是甲基睾酮(MT),但MT的诱导效果不稳定,主要是因为MT是可芳香化的[6-7],少量的MT不能起到明显提高雄性率的效果,过量反而会使雄性率下降或导致不育[8]。而加氢甲基睾酮(MDHT)的诱导效果比MT更稳定,Piferrer[6]、Gale[9]和Wassermann[10]等学者对尼罗罗非鱼的研究结果都证明了这一点。MDHT 是不可芳香化的[6,9],在鱼体内不会被芳香化酶催化变成雌激素而导致雌性增多,在高 MDHT 剂量处理时,尚未见导致不育的报道。
在处理方式上,目前应用“投喂法”诱导雄性化最为常见,至少已在青鳉、金鱼、鲤、花鳉、斑马鱼、虹鳟、大西洋鲑、大麻哈鱼、罗非鱼等雌雄异体鱼类中获得成功[11]。有学者研究发现:在鱼苗性分化前投喂一段时间的MT都能诱导罗非鱼雄性化[12-14]。投喂法虽有效,但长时间大量使用激素会导致环境污染,极少量残留也会危害人体健康[15-16]。有关“浸泡法”诱导雄性化的研究,国内只有少量浸泡催产或排卵的报道[17-18]、尚未见“浸泡法”诱导雄性化的报道,国外有少量研究报道[9-10,19]。“浸泡法”是在仔鱼发育的特定时期,在专门的容器里进行短时间的集中处理,此法所用激素剂量小,避免了对养殖水体的污染。本研究旨在探索一种简易、稳定又环保的雄激素“浸泡法”诱导尼罗罗非鱼仔鱼雄性化,为生产实践提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验用鱼 尼罗罗非鱼仔鱼取样于广东省国家级罗非鱼良种场(番禺)。选取健壮、无病,卵颗粒大、发亮,卵粒偏黄,鱼体色发红的雌鱼作为母本;同时选择健壮,无病,可以挤出白色精液的雄鱼作为父本。雌雄(1 ∶ 1)饲养于4 m×1.5 m×1.2 m(长×宽×深)水泥池。投喂普通罗非鱼成鱼饲料,保持微流水。雌鱼自行产卵孵化。在仔鱼孵出前 1~2 d,把卵从亲鱼口腔中取出,在孵化装置中孵化。待仔鱼全部孵出后,饲养于规格为40 cm×25 cm×25 cm(长×宽×高)的白色塑料箱中。按孵出后天数(DPH,Days Post Hactching)计,分别于1 DPH(出膜第1天)、7 DPH(卵黄囊消失)和13 DPH时再分组进行试验,每组100尾鱼。所有的鱼池、用品都做常规消毒。
1.1.2 药品和试剂 MT购自Sigama(USA)公司,MDHT为MD(USA)公司产品。计算出一次实验所需MT或MDHT的总剂量,然后称取盛放于一棕色玻璃瓶中(体积约15 mL),再加入分析纯酒精(φ=99%)溶解,使保存剂量为c= 10 μg·μL-1,充分振荡溶解后放入 4 ℃ 冰箱保存,实验时再取用。雌雄性腺鉴别时采用铁醋酸洋红和结晶紫染色。
1.2 实验方法
1.2.1 实验设计 MT和MDHT试验设计采用简单比较法正交试验[20],略作修正。处理时期(Treatment period)分别为1,7,13 DPH,激素剂量(Hormone dose)分别为200,600,1 800,5 400 μg·L-1,持续时间(Treatment duration)分别为 2,4,8 h。每个处理组设两个平行,另设两个自然对照组(Ctr)。激素浸泡处理时,把仔鱼分装于约5 L的玻璃缸后,向每个缸里放一个充气石,保证缸里供氧充足及激素混合均匀。准备开始进行激素浸泡处理时,用加样枪吸取所需体积的MT或MDHT溶液(保存剂量为10 μg·μL-1)加入玻璃缸,以所需体积最大的那个缸为基准,向其它缸里加入相应分析纯酒精(φ=99%),以补充酒精体积差值,消除由于水体酒精剂量不同而带来的误差。处理持续时间结束时,把仔鱼捞出,在清水里洗两遍,然后转到规格为50 cm×50 cm×50 cm 的网箱中。网箱悬挂于水泥池中,保持微流水,每天清洗网箱一次,每天投喂鳗鱼饲料3次。饲养至60 DPH,存活的鱼全部进行性别检测。
1.2.2 性别检测 待鱼饲养至60 DPH时,通过性腺压片分辨雌雄,人工解剖取性腺,解剖前向鱼体腔注射约1 mL的φ=5%醋酸溶液,使性腺变白,以利于取出性腺。性腺取出后,滴少许铁醋酸洋红进行染色,压片后在 ZEISS 显微镜下观察判断雌雄。雌鱼性腺表面可见清晰卵粒,雄鱼性腺表面无清晰细胞间隔。如压片不能清楚分辨雌雄时,揭开盖玻片,滴少许结晶紫溶液,见到明显卵细胞的为雌性,无卵细胞样的则为雄性。
1.3 数据分析
采用Excel2003进行数据整理,并运用SPSS18.0版本进行差异显著性分析。用卡方(χ2)检验[20-21]比较各组的雄性率的差异,进行多重比较时,为了降低Ⅰ类误差,采用Bonferroni校正法对显著性水平进行校正,校正的显著性水平α′=α/比较次数[3]。
为了解MT、MDHT诱导7 DPH与13 DPH仔鱼雄性率的差异,需对7 DPH与13 DPH雄性率最高的组进行两个百分数样本差异显著性t检验[22],在 Excel 2003里编辑公式(1),根据公式(1)求得t值,然后查t分布表,以比较差异的显著性。
(1)
(1)式中,x1为第一样本中某事件发生的次数,x2为第二样本中某事件发生的次数,n1为第一个样本含量,n2为第二个样本含量,SQRT 表示返回数值的算术平方根。
2 结 果
2.1 MT与MDHT浸泡诱导1 DPH仔鱼的雄性率
由图1可知:处理时期为1 DPH,持续时间为 4 h 时,不同MT、MDHT 剂量组(200,600,1 800,5 400 μg·L-1)的雄性率和对照组(Ctr)比较没有显著差异(P>0.05),各组间两两比较也没有显著差异(P>0.05)。

图1 处理时期为1 DPH,持续时间为 4 h时,不同MT、MDHT剂量组的雄性率
由图2可知:处理时期为 1 DPH,MT或MDHT剂量为600 μg·L-1时,不同持续时间组(2,4,8 h)的雄性率和对照组比较没有显著差异(P>0.05),各组间两两比较也没有显著差异(P>0.05)。这说明用MT 或MDHT 浸泡诱导1 DPH的仔鱼时,激素剂量为200,600,1 800或5 400 μg·L-1,持续时间为2,4或8 h,都不能显著提高雄性率。

图2 处理时期为1 DPH,MT、MDHT剂量为600 μg·L-1 时,不同持续时间组的雄性率
2.2 MT与MDHT浸泡诱导7 DPH仔鱼的雄性率
由图3可知:处理时期为 7 DPH,持续时间为4 h时,不同MT、MDHT剂量组(200,600,1 800,5 400 μg·L-1)的雄性率都显著高于对照组(P<0.05),MT(1 800,5 400 μg·L-1)两组的雄性率显著低于 MT(600 μg·L-1)、MDHT(600,1 800 μg·L-1)三组(P<0.05),MDHT各剂量组(200,600,1 800,5 400 μg·L-1)两两比较无显著差异(P>0.05)。这表明当MT诱导 7 DPH 仔鱼的剂量为600 μg·L-1时雄性率最高,而剂量为1 800,5 400 μg·L-1时雄性率明显下降;MDHT 的剂量为600,1 800 μg·L-1时雄性率最高,同时剂量为200,5 400 μg·L-1时雄性率没有明显下降。
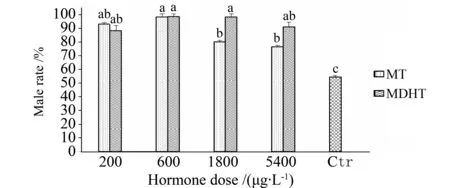
图3 处理时期为7 DPH,持续时间为4 h时,不同MT、MDHT 剂量组的雄性率

图4 处理时期为7 DPH,MT、MDHT剂量为 600 μg·L-1时,不同持续时间组的雄性率
由图4 可知:处理时期为 7 DPH,MT或MDHT剂量为600 μg·L-1时,不同持续时间组(2,4,8 h)的雄性率都显著高于对照组 (P<0.05),MT(8 h)组的雄性率显著低于MT(4 h)组的雄性率(P<0.05),MDHT各持续时间组(2,4,8 h)两两比较无显著差异(P>0.05)。这表明当用MT诱导7 DPH仔鱼时,持续时间为 4 h 效果最好、而 8 h的雄性率降低;当用MDHT时,3个持续时间组(2,4,8 h)的雄性率无显著差异。
2.3 MT与MDHT浸泡诱导13 DPH仔鱼的雄性率
由图5 可知:处理时期为 13 DPH,持续时间为4 h时,MT(200,600,1 800 μg·L-1)及 MDHT(200,600 μg·L-1)这5组的雄性率显著高于对照组(P<0.05),MT(200 μg·L-1)和 MDHT(200 μg·L-1) 2组雄性率最高、分别为87.62%和82.31%。MT(5 400 μg·L-1)、MDHT(1 800,5 400 μg·L-1)这3组的雄性率和对照组比较无显著差异(P>0.05),MT(5 400 μg·L-1)组的雄性率显著低于MT(200; 600 μg·L-1)和MDHT(200 μg·L-1)3组(P<0.05),MDHT 各剂量组(200,600,1 800,5 400 μg·L-1)两两比较无显著差异(P>0.05)。

图5 处理时期为13 DPH,持续时间为4 h时,不同MT、MDHT 剂量组的雄性率
由图6 可知:处理时期为 13 DPH,MT或MDHT剂量为200 μg·L-1时,MT(2,4 h)和MDHT(2,4 h)这4组的雄性率显著高于对照组(P<0.05),MT(8 h)组的雄性率显著低于MT(4 h)组(P<0.05),与MT(2 h)组无显著差异(P>0.05),MDHT 各持续时间组(2,4,8 h)两两比较无显著差异(P>0.05)。

图6 处理时期为13 DPH,MT、MDHT剂量为200 μg·L-1 时,不同持续时间组的雄性率
2.4 MT与MDHT浸泡诱导7 DPH与13 DPH仔鱼最高雄性率的t检验
结合图3-6 可知,MT、MDHT 浸泡诱导7 DPH与13 DPH仔鱼雄性率最高的处理组合(DPH-h-μg·L-1)分别为:MDHT(7-4-600)、MT(7-4-600)、MT(13-4-200)和MDHT(13-4-200)这4组,雄性率分别为98.81%、98.34%、87.62%和 82.31%。这4组分别进行了2个百分数样本差异显著性t检验(见图 7)。结果为:MDHT(7-4-600)、MT(7-4-600)这2组的雄性率显著高于 MT(13-4-200)、MDHT(13-4-200)这2组(P<0.05),MDHT(7-4-600)与 MT(7-4-600)两组间无显著差异(P>0.05),MT(13-4-200)与 MDHT(13-4-200)两组间也无显著差异(P>0.05)。这证明 MT、MDHT 浸泡诱导 7 DPH仔鱼的雄性率要显著高于诱导 13 DPH仔鱼的雄性率。

图7 MT 与 MDHT诱导 7 DPH 与 13 DPH 仔鱼最高雄性率的t检验
3 讨 论
3.1 激素敏感期
激素敏感期(Hormone sensitive period)是指动物胚胎发育的某一特定阶段,在该阶段内激素能对性别决定起主导作用[23-24]。如要使用激素实现性别的定向诱导,首先要确定激素敏感期。从本文的结果看,MT、MDHT诱导7 DPH尼罗罗非鱼仔鱼的雄性率最高分别为98.81%和98.34%。Gale等[9]用MT和MDHT分别浸泡处理了尼罗罗非鱼,处理剂量为500 μg·L-1、处理时期为13 DPF(Days post fertilization,受精后 13 d,相当于7 DPH)、持续时间为 3 h,雄性率分别达87%和94%;Wassermann和Afonso[10]也用MT和MDHT浸泡处理了尼罗罗非鱼,处理剂量为1 800 μg·L-1、处理时期为14 DPF(相当于7~8 DPH)、持续时间为 4 h,雄性率分别达91.6%和100%。另外,我们的研究结果通过t检验证明,13 DPH仔鱼也具有激素敏感性,只是不如7 DPH仔鱼激素敏感性高。以上结果表明:尼罗罗非鱼仔鱼的激素敏感期应为包括7 DPH在内的一个“时段”。此时生殖脊开始出现、原始性腺尚未形成[25],推测这个“时段”应该在生殖脊开始出现到原始性腺形成之前,此时性腺发育具有较强的两性分化可塑性[26]。但具体确定这个“时段”还有待进一步研究。
3.2 MT与MDHT的诱导效果对比
本文结果发现:MT诱导7 DPH仔鱼的剂量为600 μg·L-1时,雄性率最高(98.81%);MDHT 的剂量为600,1 800 μg·L-1时,雄性率最高(分别为98.34%、98.39%)。当用MT诱导7 DPH仔鱼时,持续时间为4 h雄性率最高;当用MDHT时,3种持续时间组(2,4,8 h)的雄性率都较高。Gale等[9]所采用的MT和MDHT处理剂量为500 μg·L-1,持续时间为3 h,雄性率分别为87%和94%。相比较而言,本试验的雄性率更高,这可能是Gale等所采用剂量500 μg·L-1和持续时间3 h与本研究的600 μg·L-1和4 h有所差异引起的。Wassermann和Afonso[10]所采用的MT和MDHT处理剂量为1 800 μg·L-1,持续时间为4 h,雄性率分别为91.6%和100%。这和本文结果相符。
本试验研究还发现:MT诱导7 DPH仔鱼的剂量为1 800 μg·L-1和5 400 μg·L-1时,雄性率相比 200 μg·L-1和600 μg·L-1而言明显下降(P<0.05);而 MDHT各剂量组(200,600,1 800,5 400 μg·L-1)的雄性率无显著差异(P>0.05)。当用MT诱导7 DPH仔鱼时,持续时间为4 h效果最好、而8 h的效果有所下降;当用MDHT时,3种持续时间组(2,4,8 h)的雄性率无显著差异(P>0.05)。这些现象可能与MT可芳香化[6-7]有关,当 MT 剂量较高(1 800,5 400 μg·L-1)或持续时间较长(8 h)时,过量的 MT 在芳香化酶的催化下产生雌二醇(E2)[27],从而导致雄性率相对降低。MDHT是不可芳化的[6,9],相对于可芳化的 MT 而言,MDHT剂量较高(1 800,5 400 μg·L-1)和持续时间较长(8 h)时,雄性率并无显著降低,且MDHT剂量较低(200 μg·L-1)和持续时间较短(2 h)时,雄性率也无显著降低。因此,总体而言 MDHT 浸泡诱导雄性化的稳定性较 MT 好,MDHT表现出更好的应用潜力。
3.3 “浸泡法”的应用前景
本文结果表明,运用MT和MDHT浸泡诱导尼罗罗非鱼仔鱼雄性化的雄性率最高分别可达98.81%和98.39%,雄性率能够达到生产应用需求。尤其是MDHT表现出更好的应用潜力。诱导雄性化不光在生产上应用,在科研中也有着巨大的应用价值,性反转鱼在性别决定机制、染色体组学和三系配套技术[28-29]等研究中早有应用,通过“浸泡法”得到的“转化系”的鱼,必将为这些基础理论的研究提供新的研究题材。
传统的激素诱导处理方式有投喂法、注射法和埋植法。投喂法最为常见,使用时先把激素溶解在酒精中,然后拌入饲料中投喂,此法虽有效,但在鱼的消化过程中激素的效应会降低,而且投喂法耗时长、激素用量大,会导致环境污染,极少量残留也会危害人体健康[15-16];注射法和埋植法费时费力,一般只在科研中有应用价值,而且不能应用于胚胎或仔鱼,这也限制了其推广使用;“浸泡法”是一门新兴的技术,已在大马哈鱼中成功应用[6,30],其方法简便易行,一般在专门的容器或装置进行短时间的集中处理,由于浸泡激素呈全面均匀分散进入鱼体皮下组织内,机体组织吸收效果好,此法所用激素剂量小,避免了对养殖水体的污染,这对保护生态环境有着较为重要的意义。
参考文献:
[1]王斌.中国罗非鱼出口贸易国际竞争力研究[D].无锡:江南大学,2011.
[2]李思发.我国罗非鱼养殖业世纪展望[J].中国水产,2000(1):15-20.
[3]陈兴汉,刘晓春,蒙子宁,等.温度调控诱导尼罗罗非鱼仔鱼雄性化的研究[J].中山大学学报:自然科学版,2013,52(1):94-99.
[4]夏德全.中国罗非鱼养殖现状及发展前景[J].科学养鱼,2000(5):1-2.
[5]PANDIAN T J,SHEELA S G.Hormonal induction of sexreversal in fish[J].Aquaculture,1995,138(1):1-22.
[6]PIFERRER F,BAKER I J,DONALDSON E M.Effects of natural,synthetic,aromatizable,and nonaromatizable androgens in infucing male sex differtiation in genotypic female Chinook salmon(Oncorhynchustshawytscha)[J].J Exp Zool,1993,91(1):59-65.
[7]李广丽,刘晓春,林浩然.17α-甲基睾酮对赤点石斑鱼性逆转的影响[J].水产学报,2006,30(2):145-150.
[8]PIFERRER F,CARRILLO M,ZANUY S,et a1.Induction of sterility in coho salmon(Oncorhynchuskisutch)by androgen immersion before first feeding[J].Aquaculture,1994,119(4):409-423.
[9]GALE W L,FITZPATRICK M S,LRCERO M,et a1.Masculinization of Nile tilapia(Oreochromisniloticus)by immersion in androgens[J].Aquaculture,1999,178(3):349-357.
[10]WASSERMANN G J,AFONSO L O B.Sex reversal in Nile tilapia(OreochromisniloticusL.)by androgen immersion[J].Aqua Res,2003,34(1):65-71.
[11]杜长斌.我国鱼类性别控制研究进展[J].水产学杂志,2000,13(1):74-80.
[12]邬国民,练慧英.应用甲基睾丸素诱导莫桑非洲鲫雄性化的研究[J].遗传,1979,1(6):36-39.
[13]钱晖,杨文.激素诱导罗非鱼雄性化的试验研究[J].淡水渔业,1993,23(4):41-42.
[14]李家乐,李思发,韩风进.甲基睾丸酮诱导吉富品系尼罗非鲫雄性化的研究[J].水产学报,1997,21(12):107-110.
[15]穆迎春,马兵,宋怿,等.甲基睾酮对水产品质量安全和人体的影响[J].海洋与渔业,2008(8):16.
[16]OKAZAKI K,IMAZAWA T,NAKAMURA H,et a1.A repeated 28-day oral dose toxicity study of 17a-methyl testosterone in rats,based on the ‘Enhanced OECD Test Guideline 407’ for screening the endocrine-disruputing chemical[J].Arch Toxicol,2002,75(10):635-642.
[17]于福才,马丽.K+和 Li+浸泡刺激海胆的排卵反应[J].海洋学报,1991,13(6):843-848.
[18]胡廷尖,王雨辰,陈丰刚,等.泥鳅激素浸泡催产试验的研究[J].中国农学通报,2012,28(8):82-86.
[19]VARADARAJ K,PANDIAN T J.Masculinization ofOreochromismossambicusby administration of 17α-methyl-5-androsten-3β-diol through rearing water[J].Cur Sci,1987,56(9):412-413.
[20]童一中.生物统计法[M].长沙:湖南科技出版社,1986:450-478.
[21]李春善,王志和,王文林,等.生物统计学[M].2版.北京:科技出版社,2000:71-80.
[22]吴仲贤.生物统计[M].北京:北京农业大学出版社,1993:114-119.
[23]RAYNAUD A,PIEAU C.Embryonic development of the genital system[M].// GANS C,BILLETT F.Biology of the Reptilia.Vol 15.New York:John Wiley,1985:149-300.
[24]焦保卫,王德寿,邓思平,等.爬行动物温度依赖性性别决定研究进展[J].动物学杂志,2002,37(4):74-78.
[25]陈兴汉,刘晓春,蒙子宁,等.尼罗罗非鱼仔鱼个体发育及性腺分化发育的研究[J].热带生物学报,2012,3 (3):197-203.
[26]刘筠,刘国安,陈淑群,等.尼罗罗非鱼性腺发育的研究[J].水生生物学集刊,1983,8(1):17-32.
[27]LEE S T L,WLME D E,CHAO T M,et a1.In virto metabolism of testosterone by gonads of grouper(Epinephelustauvina)before and after sex inversion with 17a-methyltestosterone[J].Gen Comp Endocrino1,1995,99(1):41-49.
[28]杨永铨.莫桑比克罗非鱼性别生理遗传控制的初步研究.遗传学报[J].1979,6(3):305-310.
[29]杨永铨,张中英,林克宏.应用三系配套途径产生遗传上全雄莫桑比克罗非鱼[J].遗传学报,1980,7(3):241-246.
[30]BAKER I J,SOLAR I I,DONALDSON E M.Masculinization of Chinook Salmon(Oncorhynchustshawytscha)by immersion treatments using 17α-Methyltestosterone around the time of hatching[J].Aquaculture,1988,72(3):359-367.

