平菇菌粗多糖的抗氧化活性研究
汪建中, 李艳如, 龚华锐
(安徽师范大学生命科学学院 安徽省重要生物资源保护与利用重点实验室 生物环境与生态安全安徽省重点实验室, 安徽 芜湖 241000)
在食品工业中,常用抗氧化剂防止食品的氧化变色或者因氧化导致的品质劣变[1]。已有的研究表明,食品中常用的合成抗氧化剂BHA和BHT对动物可能有致癌性[2],因此,人们希望开发来源于动、植物无毒副作用的抗氧化剂。而食用菌营养丰富,天然安全,具有抗氧化、抗肿瘤、抗菌、抗病毒、免疫调节以及产生抗生素等多种生理活性[3, 4],是寻找天然抗氧化剂的理想材料。
多糖类物质普遍存在于食用菌中,是其重要的生物活性成分之一,具有较强的抗氧化能力[5]。平菇(Pleurotusostreatus)是目前广泛栽培的食用菌之一,从其子实体、菌丝体以及发酵液中都可以获得平菇多糖。近年来,平菇多糖抗氧化活性的研究越来越受到人们关注。如程超等的研究表明,平菇子实体多糖对超氧阴离子自由基、羟自由基具有清除作用[6]。曹向宇等采用酶法提取、离子交换层析和凝胶过滤纯化平菇菌丝体多糖,结果表明,纯化后的平菇菌丝体多糖具有清除超氧离子自由基、羟自由基的能力以及抑制红细胞溶血的生成,且呈现一定的效量关系[7]。也有研究表明,同一种食用菌的3种多糖的抗氧化能力一般存在差异[8, 9]。本文以深层培养平菇获得的菌丝体、发酵液为原料,比较研究了其菌丝体、发酵液多糖清除DPPH自由基、羟自由基以及铁离子螯合能力和还原力等抗氧化能力,希望为开发天然安全的食品药品抗氧化剂提供一些理论依据。
1 材料与方法
1.1 菌种
平菇(Pleurotusostreatus)由安徽师范大学微生物实验室保藏。
1.2 培养基
平菇斜面培养基: PDA培养基。
平菇液体菌种培养基:葡萄糖2%、蛋白胨0.2%、硫酸镁0.05%、氯化钙0.01%、磷酸二氢钾0.05%。
液体发酵培养基: 葡萄糖3%,蛋白胨0.2%,麸皮1%,磷酸二氢钾0.05%,硫酸镁0.05%。
1.3 试剂
DPPH自由基、菲洛嗪等购自Sigma公司;VC、EDTA二钠盐、无水乙醇、双氧水、氯化亚铁、硫酸亚铁、铁氰化钾、三氯乙酸、磷酸二氢钾等购自无锡展望化工厂。所有试剂均为分析纯。
1.4 仪器
SKY2102C恒温摇床,上海苏坤实业有限公司;GUCS-10发酵罐,镇江东方工程设备技术有限责任公司;HH-4恒温水浴锅,金坛市杰瑞尔电器有限公司;TD5A-WS离心机,湘仪离心机仪器有限公司;RE52-86A旋转蒸发仪、SHZ-D(Ⅲ)型循环水真空泵,上海亚荣生化仪器厂;FD-1D-50冷冻干燥机,北京博医康实验仪器有限公司;UV-3802紫外可见分光光度计,优尼科(上海)仪器有限公司;AR-1140型电子天平,奥豪斯国际贸易(上海)有限公司。
1.5 平菇多糖的制备
10 L发酵罐装液体培养基7 L,接种10%(v/v)的平菇液体菌种,搅拌转数170 r/min,通气量4 NL/min,26.5℃恒温培养4 d,发酵产物经过滤固液分离获得菌丝体和发酵液。
将菌丝体水洗、50℃烘干后磨碎,100目过筛,与蒸馏水按固液比1∶30(W/V)的比例混合均匀,于95℃回流提取2 h, 4000 r/min离心10 min,沉淀重复提取1次,合并2次上清液。将上清液经减压浓缩至适当体积得水提浸膏,加入4倍体积的95%乙醇、4℃沉淀24 h后,4000 r/min离心10 min,沉淀经冷冻干燥(-45℃)后得菌丝体多糖。
发酵液经4000 r/min离心10 min后,取上清液减压浓缩至适当体积得浸膏,加入4倍体积的95%乙醇、4℃沉淀24 h后,4000 r/min离心10 min,沉淀经冷冻干燥(-45℃)后得发酵液多糖。
1.6 平菇多糖的紫外光谱
取适量多糖,配成1.5 mg/mL的水溶液,在200~400 nm范围内进行光谱扫描。
1.7 平菇多糖抗氧化活性的测定
1.7.1 DPPH自由基清除能力测定[10]
4 mL反应混合液中含有0.04 mg/mL的DPPH 溶液2 mL,多糖样品溶液2 mL。迅速混匀后,室温条件下,黑暗环境中静置30 min,于波长517 nm 处测其吸光度。以抗坏血酸为阳性对照,以50%的乙醇溶液作参比。每个样品平行测定3 次,取平均值。根据下面公式计算多糖样品的DPPH自由基清除率:
SE/%=[1-(A1-A2)/A0]×100
式中:SE为清除率;A0为以蒸馏水代替样品时溶液的吸光度;A1为加有样品或阳性对照时溶液的吸光度;A2为以无水乙醇代替DPPH 时溶液的吸光度。
1.7.2 羟自由基清除能力测定[11]
3 mL反应混合液中含有20 mmol/L的水杨酸钠溶液0.3 mL,1.5 mmol/L 的硫酸亚铁溶液1.0 mL,多糖样品溶液1.0 mL,最后加入6 mmol/L的H2O20.7 mL。迅速混匀后,37℃恒温水浴1 h,于波长510 nm处测其吸光度。以抗坏血酸为阳性对照,以蒸馏水作为参比。每个样品平行测定3 次,取其平均值。根据下面公式计算多糖样品的羟自由基清除率:
SE/%=[ (A0-A1)/A0]×100
式中:SE为清除率;A0为以蒸馏水代替样品的吸光度;A1为加有样品或阳性对照后的吸光度。
1.7.3 铁离子螯合能力测定[12]
5 mL反应混合液中含有2 mmol/L 的氯化亚铁溶液0.1 mL,蒸馏水3.7 mL,多糖样品溶液1 mL,最后加入5 mmol/L的ferrozine溶液0.2 mL,迅速混匀,在室温条件下静置20 min,于波长562 nm处测其吸光度。吸光度越低,说明多糖样品的铁离子鳌合能力越强。以EDTA-二钠盐作为阳性对照,蒸馏水作参比。每个样品平行测定3 次,取其平均值。根据下面的公式计算多糖样品的铁离子鳌合能力:
铁离子鳌合能力(%)=[(A0-A1)/A0]×100
式中:A0为以蒸馏水代替样品的吸光度;A1为加有样品或阳性对照后溶液的吸光度。
1.7.4 还原能力测定[13]
向试管中加入pH值6.6的磷酸盐缓冲液2.5 mL,多糖样品溶液1 mL,1%的铁氰化钾溶液2.5 mL,迅速混匀,50℃恒温水浴、黑暗条件下反应20 min,再加入10%的三氯乙酸溶液2.5 mL,充分振荡后,4000 r/min 离心10 min,取上清液2.5 mL,加入蒸馏水2.5 mL,0.1% 的FeCl3溶液0.5 mL,常温反应5 min后,于波长700 nm处测定其吸光度。吸光度越高,说明这种反应混合物的还原力越强。以抗坏血酸为阳性对照,蒸馏水作为参比。每个样品平行测定3 次,取其平均值。
1.7.5 EC50值
EC50值是指清除率达到50%时所需样品的质量浓度,是评价真菌粗多糖抗氧化活性的一个重要参数,可根据不同质量浓度样品的清除率曲线得出。EC50值越低表明样品的抗氧化能力越强。本实验中的EC50值分别指当DPPH自由基、羟自由基清除率、铁离子螯合能力为50%以及还原力实验中在波长700 nm处OD值为0.5时所需样品的质量浓度,该值由统计分析的回归方程计算得出。
1.8 数据处理
用EXCEL和SPSS软件进行数据的处理与分析,结果取平均数±标准误。
2 结果与分析
2.1 平菇菌丝体多糖和发酵液多糖的紫外光谱
由图1可知,在260和280 nm处,2种多糖均未发现有特征吸收峰,表明它们均不含核酸和蛋白质。
2.2 平菇菌丝体多糖和发酵液多糖清除DPPH自由基能力的比较
当有自由基清除剂存在时,DPPH 自由基接受一个电子或氢原子,形成稳定的化合物,使其乙醇溶液从深紫色变为黄色,变色程度与其接受的电子数量(自由基清除活性)成定量关系,因此可用分光光度计进行快速定量分析。另外DPPH 自由基结构简单,反应容易控制。因此DPPH自由基被广泛应用于评价动、植物提取物或单一化合物的抗氧化能力实验中。由图2可知,2种多糖均具有DPPH自由基清除活性。在实验浓度范围内,随着多糖浓度的增加,其清除率也随之增加。当浓度为15 mg/mL时,它们的清除率均达到最大值,分别为77.60%和64.33%。菌丝体、发酵液多糖的EC50值分别为2.20 mg/mL和6.79 mg/mL,表明这2种多糖都具有较强的DPPH自由基清除能力。
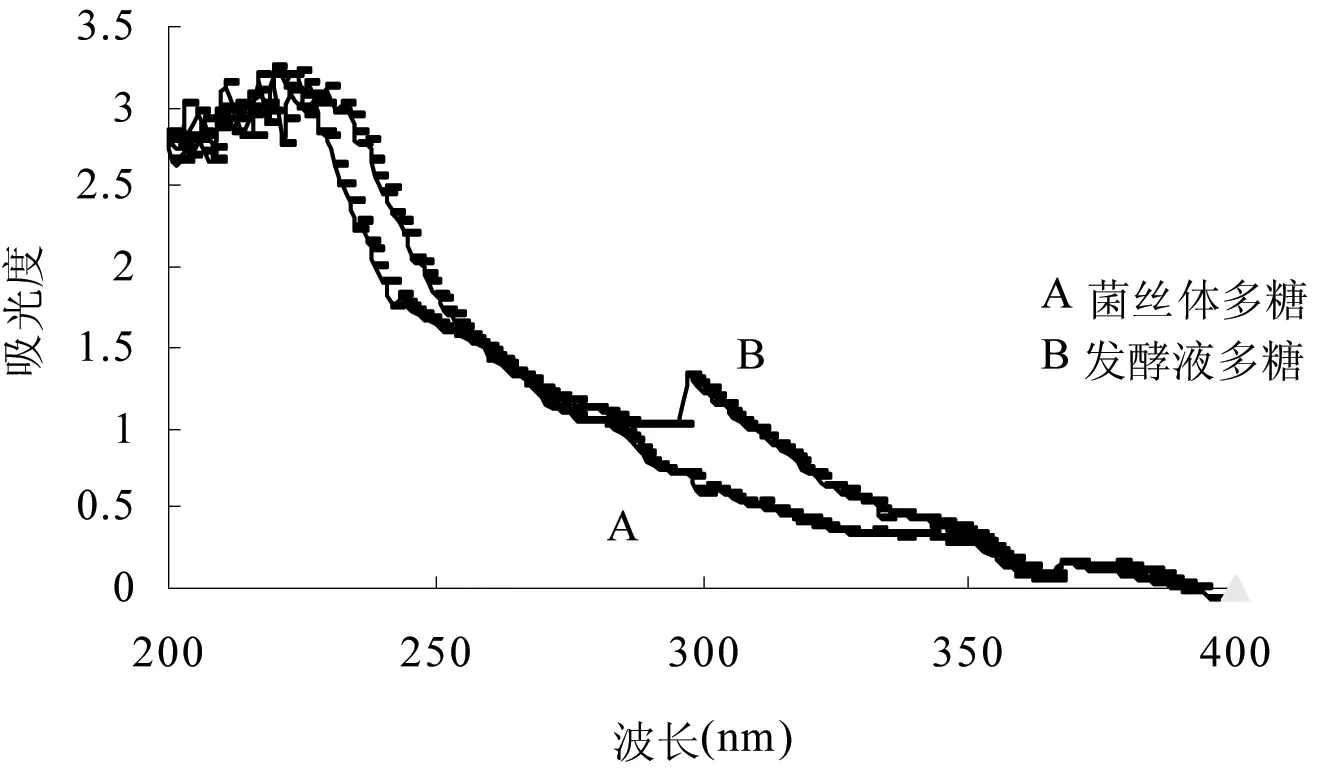
图1 平菇菌丝体多糖和发酵液多糖的紫外光谱
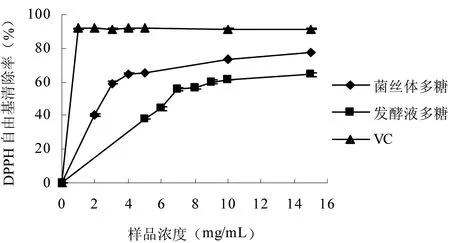
图2 平菇菌丝体多糖和发酵液多糖的DPPH自由基清除能力
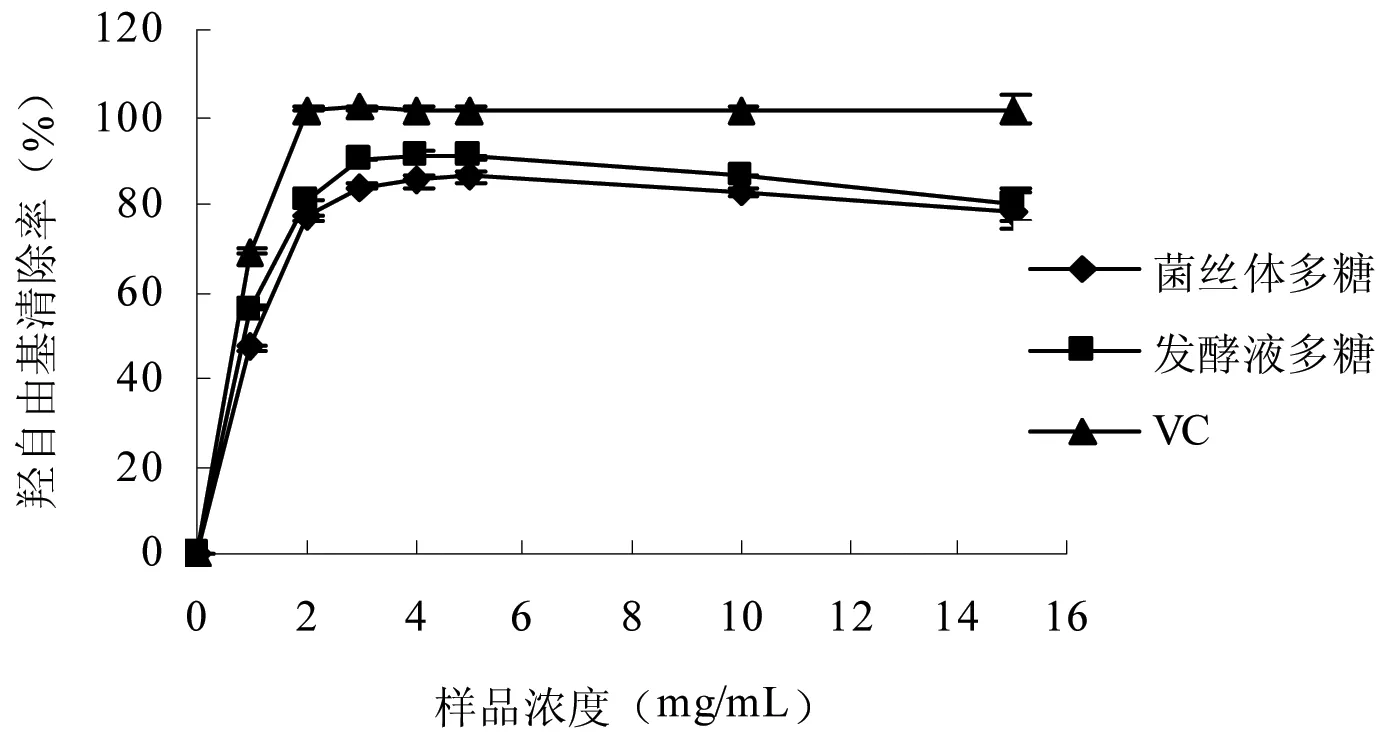
图3 平菇菌丝体多糖和发酵液多糖的羟自由基清除能力
2.3 平菇菌丝体多糖和发酵液多糖清除羟自由基能力的比较
羟自由基是已知活性最强的活性氧自由基,可严重损害生物体内相邻的生物分子,引起细胞损伤,从而导致机体衰老和癌变等。因此,清除羟自由基可能是生物体抵御疾病的最有效方式之一[14]。由图3可知,2种多糖均具有羟自由基清除活性,在一定浓度范围内,随着多糖浓度的增加,其对羟自由基的清除率也随之增加,菌丝体、发酵液多糖清除率最大值分别为86.30%和91.43%,EC50值分别为0.89 mg/mL和0.72 mg/mL,表明这2种多糖均具有较强的羟自由基清除能力。
2.4 平菇菌丝体多糖和发酵液多糖铁离子螯合能力的比较
存在于生物体系中的铁离子能够通过Fenton类型反应促进脂类物质的氧化,还可以使脂类氧化后的氢过氧化物降解产生自由基来传递氧化反应链,当螯合剂存在时可以降低其氧化能力,从而起到抗氧化作用[15]。因此,铁离子鳌合能力就成为评估各种植物及真菌提取物抗氧化能力的一项指标。由图4可知,2种多糖均具有铁离子螯合能力。在一定浓度范围内,随着多糖浓度的增加,它们对铁离子的螯合能力也随之增加。当浓度为15 mg/mL时,菌丝体、发酵液多糖的铁螯合能力最强,分别为49.86%和75.46%。菌丝体、发酵液多糖的EC50值分别为11.83 mg/mL和3.32 mg/mL,表明发酵液多糖的铁离子螯合能力大于菌丝体多糖。与EDTA二钠相比,上述2种多糖的铁离子螯合能力均较低,这可能是由于多糖是大分子物质,对金属离子的螯合能力受到其空间结构等因素的影响。
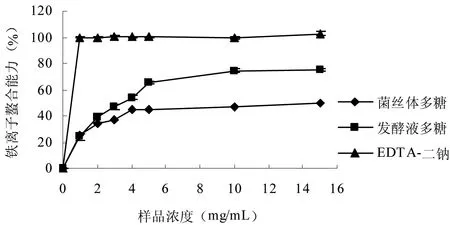
图4 平菇菌丝体多糖和发酵液多糖的铁离子螯合能力
2.5 平菇菌丝体多糖和发酵液多糖还原能力的比较
抗氧化剂通过自身的还原作用给出电子而清除自由基,还原力越强,抗氧化能力就越强。因此,一种化合物的还原能力可以作为其潜在抗氧化能力的一个重要指标[16],可通过测定抗氧化剂的还原力来说明其抗氧化能力的大小。由图5可知,2种多糖均具有还原能力,且在一定浓度范围内,随着多糖浓度的增加,其还原力也随之增强。当浓度为15 mg/mL时,它们的OD值最大,分别为0.653和1.012。菌丝体、发酵液多糖的EC50值分别为11.24 mg/mL和7.91 mg/mL,表明发酵液多糖的还原力大于菌丝体多糖。2种多糖与VC比较,还原能力较弱,这可能是多糖是大分子物质,具有的还原性末端相对较少的缘故。
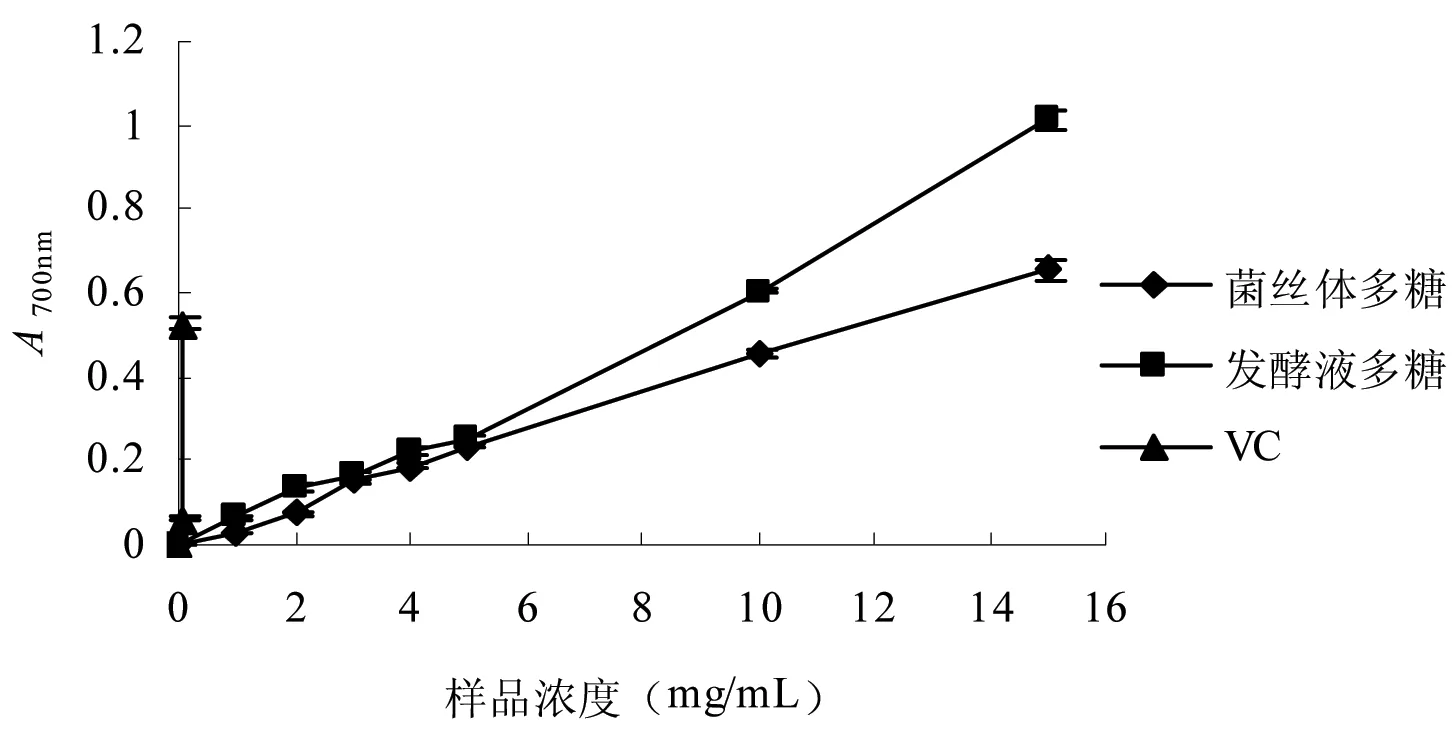
图5平菇菌丝体多糖和发酵液多糖多糖的还原力
3 讨论与结论
食用菌多糖是食用菌中最重要的活性成分之一,具有清除自由基、提高抗氧化酶活性和抑制脂质过氧化等抗氧化活性,从而可起到保护生物膜和延缓衰老的作用,因此食用菌多糖成为保健食品、药品以及抗氧化剂开发的重要来源[17]。
目前,科学工作者对食用菌多糖清除DPPH、羟自由基能力的研究较多。如陶明煊等的研究结果显示金顶侧耳(Plurotuscitrinopileauts)、姬菇(Pleurotuscornucopiae)和毛头鬼伞(Coprinuscomatus)子实体粗多糖清除DPPH自由基的EC50值分别为14.51、15.36和15.02 mg/mL[5],远大于本研究中平菇菌丝体、发酵液多糖的EC50值;与吕国英等的研究结果相比,在10~15 mg/mL范围内,平菇菌丝体、发酵液多糖对DPPH自由基的清除率远大于蛹虫草(Cordycepsmilitaris)无性型菌丝体的去离子水、乙醇和丙酮提取物[18]。而在清除羟自由基的研究中,鸡油菌(Cantharelluscibarius)、变绿红菇(Russulavirescens)、金顶侧耳、姬菇和毛头鬼伞子实体粗多糖的EC50值分别为1.12、1.21、2.45、2.60和2.59 mg/mL[4, 5],均大于本研究中平菇菌丝体、发酵液多糖的EC50值;曹向宇等测定了经过DEAE-32 离子交换层析和Sephadex G100 凝胶过滤纯化的平菇子实体多糖对羟自由基的清除率,结果显示,其为0.5 mg/mL时,清除率就达到53.78%[6],效果优于本研究中的平菇粗多糖,这可能是由于纯化后的多糖有效成分更多的缘故。祝子坪在研究桑黄菌(Phellinus igniarius)菌丝体、发酵液多糖对上述2种自由基清除的能力时发现,菌丝体多糖清除DPPH自由基的能力大于发酵液多糖,而测定清除羟自由基的能力其结果正好相反[15],显示了与本研究相一致的结果。由此可以看出,平菇菌丝体、发酵液多糖具有较强的DPPH自由基、羟自由基清除能力,且清除能力存在差异。
在有关食用菌多糖铁离子螯合能力的报道中,美味牛肝菌(BoletusedulisBull)、松茸(Tricholomamatsutake)、鸡油菌、变绿红菇和蜜环菌(Armillariamellea)子实体多糖的EC50值分别为12.78、4.97、3.22、3.79和3.41 mg/mL[4, 19]。也有研究表明,经纯化的洋蕈(Agaricusbisporus)、巴西蘑菇(Agaricusbrasiliensis)、赤灵芝(Ganodermalucidum) 和桑黄菌(Phellinuslinteus)子实体多糖铁离子螯合能力的EC50值分别为7.80、2.04、0.59和0.91 mg/mL[20]。与之相比较,平菇发酵液多糖的EC50值为3.32 mg/mL,具有较强的铁离子螯合能力。本研究结果也表明,发酵液多糖的还原力大于菌丝体多糖,与前人的研究结果一致[15]。
已有的研究表明,食用菌多糖具有较好地还原能力,如纯化后的洋蕈、巴西蘑菇、赤灵芝和桑黄菌子实体水溶性多糖还原力的EC50值分别为14.83、3.13、0.67和0.47 mg/mL[20];鸡油菌、变绿红菇、蜜环菌和棕灰口蘑(Tricholomamyomyces)子实体水溶性粗多糖还原力的EC50值分别为4.08、3.02、1.05和1.37 mg/mL[4]。而本研究中平菇菌丝体、发酵液多糖还原力的EC50值分别为11.24和7.91 mg/mL,说明平菇菌丝体多糖的还原能力较弱。
综上可知,平菇菌丝体、发酵液多糖具有较好地抗氧化活性,但它们的抗氧化能力存在差异。菌丝体多糖清除DPPH自由基较强;发酵液多糖清除羟自由基的能力、铁离子螯合能力以及还原力较强。在一定的浓度范围内,多糖的浓度增加其抗氧化能力也随之增强,呈量效依赖关系。
参考文献:
[1]尤 新. 食品抗氧化剂与人体健康[J]. 食品与生物技术学报, 2006, 25 (2): 1-7.
[2]Botterweck A A M, Werhagen H, Goldbohm R A, et al. Intake of butylated hydroxyanisole and butylated hydroxytoluene and stomach cancer risk: results from analyses in the etherlands cohort study[J]. Food and Chemical Toxicology, 2000, 38: 599-605.
[3]Elmastas M, Isildak O, Turkekul I, et al. Determination of antioxidant activity and antioxidant compounds in wild edible mushrooms[J]. Journal of Food Composition and Analysis, 2007, 20(3-4): 337-345.
[4]魏 磊, 郑朝辉, 侯成林, 等. 四种野生食用菌粗多糖的抗氧化活性研究[J]. 微生物学通报, 2011, 38(10): 1533-1539.
[5]陶明煊, 王 峰, 刘 俊, 等. 3种食用菌清除自由基的作用研究[J]. 食品科学, 2009, 30 (23): 135-137.
[6]程 超, 李 伟, 汪兴平. 平菇水溶性多糖结构表征与体外抗氧化作用[J].食品科学, 2005, 26 (8): 55-57.
[7]曹向宇, 刘剑利, 芦秀丽, 等. 平菇菌丝体多糖的分离纯化和体外抗氧化活性[J]. 食品科学, 2010, 31(22): 124-128.
[9]盛 伟, 方晓阳. 杏鲍菇菌丝体胞内与胞外多糖体外抗氧化活性研究[J]. 中国林副特产, 2009, 98 (1) : 7-10.
[10]Amarowicz R, Naczk M, Shahidi F. Antioxidant activity of various fractions of non-tannin phenolics of canola hulls[J]. Journal of Agricultural and Food Chemistry, 2000, 48 (7): 2755-2759.
[11]Smiynoff N, Cumbes Q. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28 (4): 1057-1060.
[12]Oyazu M. Antioxidative activity of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J]. Journal of the Japanese Society for Food Science and Technology, 1988, 35(11): 771-775.
[13]Cengiz S, Bektas T, Mustafa Y. Evaluation of the antioxidant activity of four edible mushrooms from the central Anatolia, Eskisehir-Turkey:Lactariusdeterrimus,Suilluscollitinus,Boletusedulis,Xerocomuschrysenteron[J]. Bioresource Technology, 2008, 99: 6651-6655.
[14]郭 坦, 侯成林, 魏 磊, 等. 印度菌块提取物的抗氧化活性研究[J]. 菌物学报, 2010, 29 (4): 569-575.
[15]祝子坪, 李 娜. 桑黄菌多糖体外抗氧化作用[J]. 食品科学, 2011, 32 (19): 92-95.
[16]王应男, 张公亮, 刘 洋, 等. 榆耳菌丝体多糖的体外抗氧化活性研究[J]. 食品工业科技, 2012, 12 (33): 197-196.
[17]李小雨, 王振宇, 王 璐. 食用菌多糖的分离、结构及其生物活性的研究进展[J]. 中国农学通报, 2012, 28 (12): 236-240.
[18]吕国英, 潘慧娟, 吴永志, 等. 蛹虫草无性型菌丝体提取液体外抗氧化活性研究[J]. 菌物学报, 2009, 28(4): 597-602.
[19]孙 娟, 郑朝辉, 刘 磊, 等. 4 种珍稀食用菌粗多糖的抗氧化活性研究[J]. 安徽农业大学学报, 2011, 38(3): 404-409.
[20]Kozarski M, Klaus A, Niksic M, et al. Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushroomsAgaricusbisporus,Agaricusbrasiliensis,GanodermalucidumandPhellinuslinteus[J]. Food Chemistry, 2011, 129: 1667-1675.

