紫外诱变对微绿球藻生长和营养成分的影响
叶 丽, 蒋霞敏, 孙志鹏, 高秀芝, 张泽凌
(宁波大学 海洋学院, 浙江 宁波 315211)
微绿球藻(Nannochloropsisoculata)是一种海洋单细胞微藻,具有易培养、营养丰富的特点,在水产养殖中应用较为广泛,是近两年在泥蚶、蟹、虾等育苗及轮虫培养中应用较佳的经济饵料[1-4]。微绿球藻作为二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等高度不饱和脂肪酸的新来源日益受到国内外科研工作者的重视。
目前由于微绿球藻生长速率低,采收困难和藻种退化等问题已严重阻碍微绿球藻产业的发展[5]。因此高产优质微绿球藻藻株的筛选成为当前的一个重大课题。采用He_Ne激光、γ射线以及甲基磺酸乙酯(EMS)在微绿球藻育种中的应用已见报道[6-9],而紫外辐射在微绿球藻育种中的应用研究尚未见报道。本文针对紫外辐射微绿球藻的诱变效应进行研究,以期利用紫外辐射诱变筛选出生长快、高产EPA的优良藻株,为海洋微藻的开发利用提供理论依据。
1 材料与方法
1.1 藻种培养
试验用微绿球藻由宁波大学藻种室提供。采用MAV[10]培养液,智能光照箱培养,培养条件:光照强度 70 μmol·m-2·s-1,温度 25℃,光暗周期 12 h∶12 h, 培养容器1000 mL三角烧瓶,培养水体1000 mL,每天定时摇动2次。
1.2 紫外诱变与筛选
取对数生长期的微绿球藻藻液 10 mL 置于直径9 cm的培养皿中,使藻液均匀平铺在培养皿底部,藻液厚1cm,用30 W 紫外灯,照射距离为50 cm。设置不同辐照时间(0、5、10、15、20、25和30 min),各设3 平行。辐照后立即将藻液接入 100 mL新鲜培养基,暗培养24 h,后转入智能光照箱内培养,培养条件同1.1。经数代培养后,各组重新接种到100 mL新鲜培养基中培养,接种密度10×104cell/mL。7 d 后进行生长速率检测。
1.3 突变株与出发株的比较试验
选取生长速率较快的2株突变株(MN-1和MN-2)和出发株进行扩大培养,培养容器5 L三角烧瓶,培养水体5 L,初始接种密度100×104cell/mL,采用室内培养架上培养。培养条件:日光灯光源,光照强度 60 μmol·m-2·s-1,水温 25℃,光暗周期 12 h∶12 h,其他条件同1.1。
1.4 藻体收集与保存
培养至对数末期,4500 r/min离心(Thermo)5~10 min,蒸馏水洗涤2~3次,离心、收集藻泥,经冷冻干燥,低温(-20℃)保存待用。
1.5 营养成分测定
生物量的测定采用冷冻干燥称重法;粗蛋白含量的测定采用凯氏定氮法(GB/T5009.5-2010);多糖含量的测定采用苯酚-硫酸法,总脂含量的测定采用氯仿-甲醇法[12, 13]。脂肪酸的测定:在抽提的总脂中加入5%~6%KOH甲醇溶液(V/V 4∶1),充N2 1 min,60℃水浴皂化甲酯化[11],然后用日本SHIMADZU公司QP2010气相色谱-质谱分析仪进行分析,参考脂肪酸标准和文献[12-14],用面积归一法计算出各脂肪酸的百分含量(以占脂肪酸含量的百分比表示)。
1.6 数据统计与分析
生长速率K=(lnNt-lnN0)/t,其中Nt表示培养t时间后的细胞数,N0表示初始细胞数目,t表示试验时间。数据用Excel 2003进行常规数据处理后,用SPSS18.0软件对数据进行单因素方差分析(One-way ANOVA),当差异显著时进行Turkey’s多重比较法进行组间差异显著性检验。实验数据均采用平均值±标准偏差表示。
2 结果与分析
2.1 不同紫外辐照时间对藻生长速率的影响
在起始密度相同的情况下,7 d后,各处理组藻株的生长速率如图1所示。与出发株相比,辐照15 min的突变株(MN-1)和辐照 20 min的突变株(MN-2),生长速度明显加快,分别提高了21.08%和6.25%。其余辐射的突变藻株,藻体颜色变浅,生长速率显著降低(P>0.05)。因此,选择突变株MN-1和MN-2作实验用藻株。
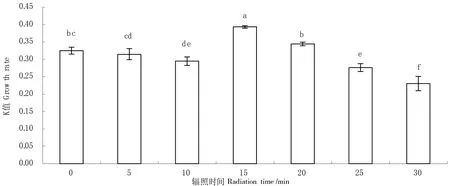
图1 不同紫外辐射时间对微藻生长速率的影响
2.2 生物量比较
微绿球藻突变株与出发株在生物量的积累上发生了改变(图2)。与出发株(142.3 mg/L)相比,突变株MN-1的生物量增加了15.55%(163.0 mg/L),差异显著 (P<0.05);突变株MN-2的生物量增加了5.62%(150.3 mg/L),但差异不显著(P>0.05)。
2.3 粗蛋白、多糖、总脂含量比较
微绿球藻突变株与出发株其粗蛋白的含量不同(图3)。与出发株的粗蛋白含量(33.01%)相比,突变株MN-1 (32.86%)和突变株MN-2 (27.56%)稍微有所下降,但三者之间均无显著差异(P>0.05)。

图 2 突变株与出发株生物量的比较
微藻的总脂含量也有所改变(图3)。出发株的总脂含量仅有23.45%,MN-1和MN-2的总脂含量分别增加了9.81%和7.93%,均显著高于出发株(P<0.05), MN-1和MN-2的总脂无显著差异(P>0.05)。
紫外辐射处理后突变株的多糖含量也有变化(图3)。出发株的多糖含量为1.75%,而突变株MN-1的多糖含量有所下降,为1.62%,与出发株无显著差异(P>0.05),突变株MN-2的多糖含量增加了13.72%,达到了1.99%,与出发株及MN-1均存在显著差异(P<0.05)。

图 3 突变株和出发株粗蛋白、多糖、总脂含量的比较(干重基础)
2.4 脂肪酸组成比较
如表1所示,共检测出9种脂肪酸,包括3种饱和脂肪酸(SFA) 、3种单不饱和脂肪酸(MUFA)和3种多不饱和脂肪酸(PUFA)。3个藻株的脂肪酸组成没有变化,但脂肪酸各组分含量发生了改变。SFA以MN-2的含量较高(39.16%),显著高于MN-1(31.2%)和出发株(30.38%);MUFA以出发株(34.4%)与MN-1(34.7%)较高,显著高于MN-2(30.52%);n9-MUFA以出发株(11.29%)较高,显著高于MN-1(9.56%)和MN-2(9.41%);PUFA 以MN-1(34.41%)与出发株(35.23%)较高,二者无差异,而出发株(35.23%)显著高于MN-2(30.32%),差异显著; C20:5(n3)以 MN-1最高(28.10%),比出发株(27.59%)增加了1.81%,差异显著(P<0. 05),MN-2(22.16%)明显低于出发株(P<0. 05),减少了19.71%;对于n-6PUFA,MN-2含量最高(8.16%),出发株次之(7.64%),MN-1最低(6.31%)。
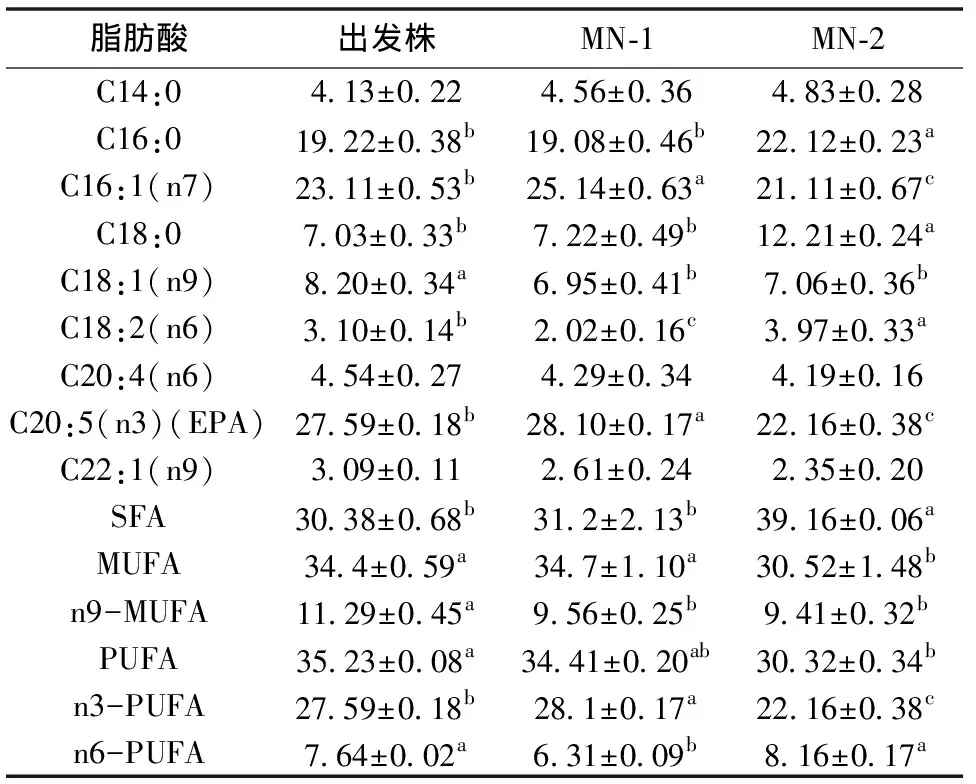
表 1 突变株与出发株脂肪酸组成的比较(%)
3 讨论
3.1 紫外诱变对微绿球藻生长速率的影响
本实验通过不同的紫外诱变时间,获得了6个微绿球藻突变株。其中紫外辐射15 min的突变株(MN-1)和紫外辐射20 min的突变株(MN-2)的生长速率均有不同程度的增加,紫外辐射15 min的突变株MN-1尤为显著,此时微藻的生长速率达到了0.39,相对微绿球藻出发株增加了21.08%;其余时间的紫外辐射突变株的生长速率均有所下降。这是由于紫外辐射对微藻基因的改变是非定向的,不同的紫外辐射引起的突变也各不相同,因此不同微藻突变株的生长速率也不一样。
3.2 生物量、粗蛋白、多糖及总脂的比较
突变株与出发株在生物量、粗蛋白和总脂含量上均有不同程度的改变。本实验通过紫外诱变技术,得到2株突变藻株,其生物量最高为160.3 mg/L,显著高于出发株的142.3 mg/L。 但低于Ma等[15]和Kandiah等[8]的报道,这种差异与出发藻株有关。3株微藻的粗蛋白含量为32.56%~33.01%,与黄旭雄等[4]测得的蛋白含量稍有些出入。这可能与微藻的培养条件、样品处理及检测条件的不同有关。而微藻多糖的研究鲜有报道。微藻的总脂含量受诸多因素的影响,Fábregas等[16]指出微绿球藻总脂与光照有关,Chiu等[17]报道的微绿球藻总脂含量为22.7%~29.7%,具体与CO2的充入量有关。魏东等[18]报道微绿球藻的总脂含量占干重的20%~54.5%,具体与氮源、N/P和生长期有关。本试验测得的微绿球藻总脂肪含量为23.45%~25.75%,与上述报道基本一致。但与Yin等[19]报道微绿球藻总脂15.50%、蒋霞敏等[10]报道微绿球藻总脂6.52%有较大的差异。
紫外辐射引起微绿球藻生物量、粗蛋白、多糖、总脂及脂肪酸含量的变化,可能是因为为微绿球藻吸收紫外光后,微藻的DNA分子形成嘧啶二聚体,二聚体的出现会减弱双键间氢键的作用,并引起双链结构扭曲变形,阻碍碱基间的正常配对,使分子结构发生变化,诱导微藻体内代谢过程的变化,从而产生上述参数的变化。
3.3 脂肪酸的比较
在3株微藻中均只检测到9种脂肪酸,与Yin等[19]报道的微绿球藻中检测到31种脂肪酸有较大出入,这可能与微绿球藻的培养条件、样品处理及检测条件的不同有关。3株微藻均含有丰富的16:0、16:1(n7)、20:5(n3),其含量均高于19.08%,这与Jane等[7]的研究结果相一致。但与Ma等[15]、Thi等[9]报道的含量最高的脂肪酸为16:0、16:1(n7)有出入。突变株MN-2在MAV培养基中培养7 d的饱和脂肪酸(SFA)含量为39.16%,显著高于出发株和突变株MN-1,而 Thi等[9]报道的微绿球藻EMS突变株在 f/2培养基中培养18 d 时SFA的含量可达45.9%,Ma[15]等报道的微绿球藻重离子束诱变株在BG-11培养基中培养5 d时SFA的含量可达58.1%。3株微藻的MUFA含量为30.52%~34.7%,这与Ma[15]等报道的微绿球藻及其突变株的MUFA含量为29.7%~38.5%接近,但与Thi[9]等报道的微绿球藻及其随机突变株的MUFA含量34.8%~45.8%有差异。3株微藻的PUFA含量为30.32%~35.23%, 其中2个突变株的总脂含量虽有不同程度的增加,但PUFA的含量均有所降低。这与李秀波等[20]报道的微藻PUFA含量随着其油脂含量的增加而下降相符合。在Ma[15]等的报道中也出现了同样的趋势。3株微藻的EPA含量为22.16%~28.10%,远高于Ma[15]等报道的微绿球藻及其突变株EPA含量(6.1%~11.8%),但Yin[19]等报道的微绿球藻的EPA含量高达38.39 %,原因可能是培养条件、检测方法及藻种的不同所导致的。
4结论
本次研究从6株突变株中筛选出了2株生长率高于出发株的藻株MN-1和MN-2,并在指数生长末期对其与出发株就生物量、粗蛋白、多糖、总脂及脂肪酸进行了比较发现:MN-1的生长速率增加21.08%,生物量增加14.55%,粗蛋白含量增加2.54%,总脂含量增加9.81%, EPA增加1.81%,SFA增加2.70%; MN-2的生长率增加6.25%,生物量增加5.62%,多糖增加13.26%,总脂增加7.93%, SFA增加28.9%。结合微藻生长特性,并从生物量、粗蛋白含量、多糖含量、总脂含量及脂肪酸组成等营养学角度综合考虑,通过紫外诱变改良微绿球藻具有良好的开发应用前景。
参考文献:
[1]Urano K, Maruyama K, Ogata Y, et al. Characterization of the ABA-regulated global responses to dehydration inArabidopsisby metabolomics[J]. Plant Journal, 2009, 57(6): 1065-1078.
[2]Attilio C, Alessandro A C, Erika Y O, et al. Effect of temperature and nitrogen concentration on the growth and lipid content ofNannochloropsisoculataandChlorellavulgarisfor biodiesel production[J]. Chemical Engineering and Processing, 2009, 48(6):1146-1151.
[3]Simone P, Sigurd S, Martin M. Pressurized fiuid extraction of polyunsaturated fatty acids from the microalgaNannochloropsisoculata[J]. Biomass and Bioenergy, 2012, 47(1):474-482.
[4]黄旭雄, 周洪琪, 朱建忠, 等.不同生长阶段微绿球藻的营养价值[J].水产学报, 2004, 28(4):477-480.
[5]蒋霞敏.温度、光照、氮含量对微绿球藻生长及脂肪酸组成的影响[J].海洋科学, 2002, 26(8):9-12.
[6]赵萌萌, 王卫卫. He_Ne激光对钝顶螺旋藻的诱变效应[J].光子学报, 2005, 34(3):400-403.
[7]Jane C S, Alex L, Assaf S K, et al. A mutant ofNannochloropsisdeficient in eicosapentaenoic acid production[J]. Phytochemistry, 1995, 40(3): 807-814.
[8]Kandiah A, Guruvaiah M, Milton S, et al. Characterization of microalgaNannochloropsissp. mutants for improved production of biofuels[J]. Applied Energy, 2012, 96 (1): 371-377.
[9]Thi T Y D, Jeffrey P O. Enhanced intracellular lipid inNannochloropsissp. via random mutagenesis and flow cytometric cell sorting[J]. Algal Research, 2012, 1(1):17-21.
[10]蒋霞敏, 郑亦周.14种微藻总脂含量和脂肪酸组成研究[J].水生生物学报, 2003, 27(3):243-247.
[11]Bligh E G, Dyer W J. A rapid method of lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiolology, 1959, 37:911-917.
[12]Reiser S, Somerville C. Isolation of mutants ofAcinetobactercalcoaceticusdeficient in wax ester synthesis and complementation of one mutation with a gene encoding a fatty acyl-coenzyme A reductase[J]. Journal of Bacteriology, 1997, 179(9):2969-2975.
[13]蒋霞敏, 柳敏海, 邢晨光.不同生态条件对绿色巴夫藻生长及脂肪酸组成的影响[J].水生生物学报, 2007, 31(1):88-93.
[14]Chen Y C. The biomass and total lipid content and composition of twelve species of marine diatoms cultured under various environments [J]. Food Chemistry, 2012, 131(1):211-219.
[15]Ma Y B, Wang Z Y, Zhu M, et al. Increased lipid productivity and TAG content inNannochloropsisby heavy-ion irradiation mutagenesis[J]. Bioresource Technology, 2013, 136:360-367.
[16]Fabregas J, Masdea A, Domnguez A, et al. The cell composition ofNannochloropsissp. changes under different irradiances in semicontinuous culture[J]. World Journal of Microbiology and Biotechnology, 2004, 20(1):31-35.
[17]Chi S Y, Kao C Y, Tsai M T, et al. Lipid accumulation and CO2utilization ofNannochloropsisoculatain response to CO2aeration[J]. Bioresource Technology, 2009, 100(2):833-838.
[18]魏 东, 张学成, 隋正红, 等.氮源和N/P对眼点拟微球藻的生长、总脂含量和脂肪酸组成的影响[J].海洋科学, 2000, 24(7):45-50.
[19]Yin X W, Min W W, Lin H J, et al. Population dynamics, protein content, and lipid composition ofBrachionusplicatilisfed artificial macroalgal detritus andNannochloropsissp. diets [J]. Aquaculture, 2013, 380-383(4):62-69.
[20]李秀波, 徐旭东, 孔任秋.五种微绿球藻产油和产多不饱和脂肪酸的研究[J].水生生物学报, 2010, 34(5):893-897.

