渔山列岛浮游动物的群落结构特征分析
张泽凌, 蒋霞敏, 夏明月, 王 弢, 叶 丽
(宁波大学 海洋学院, 浙江 宁波 315211)
渔山列岛是国家级海洋生态特别保护区,位于浙江省宁波象山半岛东南,处浙江近海上升流的核心部位,受台湾暖流影响,营养盐丰富,是中国东部沿海典型海岛。
浮游动物是海洋生态系统中的重要组成成分,既可作为许多鱼类的优质食物,又可调节控制浮游植物和浮游微生物的发生和发展[1-5]。因此,研究掌握浮游动物的种类组成和群落结构特征对了解与研究海洋生态系统的结构、功能运转以及渔业资源和渔场等具有十分重要的意义[6]。近年来国内外学者都对浮游动物进行了较广泛的调查分析,调查海域主要集中在南麂列岛[7]、连云港近岸[8]、三亚湾[9]、南海北部[10]、杭州湾[11]、福建罗源湾[12]、大亚湾海域[13]、深圳湾[14]及瓯江口[15]。然而对渔山列岛海区的浮游动物迄今为止未见报道。本文选择渔山列岛为调查区域,分析调查海域浮游动物的种类组成、优势种类、群落结构等特征参数,以期为渔山列岛海域生物多样性的调查和保护提供基础参数和科学依据。
1 材料和方法
1.1 采样站点和时间
根据渔山列岛环境特点,设置8个采样站位(图1)。分别为:S1西码头;S2大岙;S3东岙;S4灯塔;S5仙人桥;S6大白礁;S7白礁尾;S8白礁湾。
分别于2011年10月28日(秋季)、2012年4月7日(春季)和2012年7月7日(夏季)在以上8个站位对渔山列岛进行样品的采集,冬季因无交通船,所以未采集。
图1 渔山列岛浮游动物站位分布
1.2 采样方法
样品的采集、处理与分析等均依照《海洋调查规范》[16]执行,物理指标:温度、pH值、溶氧、盐度用YSI556MPS便携式水质测定仪在采样现场测定,透明度用透明度盘测定;化学指标:氨氮、总氮、总磷、亚硝酸盐用Test,N Tube方法[17]在实验室测定。
1.3 多样性分析
分析浮游动物群落多样性时采用香农(Shannon-Wiener)指数H′、马格利夫(Margalef)指数d和均匀度(Pielou)指数J。
H′ =-∑Pi×log2Pi(Pi=ni/N) ,式中,S为物种数;N为同一样品中的个体总数;ni为第i种的个体数[18]。
d= (S-1) / lnN,式中,S为物种数;N为同一样品中的个体总数[19]。
J=H′ / log2S,式中,S为物种数;H′为香农指数[20, 21]。
1.4 数据分析与统计
应用Excel进行数据处理和图表制作,应用SPSS19.0分析渔山列岛浮游动物的丰度、多样性指数与环境因子的相关性。
2 结果和分析
2.1 种类组成与区域分布
2.1.1 种类组成
本次调查共鉴定到浮游动物45种,其中原生动物类14种,占31.1%;水母类5种,占11.1%;轮虫类3种,占6.7%;枝角类3种,占6.7%;桡足类13种,占28.9%;端足类一种,占2.2%;磷虾类1种,占2.2%;浮游幼虫5种,占11.1%(图2)。原生动物以根状拟铃虫(Tintinnopsisradix)为最优群类,桡足类以中华哲水蚤 (calanussinensis)为最优群类,台湾温剑水蚤(Thermocyclopstaihokuensis)次之,挪威小星猛水蚤 (Microsetellanorvegica)第3位,浮游幼虫以桡足类幼虫 (Copepodite nauplinua)为最优势种。

图2 各类浮游动物总种数所占比例
2.1.2 区域分布与月份变化
浮游动物种类组成随月份变化明显(图3)。原生动物自4月(10种)减少到7月(6种),保持到10月最少5种。桡足类7月共检出12种,占总种数的46.3%;10月8种,占总种数的30.8%。浮游幼虫4月检出3种,7月5种,10月5种。枝角类4月最多3种,7月最少1种,10月2种。水母类7月最多5种,4月最少1种,10月3种。总体看来,浮游动物种数的变化规律为7月、10月较多,4月较少。

图3 渔山列岛浮游动物种类月份变化
调查期间,位于渔山列岛东岙S3站浮游动物种数最少,仅26种,除S1外位于列岛外侧冬南部的站位S4、S5、S6浮游动物种数较分别达到36种、32种、34种。可见,浮游动物种数的全年平面分布基本呈现外侧(东南)高于内侧(西北)的趋势(图4)。

图4 渔山列岛浮游动物种类站位变化
2.2 优势种组成
渔山列岛海域浮游动物的优势种月份变化明显,调查海域3个季度月共出现浮游动物优势种10种,桡足类、原生动物和浮游幼虫是渔山列岛海域浮游动物优势种的主要组成。其中中华哲水蚤、桡足类幼虫、根状拟铃虫在3个月份均是优势种。4月优势种主要有中华哲水蚤 、台湾温剑水蚤 、根状拟铃虫、中华拟铃虫 (Tintinnopsissinensis)、桡足类幼虫;7月优势种主要有根状拟铃虫、中华哲水蚤、台湾温剑水蚤、挪威小星猛水蚤、太平洋纺锤水蚤 (Acartiapacifica),短尾类蚤状幼虫(Brachyura zoea);10月优势种主要有根状拟铃虫、王氏拟铃虫(Tintinnopsiswangi)、中华哲水蚤、台湾温剑水蚤、桡足类幼虫和面盘幼虫(Veliger larva)(表1)。

表 1不同月份的浮游动物优势种类
“+”表示为该月份优势种。
2.3 浮游动物密度和生物量时空分布
渔山列岛3个月份的浮游动物密度分别为0.298×103ind/m3~1.566×103ind/m3,0.833×103ind/m3~1.633×103ind/m3,1.065×103ind/m3~3.966×103ind/m3。各站点浮游动物平均密度变化为10月>7月>4月。从站位上来看,浮游动物在S1、S4、S5、S6的密度要明显高于在其他几个站点的密度(图5)。
渔山列岛3个月份浮游动物总生物量分别为0.0016~0.0050 mg/L,0.0074~0.0159 mg/L,0.0038~0.0125 mg/L。7月平均总生物量在3个月份中最高,依次为7月>10月>4月,其中S5生物量在本次调查中居站位之首,为0.036 mg/L。各站位中S4、S5、S6生物量要相对高于其他几个站点,渔山列岛浮游动物生物量呈现西高东低的趋势(图6)。
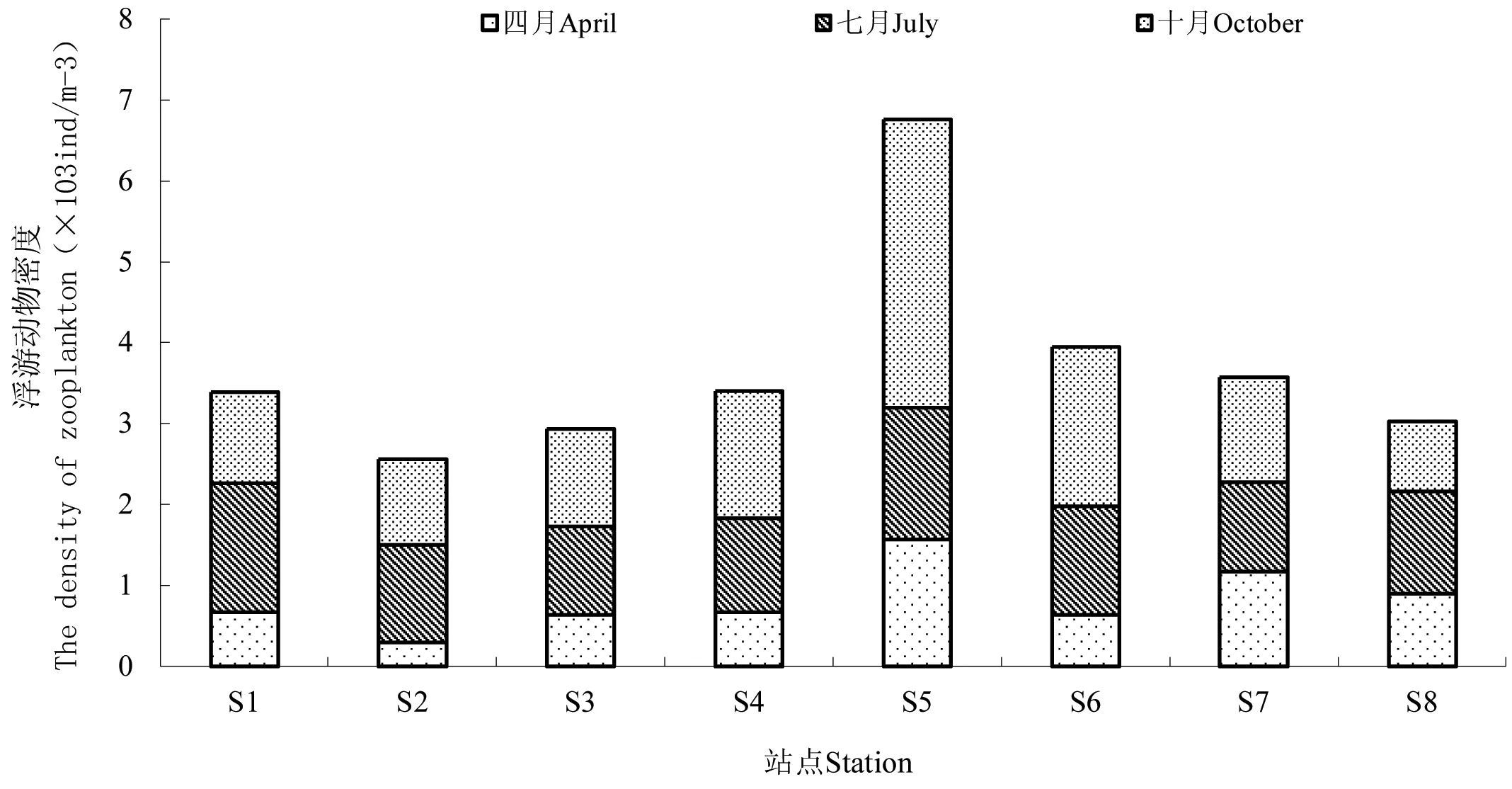
图5 渔山列岛浮游动物密度变化

图6 渔山列岛浮游动物生物量变化
2.4 生物多样性指数分析
浮游动物多样性指数按月份来分,4月、7月、10月的香农指数分别为2.638~3.344,3.152~3.496,2.691~3.285;马格利夫指数分别为0.476~0.746,0.714~0.930,0.572~0.861;均匀度指数分别为1.220~1.395,1.252~1.336,1.211~1.301(表2)。从表2可以看出,调查海区浮游动物的多样性指数(H′)月平均数值,7月>10月>4月;丰富度指数(d)平均变化数值,7月>10月>4月;均匀度指数(J)变化数值,为7月=4月>10月。结合多样性指数及丰富度指数可见,调查期间渔山列岛浮游动物的生物多样性7月最高,物种较丰富。
调查期间,各站位浮游动物多样性指数(H′)为2.64~3.50,最低值出现在4月S2站,最高值出现在7月S1站,各站3个季节月多样性指数平均值在2.96~3.35,S8站最低,S1站最高;各站位丰富度指数(d)为0.47~0.93,最低值为4月S2站,最高7月S3站,各站3个季节月丰富度指数平均值在0.60~0.84,S2站最低,S1站最高;各站位均匀度指数(J)为1.21~1.40,最低值为10月S8站,最高4月S4站,各站3个季节月丰富度指数平均值在1.26~1.31,S8站最低,S6站最高。

表2 不同月份站位生物指数
3 讨论
3.1 渔山列岛浮游动物的组成
渔山列岛是国家级海洋生态特别保护区,地处鱼山渔场,是浙江近海上升流的核心部位,周边海域多种流系的交汇产生多变的温盐水体,加之受台湾暖流影响,多种水系交汇使其具有特殊的海洋生态特征,营养盐丰富,水质肥沃,导致其浮游动物种类繁多。
关于渔山列岛的浮游动物的分布未见报道,仅在本次调查中鉴定出45种浮游动物,低于舟山渔场及附近海域150种[22],南麂列岛69种[7]。其中原生动物类14种,占31.1%;桡足类13种,占28.9%,低于南麂列岛桡足类所占比列39.1%;渔山列岛浮游动物群落是以桡足类和原生动物为主导的群落,在桡足类中中华哲水蚤和台湾温剑水蚤占据着主要地位,7月挪威小星猛水蚤和太平洋纺水蚤也成为优势种;原生动物中拟铃虫属占据主导地位,其中根状拟铃虫在海域调查的3个月份当中均为优势种,王氏拟铃虫和中华拟铃虫在个别月也是优势种;浮游幼虫也是本次调查中占重要成分的一类,其中桡足类幼虫,无节幼体(nauplius)等出现频率较高;水母类(Auralia)、端足类(Amphipoda)、磷虾类(Euphausiacea)等在调查中偶尔出现,但生物量不高。
3.2 浮游动物的月份变化
在本次调查区域中,渔山列岛浮游动物的月份变化明显。7月最多31种,与舟山渔场及附近海域季节变化相似[22],4月最少22种。其中7月桡足类种类最多13种,占总种类的26.7%;10月浮游幼虫种类最多,占总种类的11.1%;4月原生动物种类最多9种,占总种类的20.0%。渔山列岛7月丰度最高为0.833×103ind/m3~1.633×103ind/m3,与大亚湾夏季最高丰度1013.38 ind/m3相似[13]。7月和10月的平均水温相对较高,是桡足类和原生动物类的密度高峰期,因此在这两个月份当中桡足类占据一定的优势地位。4月平均水温较低为14.07℃,相对于7月、10月来说,浮游动物的种类和丰度就相对较小了。在优势种中,中华哲水蚤是中国近海的常见优势种,属于外海型[23],其中中华哲水蚤在7月、10月这两个月一直保持着第一优势种的位置。
3.3 浮游动物的区域变化
在本次调查中,渔山列岛海域的浮游动物区域变化明显。调查显示S4(灯塔)在所有站点中种类数最多,共鉴定出24种,丰度为1.13×103ind/m3,生物量为0.025 mg/L;S5(仙人桥)共鉴定出23种,丰度和生物量均位于所有站点之首,分别为2.25×103ind/m3,0.031 mg/L;S7(白礁尾)在所有站点中生物量最少为0.015 mg/L,共鉴定出18种,丰度为1.19×103ind/m3。相比较而言,站位S1、S4、S5、S6的浮游动物种类较多,密度和生物量也比较大,这可能是因为S4、S5、S6位于列岛外侧东南部,暖流接触的更为直接。而S1推测是因为码头附近水质富营养化较高,导致浮游动物种类较繁盛。
3.4 浮游动物与环境因子间关系
浮游动物的生长繁殖与周围的环境变化紧密相关。从渔山列岛浮游动物与环境因子相关性分析可知(表3),调查期间水温与丰度相关性不大,与多样性指数(H′)在0.01水平上正相关,相关性系数为0.584,与丰富度指数(d)在0.01水平上呈显著正相关,相关性系数为0.700,与均匀度(J)相关性不是很强,说明随着水温的升高,海区浮游动物群落多样性有增大的趋势。

表3 浮游动物丰度及生物指数与环境因子的相关系数
*P<0.05;**P<0.01。
盐度是海洋浮游动物生长不容忽视的环境因子[24, 25],调查结果表明盐度与浮游动物的多样性指数在0.01水平上呈显著负相关,相关性系数为0.579,与丰富度指数在0.01水平上呈正相关,相关性系数为0.588,与丰度和均匀度相关性不强。调查结果表明,盐度越大多样性越小,丰富度越大。
pH、溶氧(DO)与浮游动物的生长息息相关[26]。pH与浮游动物的丰度在0.05水平上呈正相关,相关性系数为0.430,H′、d、J均与pH相关性不是很强;DO与丰度、H′、d、J相关性不强。
营养盐是浮游动物赖以生存的主要环境因子之一,营养盐除了直接影响浮游动物的渗透压,营养盐的变化还会影响营养浮游植物的数量和分布从而影响浮游动物食物的来源[27]。从调查情况看,总氮与均匀度呈正相关,亚硝酸盐与丰富度呈负相关,其他化学因子与多样性相关性均不是很强。
根据多样性指数对反应水体状况的来看,调查期间渔山列岛Margalef指数平均值为0.8925(<3)属于严重污染;Shannon-Weiner指数平均值为3.9(>3)为清洁—寡污型;Pielou指数平均值为1.29(>0.8~0.1)为清洁型。虽然渔山列岛浮游动物种类较多,群落结构较稳定,从H′、J反应出的水质情况良好,但丰富度d显示水质污染严重的问题不容忽视。从调查结果发现,渔山列岛原生动物和桡足类占主要成分,而原生动物生长旺盛的水体营养化程度比较高。据有关资料显示,桡足类、枝角类比较喜欢生活在清洁的水体中[28],而该片海域中轮虫的数量相对稀少,所以渔山列岛水体是污染程度相对较小的水体,但营养化程度较高,应加强监测预防赤潮等事件发生。
参考文献:
[1]吴振斌, 刘爱芬, 吴晓辉, 等. 人工湿地循环处理的养殖水体中浮游动物动态变化[J]. 应用与环境生物学报, 2007, 13(5): 668-673.
[2]杨 青, 王真良, 樊景凤, 等. 北黄海秋、冬季浮游动物多样性及年间变化[J]. 生态学报, 2012, 32(21): 6747-6754.
[3]郑小燕, 王丽卿, 盖建军, 等. 淀山湖浮游动物的群落结构及动态[J]. 动物学杂志, 2009, 44(5): 78-85.
[4]Swiercowski A, Godlewska M, Poltorak T. The relationship between the spatial distribution of fish, zooplankton and other environmental parameters in the Solina reservoir[J]. Aquat Living Resour, 2000, 13:373-377.
[5]Marco S, Daria V, Fiorenza G. Differential responses of zooplankton assemblages to environmental variation in temporary and permanent ponds[J]. Aquatic Ecology, 2008, 42(1): 129-140.
[6]陈小庆, 陈 斌, 黄 备, 等. 夏季舟山渔场及邻近海域浮游动物群落结构特征分析[J]. 动物学研究, 2010, 31(1): 99-107.
[7]纪焕红, 叶属峰. 长江口浮游动物生态分布特征及其与环境的关系[J]. 海洋科学, 2006, 30(6): 23-31.
[8]田慧娟, 刘吉堂, 王维志. 连云港近海域浮游动物种类组成及其多样性[J]. 淮海工学院学报:自然科学版, 2009, 18(4): 73-76.
[9]时 翔, 王汉奎, 谭烨辉, 等. 三亚湾浮游动物数量分布及群落特征的季节变化[J]. 海洋通报, 2007, 26(4): 42-49.
[10]Huang S Q. Liangm in preliminary study of microzooplankton grazing and community composition in the north of South China sea in autumn[J]. Marine Science Bulletin, 2007, 9(2): 457-469.
[11]王晓波, 魏永杰, 秦铭俐, 等. 杭州湾生态监控区浮游动物多样性变化趋势研究[J]. 海洋环境科学, 2008, 27 (1): 67-31.
[12]齐衍萍, 陈 洪, 朱延忠, 等. 福建罗源湾浮游动物群落特征[J]. 中国海洋大学学报, 2010, 40(1): 39-46.
[13]方 良, 李纯厚, 杜飞雁, 等. 大亚湾海域浮游动物生态特征[J]. 生态学报, 2010, 30(11): 2981-2991.
[14]张才学, 周 凯, 孙省利, 等. 深圳湾浮游动物的群落结构及季节变化[J]. 生态环境学报, 2010, 19(11): 2686-2692.
[15]高 倩, 徐兆礼. 瓯江口夏季浮游动物种类组成及其多样性[J]. 生态学杂志, 2009, 28(10): 2048-2055.
[16]GB/T12763.6-2007[S], 海洋调查规范第6部分:海洋生物调查, 2007.
[17]王文萍, 郭周芳, 尚伟伟. 水中氨氮的测定方法[J]. 水科学与工程技术, 2012, 26(3): 26-28.
[18]Shannon C E, Weaver W. The mathematical theory of communication[M]. Urbana: University of Illinois Press, 1963.
[19]Margalef D R. Information theory in ecology[J]. General Systems, 1958, 3: 36-71.
[20]Pielou E C. Species diversity and pattern diversity in the study of ecological succession[J]. Journal of Theoretical Biology, 1966, 10: 370-383.
[21]高 远, 慈海鑫, 亓树财, 等. 沂河4条支流浮游植物多样性季节动态与水质评价[J]. 环境科学研究, 2009, 22(2): 176-180.
[22]俞存根, 陈小庆, 胡颢琰, 等. 舟山渔场及邻近海域浮游动物种类组成及群落结构特征[J]. 水生生物学报, 2011, 35(1): 183-193.
[23]宋 伦, 周遵春, 王年斌, 等. 辽东湾浮游动物多样性及其与海洋环境因子的关系[J]. 海洋科学, 2010, 34(3): 35-39.
[24]Kenneth O C. Zooplankton distribution, abundance and biomass relative to water masses in eastern and central Aleutian Island passes[J]. Fisheries Oceanography, 2005, 14(1): 77-92.
[25]Heidrum F, Jonathan G. Effect of preparation and preservation procedures on carbon and nitrogen stable isotope determinations from zooplankton[J]. Rapid Communication in Mass Spectrometry, 2003, 17(23): 2605-2610.
[26]杨品红, 王志陶, 徐黎明. 人工控制条件下津市西湖生态因子的灰关联分析[J]. 水生态学杂志, 2010, 3(1): 7-12.
[27]赵彩霞, 李岩松. 黑龙江上游中游浮游动物的种类、密度及多样性研究[J]. 水产学杂志, 2007, 20(1): 80-84.
[28]ISO 14669-1999[S], Water quality-determination of acute lethal toxicity to marine copepods (Copepoda, Crustacea), 1999.
——以“不同咖啡因饮料对水蚤心率的影响”为例

