核酸免疫制备鼠抗棉铃虫FK506结合蛋白的多克隆抗体
朱燕 张富春 马纪 黄丽娜 刘小宁
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
核酸免疫制备鼠抗棉铃虫FK506结合蛋白的多克隆抗体
朱燕 张富春 马纪 黄丽娜 刘小宁
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
利用电注射基因导入法制备小鼠抗棉铃虫FK506结合蛋白(FKBP12)的多克隆抗体,并通过Western blot验证抗体与抗原的特异性结合。构建重组质粒pcDNA3-FKBP12并测序验证序列的正确性,利用基因导入法将重组质粒pcDNA3-FKBP12注射到小鼠体内,免疫4次后用ELISA检测法确定抗体的效价,并对抗体的特异性结合进行Western blot以及免疫组化检测。结果表明,小鼠抗FK506结合蛋白血清的效价达到1∶25 600,Western blot结果显示此抗血清能与融合蛋白His-FKBP12结合,免疫组化结果表明在棉铃虫3龄幼虫不同组织中FKBP12均有表达。说明电注射基因导入法制备的小鼠抗FK506结合蛋白的抗体在滴度和特异性结合方面都达到预期要求。
棉铃虫 FK506结合蛋白 多克隆抗体
FKBP在动、植物的各种细胞中均有分布,含量丰富,大小从12-135 kD不等[1]。除了肽基脯氨酰基异构酶活性(PPIase)外,很多FKBPs还参与其他一些生理生化活动,如基因转录(FKBP25和FKBP38)、 内 质 网 蛋 白 分 泌(FKBP13和FKBP65)[2]、膜结合表皮生长因子受体(TGFβR)介导的信号调节(FKBP12)[1]、细胞内Ca2+释放(FKBP12)及甾体激素受体复合物的形成(FKBP52)等[3]。
FKBP12是FKBPs家族中的一种重要的胞浆蛋白,到目前为止在哺乳动物中发现FKBP12的两种亚型分别命名为FKBP12和FKBP12.6,这两个FKBP12都有108个氨基酸组成,分子量分别是11.95 kD和11.78 kD。而本实验组研究的棉铃虫
FK506结合蛋白,分子量在11.88 kD,已有研究表明,棉铃虫FKBP12参与棉铃虫滞育,20-羟基蜕皮激素能够诱导发育,解除滞育,而FKBP12与20-羟基蜕皮激素(20E)的作用相反,参与维持滞育的过程[4],而在其它昆虫中还未见相关报道。
棉铃虫(Helicoverpa amigera)是一种世界性的农业和经济作物害虫,棉铃虫表现出对多种杀虫剂的抗性,且能够不断对新的杀虫剂产生抗药性[5],导致棉铃虫爆发成灾,造成农作物减产。为有效控制棉铃虫抗药性,减少棉铃虫对农作物的危害,本实验组欲从基因表达调控水平阐述棉铃虫产生抗性的机理,以期在基因表达水平阻断棉铃虫产生抗药性。已有研究证实CYP6B6家族基因的表达与植物次生物质的代谢调节有密切关系[6],前期本实验组用一定浓度植物次生物质2-十三烷酮处理棉铃虫,构建了cDNA文库,经酵母单杂交筛选得到FK506结合蛋白的基因全长。在此基础上,本研究构建pcDNA3-FKBP12重组质粒,免疫昆明小鼠制备抗体,经Western blot验证抗体能与纯化的融合蛋白His-FKBP12特异性结合[7],对3龄幼虫免疫组化,使抗体与棉铃虫不同组织中天然的FKBP12结合,旨在为深入探究FKBP12在棉铃虫体内的表达奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物与质粒 pcDNA3质粒为本实验室保存,为真核表达载体;昆明白小鼠购买于新疆医科大第一附属医院。
1.1.2 试剂与仪器 Taq DNA聚合酶、T4 DNA连接酶、DNA Marker、各种限制性内切核酸酶均为大连TaKaRa公司产品,蛋白质相对分子质量标准物来自Thermo Scientific公司,辣根过氧化物酶标记的山羊抗鼠IgG购自中衫金桥公司,大肠杆菌DH5α菌株感受态细胞购买于北京全式金公司,醋酸纤维素膜是Millipore公司产品,ELISA板购自ET BIOFIL公司,DNA回收试剂盒购自上海生工生物公司,DAB显色试剂盒购自康为世纪,其余所用的化学试剂均为国产分析纯试剂。基因导入仪来自上海塔瑞莎健康科技有限公司。
1.2 方法
1.2.1 重组质粒pcDNA3-FKBP12的构建和大量提取 根据前期筛选得到的FKBP12全长序列,设计FKBP12(327 bp)的PCR引物(表1),并用此引物扩增得到FKBP12全长序列。用BamHⅠ和XhoⅠ双酶切PCR产物和pcDNA3质粒,酶切产物经切胶回收后,将目的片段与载体片段连接并转化DH5α,挑取单克隆进行酶切鉴定后,将鉴定正确的单克隆送至华大基因测序。测序结果经序列比对正确后大量提取pcDNA3-FKBP12质粒,并检测质粒浓度和纯度。

表1 扩增FKBP12的引物
1.2.2 小鼠抗FKBP12抗体的制备 取5只昆明小白鼠,用苦味酸对老鼠进行染色标记,依次把在右前腿部、右后腿部、头部、背部、尾部染色的小鼠记为1-5号小鼠,用TERASA基因导入仪制备FKBP12抗血清。在免疫前取小鼠血清作为阴性血清对照,并用生理盐水稀释重组质粒pcDNA3-FKBP12,使质粒的终浓度达到1 μg/μL,免疫部位为小鼠右后腿肌肉组织,先注射20 μL,浓度为1 μg/μL的pcDNA3-FKBP12质粒,而后在同一注射部位给予一定的电流刺激(电压设置60 V,脉冲频率1 Hz,脉冲次数6次),帮助质粒进入小鼠肌肉组织内部。每隔7 d免疫1次,共免疫4次,每次免疫后对小鼠进行眼眶采血法收集血清。
1.2.3 ELISA检测小鼠抗FKBP12抗体效价 用浓度为10 μg/mL融合蛋白His-FKBP12于4℃过夜包被ELISA板,次日用PBST缓冲液洗涤3次,5%的脱脂奶粉37℃封闭2 h。再用PBST缓冲液洗涤3次后加入不同稀释浓度的小鼠血清,37℃孵育1 h。洗涤后以1∶2 000的稀释比例加入辣根过氧化物酶标记的山羊抗鼠IgG,37℃孵育1 h。PBST洗3次后加TMB底物显色,避光显色15 min后,加入2 mol/L的硫酸终止反应,用酶标仪检测A450/A655。未免疫前的血清为对照,其A450/A655值为N;免疫后
的A450/A655值为P,以P/N>2.1判断为阳性。
1.2.4 Western blot检测FKBP12抗体与抗原特异性结合 Western blot检测参照Bio-Rad公司的实验指导手册,将未经IPTG诱导的转入pET32a-FKBP12重组质粒的BL21菌的总蛋白、经镍柱纯化的His-FKBP12融合蛋白进行15%的SDS-PAGE电泳,之后采用Mini-PROTEAN 3 Trans-Blot系统(伯乐)转移至醋酸纤维素膜上,经过小鼠抗FKBP12血清和辣根过氧化物酶标记的山羊抗鼠IgG孵育后加DAB显色5 min,显色结果用扫描仪进行扫描。
1.2.5 免疫组织化学染色法检测FKBP12在棉铃虫体内的表达特征 ①固定:将3龄幼虫在40 g/L多聚甲醛固定液中固定12 h后制作石蜡切片,切片厚度为4-6 μm。②捞片:石蜡切片捞至经多聚赖氨酸(Sigma Diagnostics)预处理的载玻片上,常规脱蜡至水;③抗原热修复:将PBS缓冲液(0.01 mol/L,pH7.4)置于微波炉,中高火加热至沸腾后,再将组织切片浸入其中并调至低火使保持沸腾状态加热20 min;④0.3 g/L的过氧化氢溶液作用30 min以封闭内源性过氧化物酶;⑤封闭:PBS洗后(5 min×3次),0.5 g/L正常山羊血清封闭切片30 min(减少非特异性结合);⑥孵育一抗(鼠抗FKBP12多克隆抗体,1∶1 00),4℃过夜,PBS清洗(5 min×3次);⑦孵育二抗(辣根过氧化物酶标记标记的山羊抗鼠,1∶1 000),室温孵育2 h,PBS清洗(5 min×3次);⑧DAB显色30 s-5 min(但每张切片显色时间保持一致);⑨脱水,中性树胶封片。置于光镜下观察并拍照。阴性对照用免前阴性血清替代一抗,其它步骤同上。
2 结果
2.1 重组质粒pcDNA3-FKBP12的构建
用BamH I和Xho I双酶切原始FKBP12(327 bp)的PCR产物和pcDNA3质粒,得到的酶切片段进行连接并转化DH5α。挑取单克隆进行酶切鉴定的结果(图1)显示,挑取1-5号单克隆进行菌液PCR均为阳性克隆,从中选取3号提取质粒并双酶切鉴定,酶切出约330 bp的目的条带(图2),表明FKBP12已连接至pcDNA3载体上,重组质粒pcDNA3-FKBP12可用于后续试验。
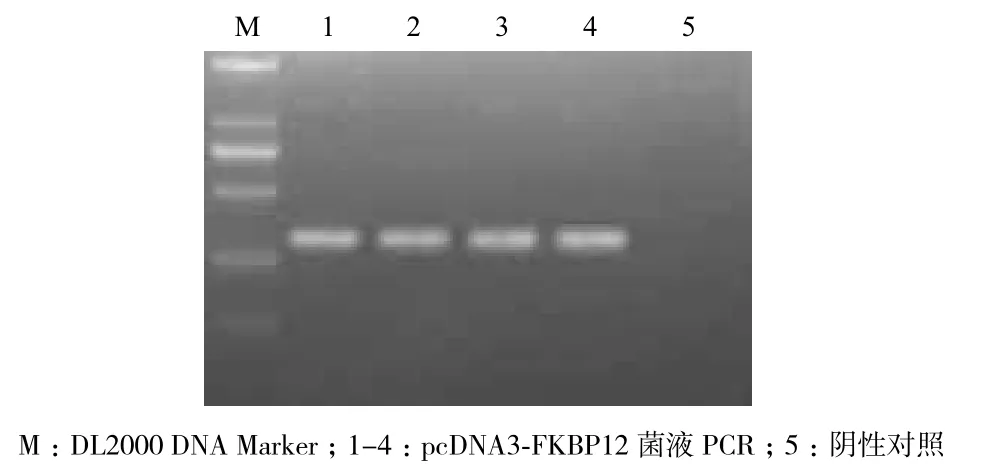
图1 重组质粒pcDNA3-FKBP12的菌液PCR鉴定

图2 重组质粒pcDNA3-FKBP12双酶切鉴定
2.2 重组质粒pcDNA3-FKBP12的序列比对和大量提取
将酶切鉴定正确的DH5α-pcDNA3-FKBP12的3号菌株送至华大基因测序,测序结果与原始FKBP12序列进行比对,在核酸水平上有4个碱基突变(图3-A),氨基酸序列完全一致(图3-B),重组质粒pcDNA3-FKBP12产生的FKBP12抗体不会改变FKBP12的抗原表位,因此可以大量提取重组质粒pcDNA3-FKBP12,用于免疫小鼠。
2.3 ELISA检测小鼠抗FKBP12抗体的效价
在质粒pcDNA3-FKBP12单独免疫4次后,用ELISA测定5只不同小鼠的血清效价(图4)。5只小鼠抗血清ELISA检测的A450/655值与阴性对照相比均大于2.1,1-5号小鼠分别为4.0、3.2、3.6、3.4和3.66,由图4可知,4次基因免疫后5只小鼠的血清效价均达到1∶25 600,说明5只小鼠的抗体滴度均达到预期目标,可满足后续试验需求。
2.4 免疫组织化学染色法检测多克隆抗体的特异性结合
用阴性血清和第4次免疫后的抗血清进行融合蛋白His-FKBP12的Western blot检测,结果(图5)
显示,在抗血清和二抗稀释的比例为1∶2 000和1∶10 000时,小鼠抗FKBP12血清与His-FKBP12融合蛋白在33 kD处杂交显示出条带,而阴性血清与His-FKBP12融合蛋白杂交在33 kD处没有条带,说明4免后的FKBP12抗血清能够与His-FKBP12融合蛋白特异性结合。综上,用基因导入仪免疫小鼠制备的棉铃虫FKBP506抗血清能够与His-FKBP12融合蛋白特异性的结合。在此基础上,用免疫组织化学染色法检测棉铃虫体内天然FKBP12表达情况,结果(图6)显示小鼠抗FKBP12血清能与棉铃虫3龄幼虫不同组织的FKBP12特异结合,而阴性血清却无此特性,说明核酸免疫制备小鼠抗棉铃虫FKBP12血清能与天然FKBP12特异结合,为深入探究FKBP12在棉铃虫体内的表达奠定基础。

图3 重组质粒pcDNA3-FKBP12的测序比对结果
3 讨论
已有大量研究结果表明,FK506是一类免疫抑制剂,参与免疫抑制,而抑制IL-2的产生是FK506免疫抑制的主要机制。FKBP12是免疫抑制剂FK506的胞内受体蛋白,能参与多种生理作用,如对T细胞激活的抑制作用,参与细胞周期的调控[1]。FK506-FKBP实现免疫抑制作用,主要是通过在钙调神经磷酸化酶(CaN)诱导下,使得活化的T细胞核因子(NF-AT)的去磷酸化,从而阻碍NF-AT向核内迁移,阻断白介素-2的分泌实现免疫抑制作用[7]。FK506结合蛋白与信号转导密切相关,参与细胞周期、细胞生长发育、细胞存活和凋亡以及基因转录等多种细胞生命活动。FK506可通过与FKBP的结合,抑制mTOR信号通路的传导,从而影响
细胞蛋白质合成、细胞运动及代谢、细胞凋亡等过程[8]。棉铃虫要经过4次完全变态发育(历卵、幼虫、蛹和成虫),这些完全变态发育过程受到大量细胞信号转导事件的精确调控,而这些细胞信号转导事件目前还没有研究清楚。2010年,朱佳等[4]经研究发现在棉铃虫滞育蛹中FKBP12在mRNA和蛋白水平都有较高表达,FKBP12参与了棉铃虫滞育过程。而在棉铃虫滞育过程中TOR基因表达量较低,推测FKBP12抑制TOR基因的表达,进而维持滞育,这说明FKBP12能够响应外界不良环境,参与调控棉铃虫的生长发育,因此推测FKBP12可能参与CYP6B6的解毒代谢通路,或者参与棉铃虫应对外界不利环境的调控。

图4 ELISA检测质粒pcDNA3-FKBP12免疫小鼠4次后的血清效价
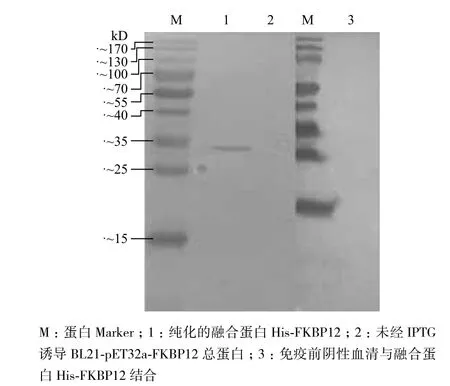
图5 多克隆抗体与融合蛋白His-FKBP12的特异性结合的检测

图6 多克隆抗体与棉铃虫体内天然FKBP12特异性结合的检测
本实验小组构建重组质粒pcDNA3-FKBP12,经测序比对,发现测序结果在4处出现碱基突变,但翻译成氨基酸的序列并没有发生改变,因此重组质粒pcDNA3-FKBP12构建成功,用此重组质粒对5只昆明小鼠进行质粒电注射基因免疫,每隔一周免疫一次,获得了棉铃虫FKBP12的鼠抗血清,用前期纯化的His-FKBP12融合蛋白作为抗原,经ELISA试验验证免疫4次后抗体效价,效价达到1∶25 600,但5只小鼠产生的抗体还是存在着个体差异,其中3号小鼠抗体效价最高,这可能与小鼠体重生长状态有关,经观察3号小鼠个头较小,在免疫期间体重变化较小,四免时体重变化较大的2号小鼠,其产生的抗体效价相对较低,这可能是影响抗体效价的一个重要原因,因此为避免这类情况,在免疫小鼠制备抗体时可选择相对稳定的BALB/c小鼠。Western blot检测结果表明,此血清能灵敏且特异性地与纯化的融合蛋白His-FKBP12结合,经免疫组织化学染色法检测棉铃虫体内FKBP12的表达情况,结果表明制备的抗FKBP12抗血清能与天然的FKBP12特异结合,说明FKBP12在3龄幼虫不同组织中均有表达。综上,制备的鼠抗FKBP12多克隆抗体可用来检测FKBP12在棉铃虫体内的时空表达规律及其应对外界不利因素影响下的表达情况,为诠释棉铃虫细胞色素P450 CYP6B6的诱导表达与植物次生物质之间关系奠定基础。
4 结论
用核酸免疫制备了小鼠抗棉铃虫FKBP12的多
克隆抗体,用ELISA检测抗体效价高达1∶25 600,用Western blot 和免疫组织学染色法验证了该多克隆抗体能与棉铃虫天然蛋白能特异性结合。
[1]Galat A. Peptidylprolyl cis/trans isomerases(immunophilins):biological diversity-targets-functions[J]. Current Topics in Medicinal Chemistry, 2003, 3(12):1315-1347.
[2]Walensky LD, Gascard P, Field ME, et al. The 13-kD FK506 binding protein, FKBP13, interacts with a novel homologue of the erythrocyte membrane cytoskeletal protein 4.1[J]. The Journal of Cell Biology, 1998, 141(1):143-153.
[3]Davies TH, Sánchez ER. Fkbp52[J]. The International Journal of Biochemistry & Cell Biology, 2005, 37(1):42-47.
[4]朱佳, 杨靖, 徐卫华.棉铃虫滞育解除的相关基因鉴定[J].中国科学技术大学学报, 2010, 40(1):48-52.
[5]Zhang H, Tang T, Cheng Y, et al. Cloning and expression of cytochrome P450 CYP6B7 in fenvalerate-resistant and susceptible Helicoverpa armigera(Hübner)from China[J]. Journal of Applied Entomology, 2010, 134(9-10):754-761.
[6]McDonnell CM, Brown RP, Berenbaum MR, et al. Conserved regulatory elements in the promoters of two allelochemical-inducible cytochrome P450 genes differentially regulate transcription[J]. Insect Biochemistry and Molecular Biology, 2004, 34(10):1129-1139.
[7]刘小宁, 李芬, 赵文博, 等.棉铃虫(Helicoverpa armigera)FK506结合蛋白基因的克隆、表达与纯化[J].生物技术通报, 2014(4):115-120.
[8]Ke H. Structure and funetion of cyclophilins[J]. Ziran, 2000, 22(3):134-141
[9]陈洪菊, 屈艺, 母得志. mTOR信号通路的生物学功能[J].生命的化学, 2010, 30(4):555-561.
(责任编辑 马鑫)
Preparation of the Polyclonal Antibody Against Helicoverpa armigera FK506 Binding Protein by Immunizing with pcDNA3-FK506BP
Zhu Yan Zhang Fuchun Ma Ji Huang Li’na Liu Xiaoning
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046)
It was to prepare the polyclonal antibody against FK506 binding protein, which was to be to verified the specificity of the antibody by Western blot. Firstly, recombinant expression plasmid pcDNA3-FKBP12 was constructed and sequenced, and the recombinant plasmid pcDNA3-FKBP12 was then transfered into Kunming mice four times. Finally, ELISA assay, Western blot analysis and immunohistochemistry(IHC)were used to determine the titer of polyclonal antibody of FK506 binding protein and its specificity, respectively. The results showed that the titer of polyclonal antibody reached 1∶25 600, and it was able to bind specifically to both the fusion protein His-FKBP12 and FKBP12 from the different tissues of the cotton bollworm in the 3rdlarvae, which laid the foundation for the subsequent experiments.
Helicoverpa armigera FK506 binding protein Polyclonal antibody
10.13560/j.cnki.biotech.bull.1985.2014.12.023
2014-03-31
国家自然科学基金项目(31260444),自治区自然基金项目(2012211A018),公益性行业(农业)科研专项经费项目(200903033)
朱燕,女,硕士研究生,研究方向:分子生物学;E-mail:1069806808@qq.com
刘小宁,女,博士,研究方向:农业昆虫与害虫防治;E-mail:liuxn0103@sina.com

