细胞外信号调节激酶1/2抑制剂U0126上调脑缺血再灌注小鼠海马微管结合蛋白2的表达
王海波,朱春莹,包义君,陈书达,郭宗泽,仇波
(1.浙江省人民医院神经外科,杭州310014;2.浙江省杭州市萧山区第一人民医院临床心理科,杭州311200;3.中国医科大学附属第一医院神经外科,沈阳110001)
细胞外信号调节激酶1/2抑制剂U0126上调脑缺血再灌注小鼠海马微管结合蛋白2的表达
王海波1,朱春莹2,包义君3,陈书达1,郭宗泽3,仇波3
(1.浙江省人民医院神经外科,杭州310014;2.浙江省杭州市萧山区第一人民医院临床心理科,杭州311200;3.中国医科大学附属第一医院神经外科,沈阳110001)
目的探讨细胞外信号调节激酶(ERK)1/2抑制剂U0126对脑缺血再灌注损伤小鼠海马微管结合蛋白2(MAP-2)表达的影响。方法健康昆明小鼠150只,随机分为假手术组、缺血再灌注组和U0126组,每组50只,各组再根据缺血后再灌注的时间点细分为6、12、24、48和72 h 5个亚组。利用免疫组织化学方法和Western blot方法检测MAP-2在各组小鼠海马的表达变化,同时应用TUNEL法检测各组小鼠海马细胞的凋亡情况。结果与假手术组相比,缺血再灌注组小鼠海马MAP-2的表达在6 h时已经明显降低,24 h达最低值,而在72 h略有回升(P<0.01);与相同时间点的缺血再灌注组小鼠相比,U0126组小鼠海马MAP-2的表达明显升高(P<0.01),而且海马细胞的凋亡情况明显好转(P<0.01)。结论U0126能够上调脑缺血再灌注损伤小鼠海马MAP-2的表达,减少脑缺血再灌注损伤海马神经细胞的凋亡。
脑缺血再灌注;细胞外信号调节激酶1/2;U0126;海马;细胞凋亡;小鼠
缺血性脑血管病约占脑血管疾病的70%以上,是威胁人类健康的一个重要因素。脑梗死后可发生一系列病理生理变化,进一步损害脑功能,导致相应的后遗症,因此脑梗死的临床和基础研究一直是神经科学的热点。作为近年来发现的一种磷蛋白质,微管相关蛋白2(microtubule associated protein 2,MAP-2)是结构性微管相关蛋白家族的一员,在微管蛋白组装、细胞骨架形成、细胞突起生成及胞质运输等方面均起重要作用[1~3]。有研究报道,在大鼠局灶性脑缺血动物模型中大脑组织MAP-2表达减少[4]。此外有研究发现将鼠大脑中动脉闭塞2 h后予以再灌注的不同时点,大部分缺血核心区可以观察到MAP-2免疫反应消失[5]。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是最初发现的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族亚类,是一种保守的丝/苏氨酸蛋白激酶,许多生长因子、细胞素、激素及介导有丝分裂、分化的信号均可激活ERK,使其发生磷酸化而活化。研究发现,局灶性脑缺血再灌注后磷酸化ERK表达增加,参与缺血后神经细胞凋亡和非程序性死亡过程,但是其具体作用机制尚不清楚[6]。本研究利用ERK抑制剂U0126阻断脑缺血再灌注后ERK的表达,观察脑缺血再灌注损伤小鼠海马MAP-2表达的变化,为阐明ERK信号通路在脑缺血再灌注损伤中的作用机制提供理论基础。
1 材料与方法
1.1 实验试剂与仪器
兔抗小鼠MAP-2多克隆抗体购自美国Santa Cruz公司,BCA蛋白浓度测定试剂盒购自美国Thermo Scientific公司,羊抗兔多克隆二抗、TUNEL试剂盒和SP免疫组化试剂盒均购自北京中山生物技术有限公司,其余为国产分析纯试剂。
1.2 动物模型
150只健康昆明小鼠(20~30 g),购自中国医科大学实验动物部,随机分为假手术组(n=50)、缺血再灌注组(n=50)和U0126抑制剂组(n=50)。用0.8%戊巴比妥钠腹腔注射麻醉小鼠,固定,备皮消毒,切开颈前皮肤,暴露两侧颈总动脉,缺血再灌注组和U0126抑制剂组采用夹闭双侧颈总动脉造成短暂前脑缺血12 min,U0126抑制剂组在缺血后从右侧颈总动脉由微量注射器注入U0126(0.2 mg/kg)。除去微动脉夹,缝合切口,消毒皮肤。术中保持室内温度25℃,保持肛温37℃。假手术组只暴露双侧颈总动脉12 min。然后每组根据再灌注的时间点细分为6、12、24、48、72 h 5个时间点亚组。
1.3 免疫组织化学方法
各组小鼠在不同时间点以0.8%戊巴比妥钠腹腔注射麻醉、开胸、经左心室灌注生理盐水洗净血液,以4℃的4%多聚甲醛固定后开颅取脑,并固定24 h。经20%~30%蔗糖及常规等级乙醇进行一系列脱水过程,制成蜡块,形成厚约6 μm的连续切片。切片脱蜡后以3%H2O2孵育15 min,经PBS清洗及抗原修复后,与MAP-2抗体(1∶100)于4℃冰箱孵育过夜;PBS清洗后加入二抗于37℃温箱共孵育20 min;然后经PBS清洗及DAB显色、脱水、透明、封片。结果采用图像分析系统测定小鼠海马区阳性反应物的平均光密度值。
1.4 Western blot方法
各组小鼠在不同时间点以0.8%戊巴比妥钠腹腔注射麻醉,冰上断头取脑,按体积比1∶5加入蛋白裂解液RIPA及1 μL的PMSF,提取总蛋白,按照BCA蛋白浓度测定试剂盒说明书进行总蛋白定量,形成标准曲线,并计算出样品的蛋白浓度。样品加入5×缓冲液、变性、电泳、转膜后,加入一抗后4℃下孵育过夜,然后室温下与二抗反应2 h,以Bio-Rad化学发光仪检测电泳结果,并用软件分析条带信号,蛋白相对表达水平以目的基因的条带信号强度与内参基因GAPDH的条带信号强度比值表示。
1.5 TUNEL染色
凋亡细胞检测采用TUNEL染色,按照原位凋亡试剂盒说明书进行,DAB显色。凋亡阳性细胞记数方法:每张切片于高倍镜下随机采集5个非重叠视野,计数凋亡细胞个数,取高倍视野平均阳性细胞数进行统计。
1.6 统计学分析
2 结果
2.1 免疫组化结果
免疫组化结果显示,与假手术组相比,缺血再灌注组小鼠海马MAP-2的表达在6 h时已经明显降低,48 h表达量最低,72 h略有回升(P<0.05);与相同时间点的缺血再灌注组小鼠比较,U0126组小鼠海马MAP-2的表达水平显著升高(P<0.05)。见图1、表1。
2.2 Western blot结果
Western blot结果显示,与假手术组比较,各时间点的缺血再灌注组小鼠海马MAP-2的表达明显降低(P<0.05);与相同时间点的缺血再灌注组小鼠比较,U0126组小鼠海马MAP-2的表达显著升高(P<0.05)。见图2、表2。
2.3 TUNEL结果
TUNEL阳性染色为细胞核棕黄色颗粒。TUNEL结果显示,随着再灌注时间的延长,凋亡细胞逐渐增多,至48 h达到峰值。与假手术组相比,缺血再灌注组凋亡细胞显著增加(P<0.05);与相同时间点的缺血再灌注组小鼠比较,U0126组小鼠海马凋亡细胞显著减少(P<0.05)。见图3、表3。

图1 免疫组化检测各组小鼠海马MAP⁃2的表达×200Fig.1 Immunohistochemical detection of the expression of MAP⁃2 in the hipppocampal region of mice×200

表1 各组小鼠海马MAP⁃2光密度值比较Tab.1 The optical density values of MAP⁃2 in the hippocampus of mice in different groups
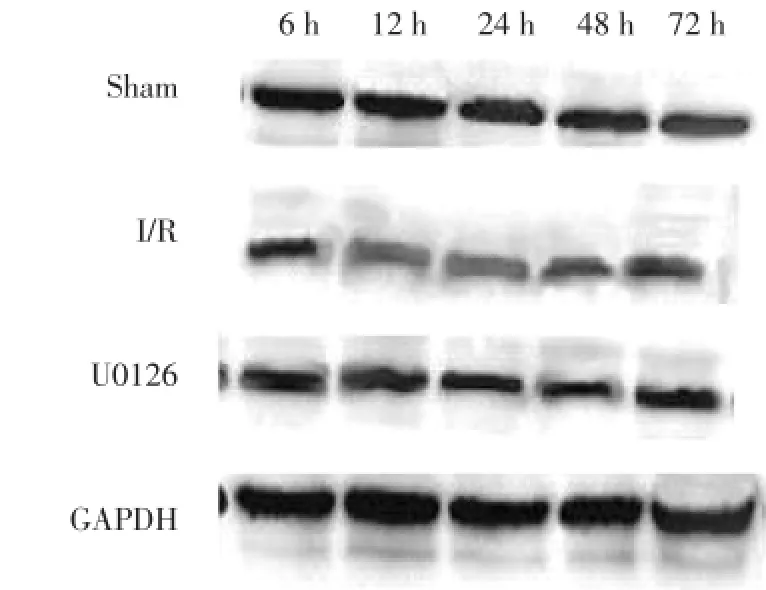
图2 Western blot检测各组小鼠海马MAP⁃2的表达Fig.2 Western blot detection of the expression of MAP⁃2 in the hipppocampal region of mice
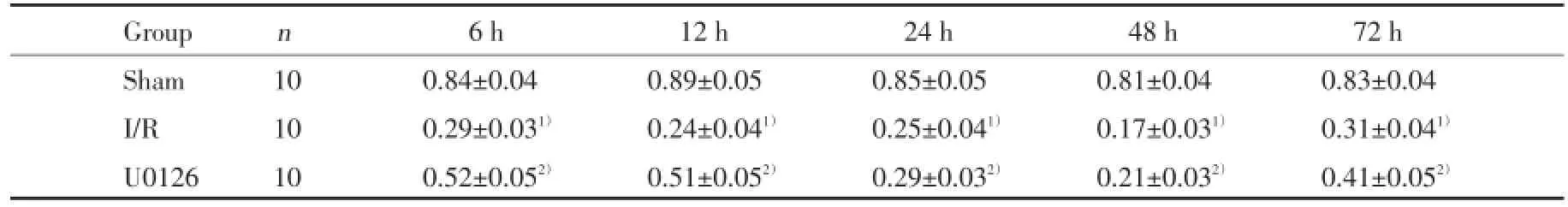
表2 各组小鼠海马MAP⁃2平均光密度值比较Tab.2 The optical density values of MAP⁃2 in the hippocampus of mice in different groups
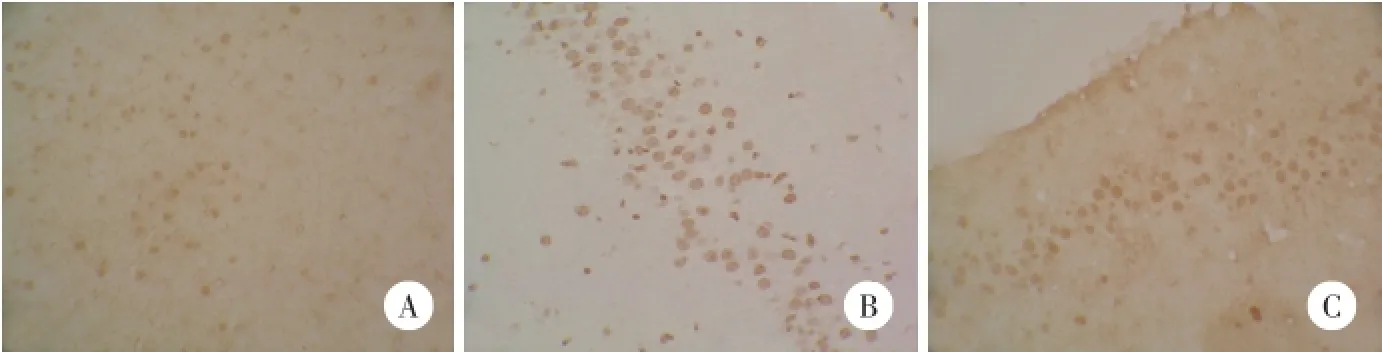
图3 TUNEL检测各组小鼠海马细胞凋亡×400Fig.3 TUNEL detection of the cell apoptosis in mice hippocampus×400
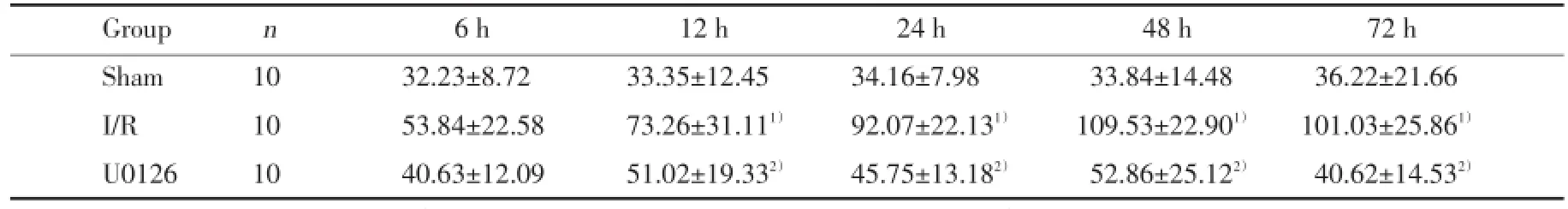
表3 各组小鼠海马细胞凋亡数比较Tab.3 The number of apoptosis cells in the hippocampus of mice in different groups as detected by TUNEL
3 讨论
缺血性脑血管病是一种发病率较高的疾病,而且预后较差,致死致残率高。由于其发病在脑缺血时,尤其是在快速、急剧的脑缺血时,脑的氧供和能量代谢被打乱,导致部分神经元内依赖能量的基因调控来不及表达就开始凋亡,因此在缺血周围区出现大量的凋亡细胞。如果不能及时给予有效的治疗,凋亡细胞则趋于死亡。因此,促进缺血再灌注损伤细胞的功能逆转,减少细胞坏死,是治疗缺血性脑血管疾病的一个重点[7]。
各种生长因子、离子射线、过氧化氢等可将ERK1和ERK2磷酸化而激活,它和细胞的增殖与分化密切相关[8,9]。ERK1和ERK2磷酸化被激活后,通过在细胞核内作用于多种转录因子,促进某些基因的转录与表达。研究发现,局灶性脑缺血再灌注后磷酸化ERK表达增加,参与缺血后神经细胞凋亡和非程序性死亡过程[1]。小鼠海马部位属于缺血敏感区,在本研究中缺血再灌注后细胞凋亡明显高于假手术组。通过TUNEL检测发现,脑缺血再灌注后,随着再灌注时间的延长,小鼠海马凋亡细胞数量迅速增多,表现为细胞核内棕黄色颗粒明显增加。在24~48 h期间内细胞凋亡速度显著增快,至48 h达到峰值。利用ERK抑制剂U0126阻断脑缺血再灌注小鼠ERK的表达后,发现缺血再灌注组小鼠海马凋亡细胞相比于同一时间点的U0126抑制剂组小鼠显著减少(P<0.05),说明U0126通过抑制ERK1/2信号通路从而阻断神经细胞凋亡和非程序性死亡,从而改善缺血再灌注后的海马细胞进一步损害。从以上结果可以推断,ERK被U0126抑制后,ERK启动的一系列凋亡信号通路被阻断,使细胞核内的转录调节因子无法活化,从而抑制细胞的分化、凋亡,进而影响了缺血后神经细胞凋亡和非程序性死亡过程,这与之前的研究结果一致[1]。但是ERK参与缺血后神经细胞凋亡和非程序性死亡的信号机制,尚需进一步深入研究。
MAP-2主要在神经元胞体、树突、树突棘表达,对于神经功能来讲,MAP-2与突触后膜骨架上一些信号蛋白和膜受体相连,是许多神经信号传导通路的底物,也是调节神经元突触可塑性以及细胞骨架动力学的必需因子,树突的分化离不开MAP-2的表达,神经元MAP-2的丢失涉及到神经元结构破坏和神经元死亡,进一步导致神经功能障碍[10]。有研究报道,在大鼠局灶性脑缺血动物模型中,大脑组织中的MAP-2表达显著降低[4],说明其低表达与脑缺血过程密切相关;这种相关性可能与脑缺血缺氧后引起酸中毒,使MAP-2抗原性减低有关,但是其具体作用机制尚不清楚。本研究中免疫组化显示缺血再灌注组MAP-2的表达在6 h时已经明显降低,至48 h时表达量最低,这一趋势与迟发性神经元死亡的时间进程相符。以上结果提示MAP-2的分解破坏或合成障碍,可能参与了脑缺血再灌注后的损伤机制。而同一时间点U0126组小鼠海马MAP-2的表达比缺血再灌注组显著升高,凋亡细胞数量也相应减少,印证了以上的推测。近几年,越来越多的人意识到MAP-2免疫活性的高低与脑损伤的关系,并且其可作为脑缺氧缺血后神经细胞受损及再生的评价指标[11]。在本研究中,缺血再灌注组小鼠海马MAP-2的免疫活性明显减低,而利用ERK抑制剂U0126阻断脑缺血再灌注小鼠ERK的表达后,相同时间点的U0126抑制剂组小鼠海马MAP-2的表达却显著升高,说明ERK的阻断能够上调MAP-2的表达,从而改善了小鼠海马在缺血再灌注后的进一步损伤,减轻了细胞凋亡程度。结合文献和本研究结果,下调MAP-2的表达很可能是ERK1/2信号通路参与缺血后神经细胞凋亡和非程序性死亡的信号机制之一。
综上所述,ERK信号通路及ERK级联反应可能通过下调MAP-2表达,从而参与了脑缺血再灌注损伤,导致了进一步的细胞凋亡;而ERK抑制剂U0126则可阻断这个病理过程,从而改善小鼠海马损伤。
以上结果对于进一步研究脑缺血再灌注后的病理生理过程以及相应的信号通路提供了新的思路,同时也在一定程度上为脑缺血再灌注损伤的临床治疗提供了理论依据,但相关信号通路的具体调控机制还需进一步的深入研究。
[1]Nunez J.Immature and mature variants of MAP-2 and tau proteins and neuronal plasticity[J].Trends Neurosei,2005,11(11):477-499.
[2]Kowalski RJ,Williams RC.Microtubule-associated protein 2 alters the dynamic properties of microtubule assembly and disassembly[J].Biol Chem,2003,268(13):9847-9855.
[3]刘正清,马志健,刘裕民.微管相关蛋白2与神经元可塑性调节[J].中国现代医学杂志,2003,13(9):51-54.
[4]An SJ,See MO,Kim HS,et a1.Accumulation of microtubule-associated proteins in the hippocampal neurons of seizure-sensitive gerbils[J].Mo1 Cells,2003,15(2):200-207.
[5]Buddle M,Eberhardt E,Climinello LH,et a1.Microtubule-associated protein 2(MAP2)associates with the NMDA receptor and is spatially redistributed within rat hippocampal neurons after oxygeng1ucose deprivation[J].Brain Res,2003,978(1-2):38-50.
[6]潘蓓,刘瑞珍,谢宝明.大鼠局灶性脑缺血再灌注后p-ERK表达及神经元凋亡的变化[J].山西医科大学学报,2009,40(5):433-437.
[7]许妍妍,刘丽莉,刘春春,等.缺血再灌注大鼠脑皮质bcl-2、bax和p53的动态表达[J].吉林大学学报(医学版),2012,38(4):697-702.
[8]Wu N,Lin X,Zhao X,et al.MiR-125b acts as an oncogene in glioblastoma cells and inhibits cell apoptosis through p53 and p38MAPK-independent pathways[J].Br J Cancer,2013,109(11):2853-2863.
[9]吴献伟,杨华圣,吴丽,等.细胞外信号调节激酶蛋白在全脑缺血再灌注损伤后的表达及与凋亡的关系[J].内蒙古中医药,2010,15(2):103-104.
[10]郑峰,吴家幂.微管相关蛋白2与缺血性脑损伤[J].神经疾病与精神卫生,2005,5(2):154-156.
[11]顾卫东,陈群,曾因明,等.脑缺血再灌注期间海马神经元微管相关蛋白-2免疫活性的变化[J].中国麻醉医学,2000,20(5):318.
(编辑 陈姜)
ERK1/2 Blocker U0126 Upregulates the Expression of Microtubule Associated Protein 2 in Hippocampusof CerebralIschemia Reperfusion Mice
WANGHai-bo1,ZHU Chun-ying2,BAOYi-jun3,CHENShu-Da1,GUO Zong-ze3,QIUBo3
(1.DepartmentofNeurosurgery,Zhejiang ProvincialPeople′s Hospital,Hangzhou 310014,China;2.ClinicalPsychology,Xiaoshan FirstPeople′s Hospital,Hangzhou 311200,China;3.DepartmentofNeurosurgery,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo investigate the effectofextracellularsignal-regulated kinase 1/2 blocker U0126 on the expression ofmicrotubule associated protein 2(MAP-2)in hippocampus ofcerebralischemia-reperfusion injury mice.MethodsAtotalof150 Kunming mice were randomly divided into sham group,cerebralischemia-reperfusion group,and U0126 group(n=50 each group),which were then subdivided into five subgroups according to the time point of reperfusion after ischemia(6,12,24,48 and 72 h).Immunohistochemistry method and Western blot method were employed to detectthe expression ofMAP-2 in hippocampus ofmice,and apoptosisofhippocampus cells in mice was detected by TUNELmethod.Re⁃sultsCompared with the control group,the expression of MAP-2 in hippocampus of mice in the ischemia-reperfusion group was significantly increased within 6 h,became barely detectable at 24 h,and rebounded slightly at 72 h(P<0.01).Compared with mice in the ischemia-reperfusion group,the expression of MAP-2 in hippocampus of mice in the U0126 group at the same time point was significantly increased(P<0.01),and the number of hippocampal cells apoptosis was decreased(P<0.01).ConclusionU0126 could upregulate the expression of MAP-2 in hippocampus ofcerebralischemia-reperfusion injury mice,and decrease apoptosisofhippocampalneuralcellsinduced by cerebralischemia-reperfusion injury.
cerebral ischemia-reperfusion;extracellular signal-regulated kinase 1/2;U0126;hippocampus;cell apoptosis;mouse
R743
A
0258-4646(2014)12-1092-05
教育部留学回国人员科研启动基金资助项目(教外司留[2013]1792号);辽宁省博士启动基金(20111095)
王海波(1982-),男,医师,硕士.
朱春莹,E-mail:172839554@qq.com
2014-09-23
网络出版时间:
——水芹主要害虫识别与为害症状

