生物人工血管的生物相容性研究
陈丹丹 彭新洁 李彦红 王召旭 中国食品药品检定研究院 (北京 100050)
生物人工血管是以猪的血管为原料,经过特殊生物处理技术制成,主要用于外科上血管病变的替代和旁路搭桥手术。生物人工血管的结构是内部光滑,不易凝血,且容许内皮细胞爬行覆盖;外表面呈纤维状,可供组织粘附爬行,植入部位不易受到感染。
理想的生物材料应具有良好的生物相容性,应对细胞、组织等无毒性、无刺激性、无致畸致突变性。本研究按照GB/T16886 医疗器械生物学评价的要求对生物人工血管进行了细胞毒性试验,急性毒性试验,皮内刺激和致敏试验,溶血试验,亚慢性毒性试验,植入试验,遗传毒性试验,从体内体外两方面评价生物人工血管的生物相容性[1~6]。
1.材料和方法
1.1 材料
生物人工血管,生产单位:广州宏畅生物科技有限公司。
1.2 试验方法
1.2.1 细胞毒性试验
取样品2.0g 加细胞培养液10mL,在37˚C 浸提24 小时,取浸提液作为供试液。制备L929 细胞(小鼠成纤维细胞)悬液:消化吹打计数,将细胞浓度调整为1×105·mL-1,吸100μL 细胞悬液注入培养板内,放入含5%的CO2恒温培养箱中培养24 小时。阳性对照:含20%DMSO的MEM 培养液。阴性对照:高密度聚乙烯。弃去原培养液,每孔分别加入100μL 的空白对照液、阴性对照液、阳性对照液、试验样品浸提液,每组设6 孔。24 小时后弃去孔内液体,每孔加入20μL MTT,在CO2恒温培养箱中培养4~6 小时后弃去孔内液体,每孔分别加入150μL DMSO,10 分钟后振荡,用双波长(570nm 和630nm)法测定吸光度[7]。
1.2.2 急性毒性试验
取样品2.0g 加氯化钠注射液10mL,在37˚C浸提72 小时,取浸提液作为供试液。体重为18-21g 的昆明种小鼠(共10 只,雄性)随机分为对照组(空白对照液)和实验组(供试液组)。将浸提液以50ml·kg-1的比例经尾静脉注射入实验组体内,将生理盐水以50ml·kg-1的比例经尾静脉注射入对照组体内。注射后观察小白鼠即时反应并于4、24、48 和72 小时观察和记录实验组和对照组动物的一般状态、毒性表现和死亡动物数[8]。
1.2.3 皮内刺激试验
取样品2.0g 加氯化钠注射液10ml,在37˚C恒温摇床浸提72 小时,取浸提液作为供试液。将体重为2.0kg~2.2kg 的3 只家兔于试验前(24 小时)背部去毛备用,在脊柱右侧选5 个点注射试验样品,每点间隔2cm,同法在左侧选5 个点注射氯化钠注射液(阴性对照),各点注射量为0.2ml。分别在24 小时、48 小时和72 小时内观察接触部位的反应情况,按照GB/T16886.10-2005 中的方法判定其结果并记分。
1.2.4 皮肤致敏试验
取样品4.0g 加氯化钠注射液20ml,在37˚C恒温摇床浸提72 小时,取浸提液作为供试液。按照GB/T16886.10-2005 中的方法进行皮内诱导、局部诱导及激发试验,判定其结果。
1.2.5 溶血试验
取样品1cm×5cm 大小,加入生理盐水8ml,制备3 份。阴性对照组:生理盐水10ml,3 管。阳性对照组:蒸馏水10ml,3 管。将各组分别置于37˚C 水浴60 分钟。将水浴后的各样品管分别加入0.16ml 抗凝兔血,对照管加入0.2 ml 抗凝兔血,再次在37˚C 水浴60 分钟。将水浴后的各管以800g 离心5 分钟后,吸取上清液。在545nm波长处读取各管上清液的吸光度值。
1.2.6 亚慢性毒性试验
体重为230~250 克的SD 品系雄性大鼠30只按体重随机分为3 组,每组10 只,分别对高剂量组大鼠尾静脉注射浸提比例为0.4g·ml-1注射剂量为10ml·kg-1的生理盐水浸提液, 对低剂量组大鼠尾静脉注射浸提比例为0.2g·ml-1注射剂量为10ml·kg-1的生理盐水浸提液,对照组给予10ml·kg-1生理盐水。
给供试品期间密切观察各组动物的外观体征、粪便性状,每日称体重一次。
连续给药14 天后(解剖前夜禁食),10%水合氯醛,0.3ml·100g-1对大鼠腹腔注射麻醉后,下腔静脉取血,分别测定血液指标:血红蛋白浓度(HGB)、红细胞数(RBC)、红细胞压积(HCT)、血小板数(PLT)、白细胞数(WBC)、白细胞分类计数(DC)、凝血酶原时间(PT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)和平均红细胞血红蛋白浓度(MCHC)等血液学指标;血液经离心分离血清,测定天门冬氨酸氨基转换酶(AST)、丙氨酸氨基转换酶(ALT)、碱性磷酸酶(ALP)、尿素(UREA)、总蛋白(TP)、白蛋白(ALB)、血糖(GLU)、总胆红素(T-BIL)、肌酐(CRE)、总胆固醇(T-CHO)、钙、氯、磷等血清生化学指标。
并于次日处死,系统尸解,称取心、肝、脾、肾、肾上腺、脑、胸腺、睾丸、附睾的重量并计算脏器系数。肉眼观察后,将上述组织全部放入中性10%甲醛溶液中固定,石蜡切片、HE 染色、显微镜下观察各脏器的病理组织学变化[9]。
1.2.7 植入试验
以B 型硬脑(脊)膜补片为对照,将样品和对照剪成10mm×10mm,选用12 只家兔。体重 2000~2500g。腹腔注射30mg·kg-1戊巴比妥钠麻醉后, 背部术野剃毛,碘酒,酒精常规消毒。左,右侧脊柱两侧皮下各植入3 个植入物。左侧为对照, 右侧为样品。于植入后1 周,4 周,12 周取材进行病理制片,显微镜观察。
1.2.8 鼠伤寒沙门氏菌回复突变试验
取样品1.8g,加氯化钠注射液9ml,在37˚C 恒温摇床浸提72 小时,制备浸提液。试验采用鼠伤寒沙门氏菌组氨酸缺陷型突变株(TA97,TA98,TA100 和TA102)。阴性对照为同批号浸提介质生理盐水(NS);阳性对照为敌克松(500μg·ml-1),2-氨基芴(2mg·ml-1),1,8-二羟基蒽醌(500μg·ml-1)。代谢活化系统:选用健康雄性成年Wistar 大白鼠,采用合并诱导方法制备S9。试验采用平板掺入法,试验设阴性对照、阳性对照、浸提液组、1/2 浸提液组、1/4 浸提液组。非活化试验:加入0.2mol·L-1磷酸缓冲液0.5mL 及受试液、新鲜菌液各0.1mL。活化试验:加入5%S9mix0.5mL 及受试液、新鲜菌液各0.1mL,置37˚C 培养72h 后统计回变菌落数,同时做S9mix检菌。
1.2.9 体外哺乳动物细胞染色体畸变试验
取样品4.7g 加入含血清的1640 培养液23.5mL,在37˚C 恒温摇床浸提24 小时,制备浸提液。试验设阴性对照、阳性对照、浸提液组、1/2 浸提液组、1/4 浸提液组。细胞株采用中华仓鼠肺成纤维细胞(CHL);阴性对照为同批浸提介质,阳性对照为0·25μg·ml-1丝裂霉素(-S9mix)和20μg/mL 环磷酰胺(+S9mix);代谢活化用多氯联苯诱导哺乳动物肝微粒体酶(S9)进行代谢活化。试验方法采用正常培养的CHL 细胞经消化液作用后,制成5×104个·mL-1细胞悬液,每个细胞培养皿接种3.0mL,培养24h 后吸去培养液,加入测试样品浸提液。活化组S9mix作用6h 后换液,培养24h 收获细胞,非活化组分别于作用24h 和48h 后收获细胞,制备染色体,Giemsa 染色,显微镜下观察100 个中期分裂相。
1.2.10 哺乳动物细胞体外基因突变试验
取样品3.5g 加入含血清的1640 培养液17.5mL,在37˚C 恒温摇床浸提24 小时,制备浸提液。试验设阴性对照、阳性对照、浸提液组、1/2 浸提液组、1/4 浸提液组。阴性对照为无血清培养液;阳性对照非活化系统为1.0mg·ml-1甲基磺酸乙酯溶液(EMS), 活化系统为250μg·ml-17,12-二甲基苯蒽(DMBA)。
取纯化V79 细胞,每个50mL 大小的培养瓶接种5.0×105个细胞,培养20 小时后,非活化系统分别加入5.0mL 材料浸提液及对照液;活化系统分别加入4.5mL 材料浸提液及对照液后,再加入0.5mL S9 混合液,置于CO2培养箱中培养4h。弃去含受试物的培养液,D-Hankʼs 洗涤后,换完全培养液培养20h。上述细胞经消化液消化、计数,将细胞接种于6 孔板中,每孔接种2.0×102个细胞,培养7 天后用甲醇固定,姬姆萨染色,计数形成的集落。另外在50ml 的培养瓶中接种5.0×105个细胞进行表达。中间低密度传代一次。表达结束后,消化计数,6 孔板的每孔中接种2.0×102个细胞,7 天后测定细胞克隆形成率。同时在6 孔板的孔中接种1.5×105个细胞,2 小时后加入含6-TG 选择培养液培养,作HGPRT 基因突变集落选择,选择期为10 天,计算基因位点突变频率。
2.结果
2.1 细胞毒性试验:样品试验液的细胞毒性分级按GB/T16886·5 中规定的分级原则为0 级,阴性对照为1 级,阳性对照为4 级。生物人工血管细胞毒性反应为0 级,符合临床使用要求。
2.2 急性毒性试验:按国家标准GB/T16886·11中规定的标准方法进行,结果小鼠活动正常,未见任何异物反应。在观察期间动物体重增加和阴性对照相比无任何差异,说明生物人工血管无全身急性毒性反应。
2.3 皮内刺激试验:家兔脊柱两侧在注射后24h、48h 和72h 观察注射点,试验组和阴性对照均为0级,说明生物人工血管无皮内刺激作用。
2.4 致敏试验:按GB/T16886·11 中规定的最大剂量法进行试验,结果阴性对照组和材料试验组相比无明显差异,均未观察到致敏作用。
2.5 溶血试验:计算溶血率=(OD 样品–OD 阴性对照)/(OD 阳性对照–OD 阴性对照)=(0.025–0.014)/(0.881–0.014)= 1.2%,符合溶血率不大于5%的标准规定。
2.6 亚慢性毒性试验:生物人工血管生理盐水浸提液(0.4g·ml-1),SD 雄性大鼠尾静脉注射(10ml·kg-1),连续给予14 天,结果样品各剂量组体重增长正常,未发现临床征象等一般毒理学指标方面异常,大体和组织病理学检查,未见各脏器明显中毒性病理改变。血液学、生物化学相关指标显示,样品高剂量组HCT、RBC、HGB、PLT、GLU、UREA、C1 升高,WBC、CRE 降低;低剂量组RBC、HCT、HGB、PLT、GLU、UREA、C1,升高,ALT 降低。凝血酶原时间高低剂量组均高于阴性对照组,其余未见与阴性对照组有统计学差异。
2.7 植入实验:样品植入后肉眼观察所见:各时间点皮肤切口愈合良好,未见局部红肿及感染。显微镜下所见:对照1 周(图1):疏松结缔组织中,可见一条带,由红染的纤维束样材料组成,呈纵行排列,之间有缝隙,四周可见菲薄的胶原纤维,成纤维细胞,和纤维细胞包绕而成的囊壁。偶见淋巴细胞,另偶见小血管和神经切面(炎I, 纤I-II) 。样品1 周(图2):疏松的脂肪结缔组织中可见一红染束状植入物,呈纵向排列的细胞网状,部分致密,部分疏松,边缘处和四周可见淋巴细胞,吞噬细胞和坏死的细胞碎片,外周可见由成纤维细胞,纤维细胞和胶原纤维构成的囊壁,偶见粒细胞(炎II-III, 纤I-II)。对照4 周(图3):疏松的脂肪结缔组织中,可见一条带植入物,由红染的纤维囊组成,纵行疏松排列,四周可见由成纤维细胞,纤维细胞和菲薄的胶原纤维构成的囊壁。四周偶见淋巴细胞散在分布,囊内材料与囊壁间偶见空隙(炎I, 纤I)。样品4 周(图4):疏松脂肪结缔组织中可见一红染束状植入物,部分致密,部分疏松,四周可见由成纤维细胞,胶原纤维构成的囊壁,囊壁与周围疏松结缔组织中偶见少许淋巴细胞浸润(炎I, 纤I)。对照12 周(图5):疏松结缔组织中,可见一条带状植入物,呈红染束状,纵行疏松排列,四周可见由胶原纤维和纤维细胞构成的菲薄的囊壁,偶见淋巴细胞在囊周分布(炎I, 纤I)。样品12 周(图6):疏松脂肪结缔组织中可见一红染植入物,呈纵向束带状,部分致密,部分疏松,有些切片可见蓝色钙盐在材料局部沉积,有囊壁形成,由胶原纤维和纤维细胞及脂肪结缔组织形成,部分切片可见较多的淋巴细胞灶状浸润,四周仍可见小血管和神经切面。(炎症I,纤维I)。
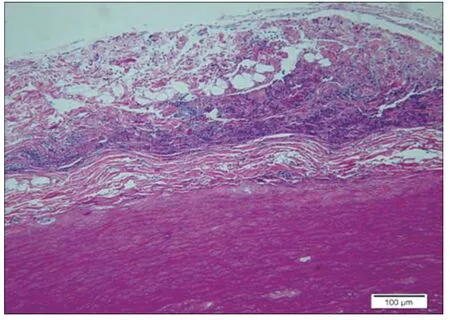
图2. 样品植入后1 周
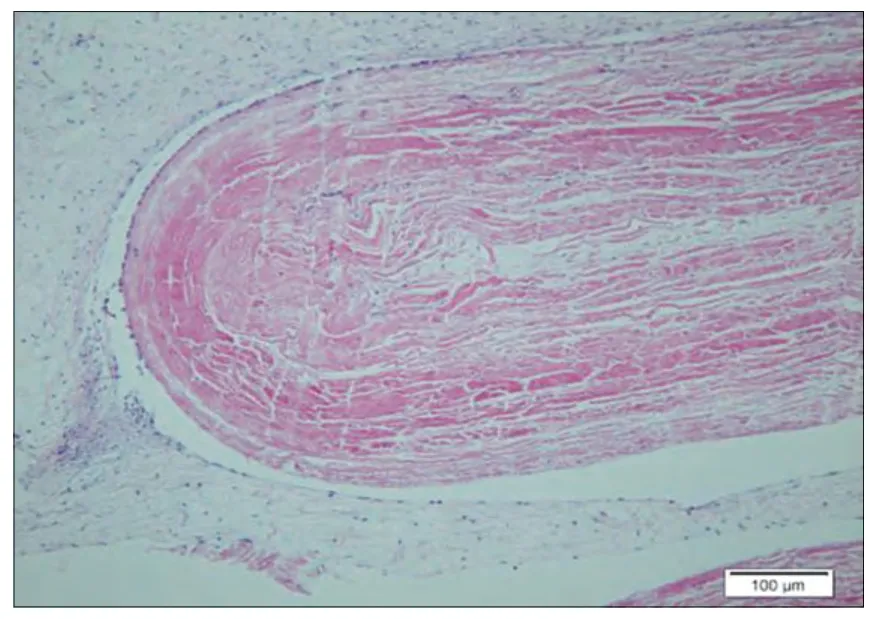
图3. 对照植入后4 周
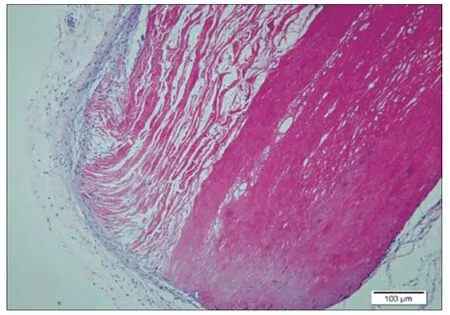
图4. 样品植入后4 周
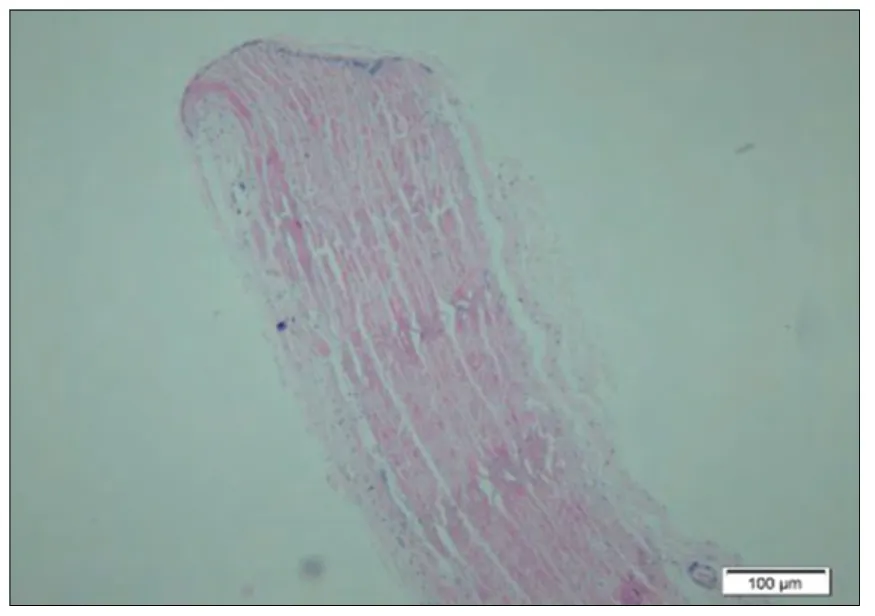
图5. 对照植入后12 周
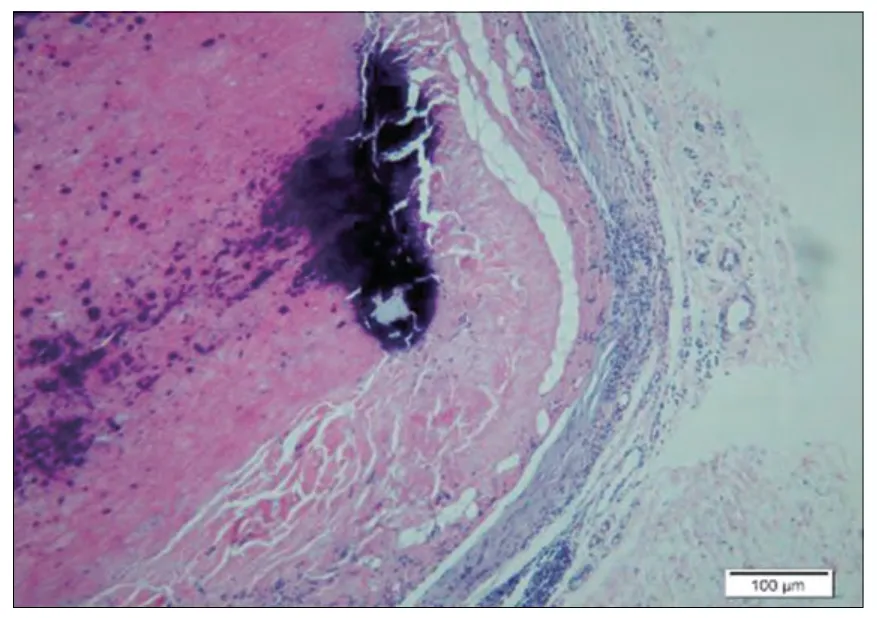
图6. 样品植入后12 周
对照26 周(图7):疏松的结缔组织中可见一条状植入物,为红染的纵行束状,排列疏松,四周可见菲薄的纤维胶原构成的囊壁,偶见条带两端处囊周有少许淋巴细胞浸润(炎症I,纤维I)。样品26 周(图8):疏松脂肪结缔组织中,可见一束状红染植入物,呈纵向分布,部分颜色变浅,中间未见炎细胞,部分边缘区域变疏松,四周可见胶原纤维和纤维细胞包绕形成较厚囊壁,但较疏松,局部区域有淋巴细胞浸润,四周结缔组织中可见小血管和神经切面(炎症I,纤维I)。结论:样品植入后1 周,4 周,12 周,26 周样品的炎症反应和纤维囊形成与对照无明显差别。
2.8 遗传毒性试验:单纯采用一种试验方法不能有效评价材料的基因毒性,因此本研究选择了Ames试验、体外哺乳动物细胞染色体畸变试验、哺乳动物细胞体外基因突变试验综合评价。结果发现在活化和非活化条件下,生物人工血管的浸提液、1/2 浸提液、1/4 浸提液对试验所用4 种菌株的回变菌落数与阴性对照组比较,均未增加2 倍。表明在此实验条件下,样品的生理盐水浸提液对鼠伤寒沙门氏菌无诱变性。在活化和非活化条件下,生物人工血管的浸提液、1/2 浸提液、1/4 浸提液与中国仓鼠肺成纤维细胞(CHL)接触后,三个剂量浸提液染色体畸变率为0%,与空白对照组无显著差别,说明生物人工血管无诱导细胞染色体畸变作用。在哺乳动物细胞体外基因突变试验中,试验样品突变频率未达到或超过阴性对照突变频率的3 倍,未见试验样品突变频率的增高与剂量相关,未见某一剂量突变频率的增加有统计学意义。说明在活化和非活化条件下,生物人工血管的各剂量组浸提液对体外培养的V79 细胞无诱导HGPRT 基因突变作用。总之未观察到生物人工血管的遗传毒性作用。
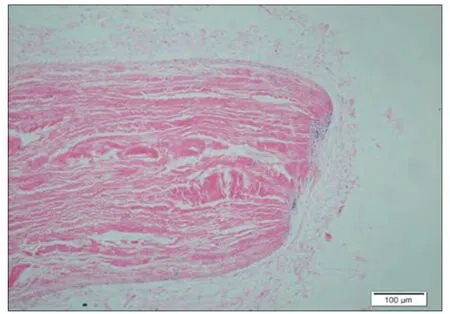
图7. 对照植入后26 周
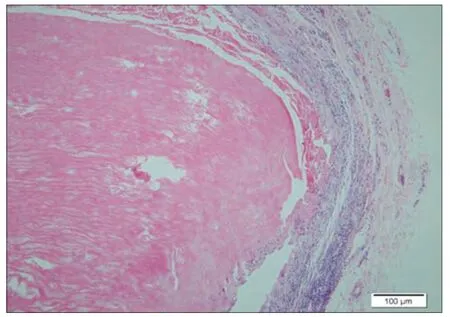
图8. 样品植入后26 周
3.结论
生物人工血管是一种新型的生物材料,通过按国家标准GB/T16886 医疗器械生物学评价系列标准(等同国际标准ISO10993)进行了全面的生物学评价,证明生物人工血管具有良好的生物相容性,是十分理想的血管替代物,在组织工程方面具有广阔的发展空间和应用前景。
[1] GB/T 16886.1 医疗器械生物学评价 第1 部分:风险管理过程中的评价与试验
[2] GB/T 16886.3 医疗器械生物学评价 第3 部分:遗传毒性、致癌性和生殖毒性试验
[3] GB/T 16886.5 医疗器械生物学评价 第5 部分:体外细胞毒性试验
[4] GB/T 16886.6 医疗器械生物学评价 第6 部分:植入后局部反应试验
[5] GB/T 16886.10 医疗器械生物学评价 第10 部分:刺激与迟发型超敏反应试验
[6] GB/T 16886.11 医疗器械生物学评价 第11 部分:全身毒性试验
[7] 郑琪 ,奚廷斐,陈艳梅等。细菌纤维素的生物相容性研究。药物分析杂志, 2010, 30 (7): 1389-1392
[8] 王春仁,姜华,曹宏英等。止血防粘连生物纸的生物相容性研究。中国生物医学工程学 报,2007,26,(2):293~295
[9] 王春仁, 王召旭, 宋谊萍等。止血纤维素材料亚慢性毒性实验研究。中国药事,2007 ,21 (9):695-698

