3D 打印在医疗器械领域的应用现状 及展望
王安琪 冯晓明 杨昭鹏 王春仁 中国食品药品检定研究院医疗器械检定所 (北京市 100050)
0.前言
3D 打印技术是增材制造(Additive Manufacturing, AM)的一种。AM 技术又称快速成型(RP,Rapid Prototyping),是“一种通过三维数据,通常由逐层的方式结合材料以制造构件的技术[1]”。目前较为成熟的分支有EBM (Electron Beam Melting), DMLS 直接金属激光烧结 (Direct Metal Laser Sintering),SLS 选择性激光烧结(Selected Laser Sinterting),LENS(激光熔敷技术), 3DP(3D 打印,3D printing), FDM 熔融层积成型技术(Fused Deposition Modeling), SLA 立体平版印刷技术 (Stereolithography Appearance), DLP 激光成型技术, UV 紫外线成型技术, LOM 分层实体制造技术(Laminated Object Manufacturing)等,可以直接或间接进行蜡、高分子、陶瓷、金属以及复合材料甚至活体细胞的加工。与传统加工技术相比,它完全突破了设计和传统加工技术的局限,不需模具,一次成型。材料利用率高,设计–交付周期短,可加工材料多,在航空航天,军事国防,能源油气,医疗生物,汽车,高端珠宝等的研发和生产领域正大放异彩。该文将着重关注其在医疗器械领域科研及应用的现状和发展趋势。
1.科研现状和发展趋势
相比于传统工艺,增材制造技术对产品尺寸精密度控制较差,价格昂贵,不适合简单结构的大批量生产。但其制造方式的变革带来了更大的设计以及制造自由度,因而在复杂结构以及个性化结构的加工中,无论在成本还是交付时间上,都体现出传统技术无可比拟的优势[2]。该技术在医疗器械制造领域的优势和发展方向体现在:
(1)复杂结构以及难加工材料医疗器械的制造,包括表面互通多孔结构以增强生物相容性,个性化定制多孔结构以减重或在特定区域设计特定理化性能。
(2)个性化定制假体的加工。根据病人个体特征,通过由CT 等临床诊断技术获取三维电脑数据,可在骨科、整形外科等得到临床应用。
(3)为人工器官的发展带来了新的发展方向:用于组织工程学器官的可降解支架(如人工血管、人工耳等);三维细胞组织拼装(人工器官的直接拼装)。
1.1 高分子
高分子材料在医疗领域的应用相对较早。事实上,这种技术在术前方案确定,手术模拟,假体预成型等领域已经有了相当长的临床史。根据CT 扫描结果重建患者的病灶区域(如需进行颅面外科矫形手术的骨结构),并由电脑模型通过3D打印技术一次成型。这种模型可用于:(1)精确重现病灶部位以及周边环境以辅助医生术前直观判断,辅助手术方案的确定或进行术前治疗模拟;(2)作为矫形模板在术前完成植入体的预整形;(3)用于个性化植入体的铸造蜡模或砂模(如齿科以及颌面整形外科植入体)。对此技术用于下颌骨钛合金矫形板的术前预成型的20 例临床研究显示:矫形板完美贴合病人颌骨,形状精确,术中无需二次调整植入体尺寸,因而大大节约了手术时间(0.25~0.68h)[3]。该技术的其他应用还包括:先天无舌整形术[4]、齿科手术模板[5]、个性化人工耳的模具(正常耳的镜像模型用于)[6]、颅骨重建整形术[7]、髋关节重建[8]、复杂脊柱修复术[9]等,均显示了很大的前景。
该技术可用于组织工程学支架的制造,模拟细胞附着和组织生长的立体环境并提供一定强度保证。与传统技术相比,其优势主要体现在加工时更大的结构自由度以及与人体器官等精确的轮廓贴合。可控的,个性化的,特征孔隙的支架结构成为了现实,而此类结构已被证实在组织工程学方面有着巨大的优势[10]。 poly(propylene fumarate), (meth)arcrylated poly(trimethylene carbonate co caprolactone), poly(lactide), polycaprolactone, poly(ethylene glycol),polycaprolactone (PCL), starch,silk fibroin, UHMWPE 等均可用于生产此类支架[11]。 使用SLS 技术控制PCL 支架孔隙率可以获得压缩模量与屈服强度分别在52MPa-67MPa 和2.0-3.2MPa之间变动的‘智能支架’,与通过有限元分析建模的预估值基本一致。同种技术制得的仿猪骨结构在植入4 周后促进了组织在三维结构内部的生长[12]。使用FDM 技术制造聚已酸内酯-磷酸钙复合材料三维支架并在临床治疗中用于颅骨修复[13]。术后6 个月CT 诊断显示已有明显骨沉积现象。
1.2 金属
得益于航空航天领域的巨大需求,金属材料的增材制造技术发展相对成熟。目前可使用该技术进行加工的材料有:钛以及钛合金、CoCr 合金、高温合金(如Inconel)、不锈钢、模具钢、硬质合金、非晶合金、铝合金、铜、铌、铍等[10]。常用于金属材料增材制造的技术有:SLM、LENS、DMLS、EBM。高能激光或电子束直接熔融金属材料,逐层加工出具有复杂结构的整体构件。此类技术在钛合金、高温合金、钢等材料的加工制造已得到了充分的研究,且已经开始了商业应用。以钛合金为例,采用合理的后处理,使用DMLS 技术加工的Ti6Al4V 展示出不低于锻造材料的静态力学性能[14],以及相当的疲劳性能(EOS 公司)。
然而值得强调的是,高能激光和电子束的使用在结构制造过程中巨大的残余热应力,不仅会引起结构变形开裂,且在材料内部引发微裂痕,影响材料性能。ASTM4999A 要求使用基于粉末床的AM 技术(如DMLS,SLM)对每件钛合金结构进行无损探伤以检查结构内部缺陷。孔隙和夹杂是该技术依然需要解决的难题,主要会影响材料的疲劳性能[15]。微裂痕,闭合孔隙等内部缺陷可以通过热等静压的方式解决。夹杂需要用过严格的原料质量控制以及生产过程控制来尽量避免。
与传统技术相比,激光(电子束)熔敷的过程造成材料粗糙表面以及更大的相对比表面积,因而可以显著改善材料的生物相容性能。而互通多孔合金结构为细胞生长提供了三维环境,并为血管和神经系统的出现提供了必要的空间,因而可以加强组织与材料融合界面的强度并促进了骨组织在三维结构中的形成。通过对成型后结构件进行HCL,NaOH 后处理或涂覆生物陶瓷涂层可以进一步增强材料的生物相容性[16]。
这里值得强调的是AM 技术使得金属材料的定制孔隙结构成为了现实,这在所有的传统工艺中是不能想象的。引入多孔结构可以增加植入物的生物相容性,促进骨融合[17,18],在保证力学行为的基础上达到最大的减重效果[10],并降低金属结构的硬度,从而尽量达到与天然骨匹配的力学性能,减小Stress shielding 效应[19]。传统手段(如粉末烧结等)很难控制孔隙形状和分布,遑论在同一构件中同时实现实体以及多种不同孔隙设计。然而,AM 技术使得根据实际应用环境,在不同部位采取不同材料以及结构以达到设计需求性能的智能植入物成为现实。Parthasarathy et al. 通过EBM 技术制造互通多孔Ti6Al4V,通过控制孔隙率以及实体支架的尺寸,达到不同力学性能[10]。孔隙率在75%~55%之间的SLM 钛结构的压缩强度在35-120MPa 之间[20],而孔隙率在49.75%~70.32%的EBM 加工Ti6Al4V 的压缩强度在7~163MPa 之间[10]。研究表明200μm 孔径促进骨结合效果最为显著[17]。
AM 技术在金属植入物的个性化应体现在:
(1)植入体外形个性化。个体骨结构差异巨大,大规模生产的植入物通常很难完全与植入物的周边环境精确配合。这在颅骨外科,整形外科的表现尤为显著。目前AM 制造是制造个性化定制植入物最为经济有效的手段。
(2)植入体细微结构个性化。通过控制细微结构,在同一医疗器械的不同部位根据生物以及力学要求设计并获得不同的力学性能,表面结构等,以最大程度体现其仿生特性。
综合考虑以上两点因素可以最大程度发挥AM 技术在金属医疗器械领域的优势,变革现有诊疗模式和植入医疗器械的生产制造。其具体实施流程见图1。通过CT、MRI 等临床诊疗手段获取病人的三维数据模型,结合逆向工程学设计植入物的三维CAD 数模,并转换为AM 制造标准输入STL 数据。采用合适软件将此三维数据转换为一系列沿纵向(加工z 轴方向)的二维层切片。选择合适的AM 制造技术有电脑控制依据二维数据逐层融化金属材料完成植入物的加工。
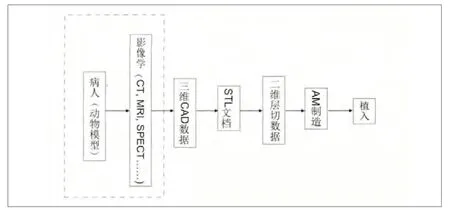
图 1. 个性化定制假体的实施流程图

图 2. 国外市售通过CE 认证或FDA 认证的增材制造医疗器械。中国尚无此类产品面世。
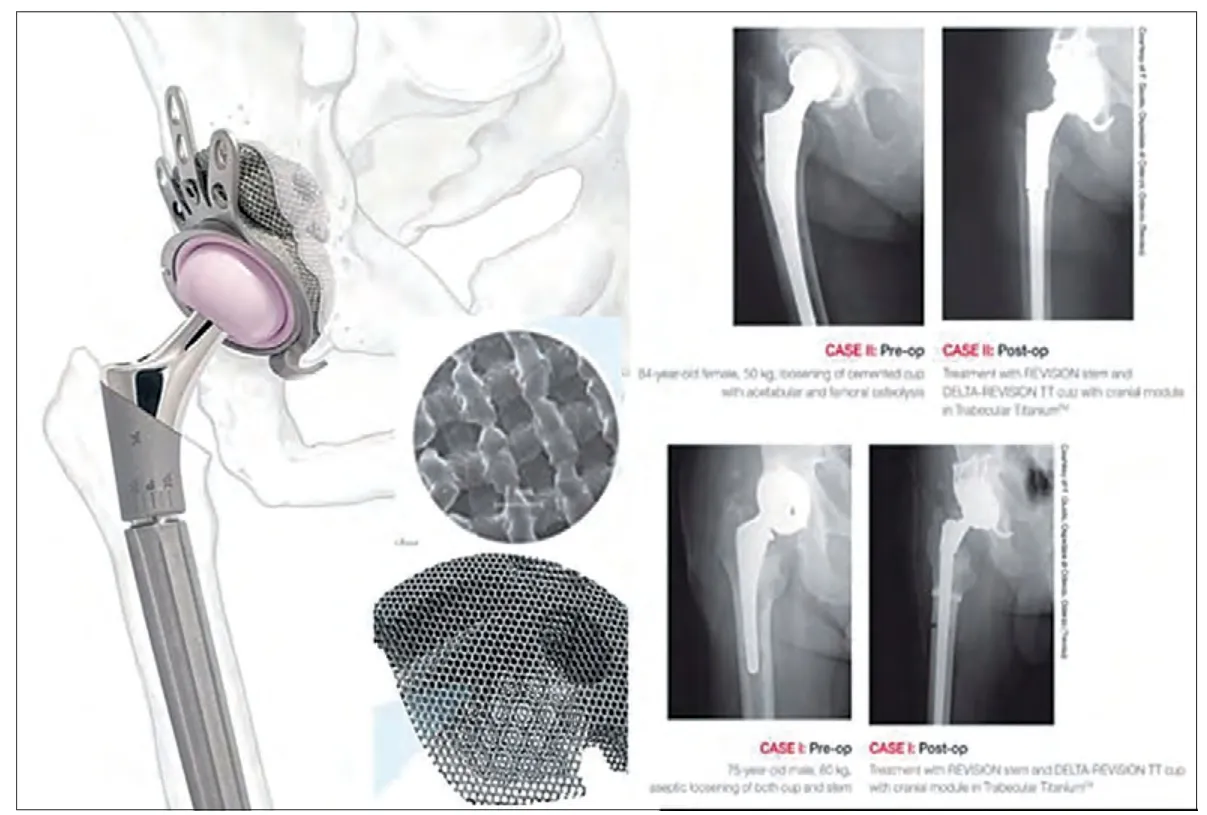
图 3. Lima Ortho 髋关节臼杯植入物,表面结构以及植入后X 光片

表 1. 陶瓷材料AM 制造技术以及性能举例 [22]
EOS 公司的DMLS 技术被用于在一例67 岁男性患者的眼部整形手术中,来制造根据病人CT临床诊断数据设计的多孔修复体[21]。2012 年,比利时与荷兰的研究机构合作为一位83 岁的女性病人定制并植入了个性化下颌骨假体[22]。通过合理的结构设计(如镂空以及内部网格结构等)在保证力学性能的前提下达到了最大程度减重:假体自重仅略大于人体下颌骨。这些特征结构还能增强细胞组织在材料表面的附着,有利于神经以及血管的三维生长。假体表面涂覆生物陶瓷涂层以进一步增强其生物相容性。
金属材料3D 打印医疗器械已经步入商品化市场化。尽管上述个性化定制假体仍处于patientspecific 的临床实验阶段, 以德国EOS 公司的DMLS 技术以及瑞典Arcam 公司的EBM 技术为代表的AM 技术已经被用于如臼杯类产品的批量生产。早在2007 年,欧盟即批准了由EBM 技术制备的关节臼杯(CE-certified),供应商为Adler Ortho 和Lima Ortho。美国FDA 于2012 年批准了此类产品的上市(Lima Ortho DELTA TT)。2007 年,Adler Ortho 的Fixa Ti-Por 臼杯全球植入达到1000例,临床显示良好骨融合[23]。目前同种技术生产的臼杯全球植入已超过30,000 例,年产量占全球臼杯类产品的2%。提供AM 金属医疗器械的公司除了欧洲的Adler Ortho 和Lima Ortho 外还有美国的Medtronic 和Exactech,如图2,图3 所示。
1.3 陶瓷
AM 技术于陶瓷以及玻璃加工的研究多集中在多孔结构制造。表格 1 中列举了几种代表性技术以及相应材料性能。加工过程中层厚、光斑直径、烧结参数、材料种类等都会影响成形结构孔隙率进而影响材料性能。如磷酸钙(Calcium Phosphate)3DP 结构根据其孔隙率的变化,压缩强度在1~77MPa 之间变动[24]。实验证明3DP 加工的磷酸钙结构有着优良的生物相容性,并在多种动物植入实验(鼠、羊等)中显示了诱导骨生长的作用。
1.4 组织工程应用
AM 技术还可直接应用于组织工程学。均匀分布细胞的胶体(水凝胶)以特定的路径挤出后通过光激发,化学或热反应以及热传导的方式在尽量减小对细胞活性影响的条件下快速产生交联,以保持三维结构。水凝胶为细胞提供了类似天然组织环境的生长条件,并支持细胞的繁殖、迁移、生长和分化。基体性能如其形貌,孔隙结构、交联度、力学性能、降解速率等均显著影响细胞活性以及成型效果[13]。凝胶种类,细胞,成型参数(如挤出温度,速率等)以及交联方式,环境影响等均会对成型细胞/凝胶复合体系产生复杂的影响。相关研究仍在进行。天然凝胶最为常用,如collagen, gelatin, matrigel, agarose, alginate, 合成凝胶也越来越多的被用于该技术的开发(PEG-DA, PEG-PPO-PEG, PPOPEG-Ala-MAm, PEG-HPMAmLa 等)[25]。常用细胞有fibroblasts, chondrocytes, hepatocytes, smooth muscle cells, adipocytes, neuronal cells, stem cells。目前此类应用较为成熟的技术有biolaserprinting, stereolithography, robotic dispensing,3D plotting等[13]。
众所周知,细胞在三维立体支架中的行为与传统二维表面有着巨大的差异。这种技术为研究三维结构中细胞行为提供重大技术突破,为细胞生物学,生物化学以及药物研究提供了新的实验技术和评价手段。尽管仍处于研究的初期阶段,可实现的活体细胞打印通常被局限在几个毫米内,但这种自动组织组装技术为人体组织工程学器官的批量大规模生产提供了新的途径。Melchels et al. 描述了组织工程学乳房假体的AM 制造方式和流程[13]。通过CT 或MRI, SPECT 等临床诊断手段获取乳房的三维电脑数据并根据需要进行重建。电脑建模时需合理在三维结构中区分乳房形状/细胞生长所需支架的材料种类和三维结构以及不同部位所需不用细胞的三维分布信息。根据电脑数据通过AM 技术进行多种材料和细胞的三维自动拼装以形成细胞与可降解材料支架的复合整体。经过合适的体外组织工程培养阶段后该乳房被植入病人体内。其仿生结构有利于促进乳房假体内的三维血管和神经生长。
目前该技术发展的主要障碍有:
(1)结构设计。细胞和组织的AM 技术与单纯材料加工不同,除了目标结构的几何尺寸数据外,还需考虑到细胞种类,分布等复杂因素,概念上类似多种材料的AM 制造。只有解决了这些信息的准确获取,才能最大程度发挥AM 技术在组织工程的优势。
(2)设备发展。当前设备对凝胶粘性有一定要求,会影响细胞的打印性能与结构精确性。另外,相对较大结构需要较长加工时间,影响细胞活性,并会造成细胞向结构底部沉积,影响细胞分布的均匀性。
(3)凝胶的性能,包括其降解性能,力学性能,交联结构等。
(4)加工尺寸。目前科研集中在毫米级别体系,然而人体组织工程学器官要求至少是厘米级甚至分米级尺寸才有实际应用意义。
2.3D 打印在中国医疗器械领域的发展现状
中国在增材制造领域已有相当的科研实力,尤其是其在航空航天领域的应用。北京航空航天大学,西北工业大学,清华大学,华中理工大学等各自投入研发不同技术并取得的一定成果。医疗器械的研究单位相对较少。清华大学研发LDM(Low-temperature Deposition Manufacturing)技术并专注于其在组织工程领域的应用[22]。第四军医大学使用RP 技术辅助半面短小整形术[26]。上海第九人民医院使用RP 模型辅助复杂髋关节重建术,术后跟踪最长已达9 年时间[27]。香港大学采用stereolithography 技术加工光敏树脂血管模型用来模拟血管超声检查[28]。华南理工大学通过SLM 技术加工科用于医用材料的互通多孔钛合金结构并成功将该技术用于多孔股骨模型的重建[29]。杨永强等通过SLM 技术制备316L 不锈钢个性化骨板用于骨肿瘤切除手术,临床结果证明了该技术能帮助医生更准确、快捷地切除病变区域,并作为模板精确修整用于移植的异体骨[30]。周丽斌等通过RP 技术制造个性化下颌植入体模具并铸造钛合金植入物。杂种犬植入试验及核素骨显像检查证实了此类植入体的有效性和可行性[31]。台湾ChangGung Memorial Hospital, Chang Gung University 通过RP 技术预制备的甲基丙烯酸甲酯个性化假体在31 例颅骨缺损病人(接受过传统修复术但均失效)的修复术中有优良的效果,临床植入报告显示只有3 例产生了需要移除的感染,他们认为这种技术为颅骨修复术提供了安全,准确,高效以及用户友好的临床手段[32]。北京乐乐嘉和无锡飞而康投资引进了DMLS 技术开始尝试如义齿等医疗器械的生产。
3.制约中国3D 打印在医疗器械行业发展的主要因素
3.1 设备和材料
目前成熟的可用于医疗器械加工的3D 打印设备多为欧美开发(如EOS,Arcam, 3DP, Object 等),而中国的设备相对落后,市售设备多用于高分子材料加工(如南京紫金立德,湖南华曙)。AM 技术对原材料有很高的性能要求,以粉末材料为例,颗粒的尺寸、粒度分布、均匀性、流动性等均严重影响成型效果。如何在控制原料的夹杂也是生产质量控制领域必须解决的难题之一。尤其是金属粉末原料如钛合金和高温合金,高规格的原料基本只能依靠进口解决,价格高周期长。这些均在客观上制约了AM 制造在中国的工业化推广进程。
3.2 产品设计和研发
国内对AM 技术在医疗器械,尤其是三级植入医疗器械领域的探索尚浅。同时,自主知识产权的骨科以及矫形外科植入物并不多,知识积累不足。AM 技术在医疗领域冲击的不仅仅是产品制造,更是从诊断到诊疗的全过程。因而需要投入大量的研发成本进行相关过程验证,产品开发,以期获得自主知识产权的3D 打印医疗器械。
同所有医疗器械一样,AM 技术产品若想在医疗领域得到商业应用,需要经过漫长的性能验证,临床前测试以及临床试验,尤其是组织工程学支架产品以及包含细胞的组织工程学产品,以最终获取市场准入资格。尽管有着巨大的经济前景,此过程中带来的昂贵的投入和漫长的时间会严重制约该行业的发展。
3.2 标准以及监管体系方面
AM 技术为临床诊断和治疗领域带来了巨大变化。传统的监管模式是否能够适应这种高效、各异性差别极大的医疗器械需要进行验证。同时因为这种技术综合了从临床诊断到材料加工及手术治疗的整个过程,如何安全有效的跟踪并监管全过程需要相关部门进行调整适应。需要完成的工作如:
(1)3D 打印技术用于医疗器械,尤其是异形、个性化医疗器械的过程验证。包括临床数据采集以及处理,3D 打印加工过程控制等。
(2)建立对3D 打印医疗器械材料性能的检验体系以系统评价其化学、物理以及生物相容性能。
(3)相关行业标准的建立以规范包括原料加工运输储存使用、3D 打印制造过程、产品质量控制等等。
4.结语
AM 技术的发展前景毋庸置疑。2012 年3 月,美国白宫宣布将投资10 亿美元支持包括增材制造在内的新技术发展,并于2012 年8 月联合宾夕法尼亚州西部、俄亥俄州东部和弗吉尼亚州西部的14 所大学、40 余家企业、11 家非营利机构和专业协会正式成立美国增材制造创新研究所。英国工程与物理科学研究委员会联合拉夫堡大学、伯明翰大学、英国国家物理实验室、波音公司以及德国EOS 公司等15 家知名大学、研究机构及企业成立了增材制造研究中心。
AM 技术的成熟促进了第四代智能医疗器械的产生和商业化[33],有着广阔的市场前景。然而其昂贵的研发成本,有限的临床数据,以及严重缺乏的行业标准和监管体系严重制约了它的商业化发展。需要政府、科研机构、制造商以及医疗机构的全方位配合以促进AM 技术尽快在医疗领域展示其优势并开始商业化运营。
[1] International A. Standard Terminology for Additive Manufacturing Technologies. 100 Barr Harbor Drive, West Conshohocken, PA 19428.
[2] Cozmei C, Caloian F. Additive Manufacturing Flickering at the Beginning of Existence. Procedia Economics and Finance. 2012;3:457-62.
[3] Lethaus B, Poort L, Böckmann R, Smeets R, Tolba R, Kessler P. Additive manufacturing for microvascular reconstruction of the mandible in 20 patients. Journal of Cranio-Maxillofacial Surgery. 2012;40:43-6.
[4] Salles F, Anchieta M, Costa Bezerra P, Torres MLGM, Queiroz E, Faber J. Complete and isolated congenital aglossia: case report and treatment of sequelae using rapid prototyping models. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 2008;105:e41-e7.
[5] Papaspyridakos P, Lal K. Complete arch implant rehabilitation using subtractive rapid prototyping and porcelain fused to zirconia prosthesis: A clinical report. The Journal of Prosthetic Dentistry. 2008;100:165-72.
[6] Liacouras P, Garnes J, Roman N, Petrich A, Grant GT. Designing and manufacturing an auricular prosthesis using computed tomography, 3-dimensional photographic imaging, and additive manufacturing: A clinical report. The Journal of Prosthetic Dentistry. 2011;105:78-82.
[7] Petzold R, Zeilhofer HF, Kalender WA. Rapid prototyping technology in medicine—basics and applications. Computerized Medical Imaging and Graphics. 1999;23:277-84.
[8] Hurson C, Tansey A, O’ Donnchadha B, Nicholson P, Rice J, McElwain J. Rapid prototyping in the assessment, classification and preoperative planning of acetabular fractures. Injury. 2007;38:1158-62.
[9] Song Z-L, Feng C-K, Chiu F-Y, Liu C-L. The clinical significance of rapid prototyping technique in complex spinal deformity surgery—Case sharing and literature review. Formosan Journal of Musculoskeletal Disorders. 2013;4:88-93.
[10] Parthasarathy J, Starly B, Raman S. A design for the additive manufacture of functionally graded porous structures with tailored mechanical properties for biomedical applications. Journal of Manufacturing Processes. 2011;13:160-70.
[11] Goodridge RD, Hague RJM, Tuck CJ. An empirical study into laser sintering of ultra-high molecular weight polyethylene (UHMWPE). Journal of Materials Processing Technology. 2010;210:72-80.
[12] Williams JM, Adewunmi A, Schek RM, Flanagan CL, Krebsbach PH, Feinberg SE, et al. Bone tissue engineering using polycaprolactone scaffolds fabricated via selective laser sintering. Biomaterials. 2005;26:4817-27.
[13] Melchels FPW, Domingos MAN, Klein TJ, Malda J, Bartolo PJ, Hutmacher DW. Additive manufacturing of tissues and organs. Progress in Polymer Science. 2012;37:1079-104.
[14] Murr LE, Martinez E, Amato KN, Gaytan SM, Hernandez J, Ramirez DA, et al. Fabrication of Metal and Alloy Components by Additive Manufacturing: Examples of 3D Materials Science. Journal of Materials Research and Technology. 2012;1:42-54.
[15] Leuders S, Thöne M, Riemer A, Niendorf T, Tröster T, Richard HA, et al. On the mechanical behaviour of titanium alloy TiAl6V4 manufactured by selective laser melting: Fatigue resistance and crack growth performance. International Journal of Fatigue. 2013;48:300-7.
[16] Heinl P, Müller L, Körner C, Singer RF, Müller FA. Cellular Ti–6Al–4V structures with interconnected macro porosity for bone implants fabricated by selective electron beam melting. Acta Biomaterialia. 2008;4:1536-44.
[17] Götz HE, Müller M, Emmel A, Holzwarth U, Erben RG, Stangl R. Effect of surface finish on the osseointegration of lasertreated titanium alloy implants. Biomaterials. 2004;25:4057-64.
[18] Bertollo N, Da Assuncao R, Hancock NJ, Lau A, Walsh WR. Influence of Electron Beam Melting Manufactured Implants on Ingrowth and Shear Strength in an Ovine Model. The Journal of Arthroplasty. 2012;27:1429-36.
[19] ŚCigaŁA K, BĘDziŃSki R, Filipiak J, Chlebus E, DybaŁA B. Application of generative technologies in the design of reduced stiffness stems of hip joint endoprosthesis. Archives of Civil and Mechanical Engineering. 2011;11:753-67.
[20] Pattanayak DK, Fukuda A, Matsushita T, Takemoto M, Fujibayashi S, Sasaki K, et al. Bioactive Ti metal analogous to human cancellous bone: Fabrication by selective laser melting and chemical treatments. Acta Biomaterialia. 2011;7:1398-406.
[21] Jun Y, Choi K. Design of patient-specific hip implants based on the 3D geometry of the human femur. Advances in Engineering Software. 2010;41:537-47.
[22] Bartolo P, Kruth J-P, Silva J, Levy G, Malshe A, Rajurkar K, et al. Biomedical production of implants by additive electrochemical and physical processes. CIRP Annals - Manufacturing Technology. 2012;61:635-55.
[23] Cremascoli P, Ohldin P. Orthopedic Implants with Integrated, Designed Network Structure for Improved Osseointegration. European Cells and Materials. 2009;17:7.
[24] Butscher A, Bohner M, Hofmann S, Gauckler L, Müller R. Structural and material approaches to bone tissue engineering in powder-based three-dimensional printing. Acta Biomaterialia. 2011;7:907-20.
[25] Billiet T, Vandenhaute M, Schelfhout J, Van Vlierberghe S, Dubruel P. A review of trends and limitations in hydrogel-rapid prototyping for tissue engineering. Biomaterials. 2012;33:6020-41.
[26] Zhou L, He L, Shang H, Liu G, Zhao J, Liu Y. Correction of hemifacial microsomia with the help of mirror imaging and a rapid prototyping technique: case report. British Journal of Oral and Maxillofacial Surgery. 2009;47:486-8.
[27] Li H, Wang L, Mao Y, Wang Y, Dai K, Zhu Z. Revision of Complex Acetabular Defects Using Cages with the Aid of Rapid Prototyping. The Journal of Arthroplasty.
[28] Lai SSM, Yiu BYS, Poon AKK, Yu ACH. Design of Anthropomorphic Flow Phantoms Based on Rapid Prototyping of Compliant Vessel Geometries. Ultrasound in Medicine & Biology. 2013;39:1654-64.
[29] Su X-b, Yang Y-q, Yu P, Sun J-f. Development of porous medical implant scaffolds via laser additive manufacturing. Transactions of Nonferrous Metals Society of China. 2012;22, Supplement 1:s181-s7.
[30] 杨永强, 何兴容, 吴伟辉, 丁焕文, 王迪, 孙婷婷, et al. 选区激光熔化直接成型个性化骨科手术模板. 中国激光. 2009;36:7.
[31] 周丽斌, 刘彦普, 胡曼, 刘葳, 王晓聪, 何亚会, et al. 利用核医学方法监测自体移植骨在个体化钛支架内的转归. 实用口腔医学杂志. 2008;24:7.
[32] Goh RCW, Chang C-N, Lin C-L, Lo L-J. Customised fabricated implants after previous failed cranioplasty. Journal of Plastic, Reconstructive & Aesthetic Surgery. 2010;63:1479-84.
[33] Holzapfel BM, Reichert JC, Schantz J-T, Gbureck U, Rackwitz L, Nöth U, et al. How smart do biomaterials need to be? A translational science and clinical point of view. Advanced Drug Delivery Reviews. 2013;65:581-603.

