ISO17664《制造商提供的可重复灭菌的医疗器械的处理信息》标准解读
管西军 Intertek 天祥集团 (深圳 518000)
为了防止医疗器械使用中的交叉感染,越来越多的无菌使用的医疗器械都在向一次性使用方向发展,尽管是这样,仍有相当一部分医疗器械是重复性使用的器械。对于重复性使用的医疗器械,器械在每次使用前如何处理,对于器械再次使用的安全性和有效性非常重要。然而,由于制造商没有提供再处理信息,或提供的再处理信息过于简单,这会导致医院采用了不当的处理方案。其后果往往是不可避免地导致器械的使用性能和安全可靠性降低,或使器械达不到预期的使用寿命。国际标准化组织认识到,向医疗单位提供足够详细的再处理信息,并能正确指导医疗器械的再处理过程是医疗器械制造商的责任。为此专门制定了ISO 17664 标准,用以指导医疗器械制造商向医疗机械提供正确的处理方法。
标准(以下“标准”都为ISO17664 标准)的正文共分:范围、术语和定义、医疗器械制造商提供的信息、信息的表述、提供的再处理信息的确认、风险分析六章要求。
• 标准适用于预期多次使用的医疗器械,这些器械预期需要从其一次使用后的状态,处理成无菌且供下一次使用的状态。有些非无菌供应但预期无菌状态使用的医疗器械也将需要类似的处理,并符合标准的内容。
• 标准的术语部分参见标准。
• 标准中涉及的医疗器械“再处理”的一般流程可用图1 来直观地描述(即医疗器械制造商需提供的信息)。
“准备”:分两个阶段,即使用地点的准备和清洗前准备。前者一般是由医务人员在使用完器械后,在送去处理前所需进行的工作,比如,用布或纸先简单擦拭、装入适宜的容器等事项,以使器械便于进一步的处理和防止器械在运送过程中受到损坏;后者则是由处理者(医疗机构的消毒室或承包机构)在处理前的准备,如打开、拆开器械、刷拭等。
“清洗”:制造商一般应提供确认过的自动清洗和手工清洗两种清洗方法。如果不能用自动清洗,制造商应给出警示。
“消毒”: 灭菌前的消毒,是为了下一步对器械进行检验和维修,防止将器械上可能携带的病毒向检修人员传播。制造商一般应提供自动和手工消毒两种方法。
“干燥”: 有些器械消毒后需要进行干燥,需要时,制造商应提供确认过的方法。
“检验和试验”:主要是检验清洗的效果和器械的性能是否还满足使用要求。
“维护”:在灭菌前对其进行适当的或必要的维护,比如对活动铰链进行必要的润滑。
“包装”:制造商应规定采用适合于预期灭菌和灭菌后贮存的包装,以便对器械进行灭菌并保持其在再次使用前无菌。应确认包装与拟用的灭菌过程相适宜,与被包装的器械相适宜。
“灭菌”: 制造商应规定确认过的灭菌方法。
“贮存”: 制造商应对再处理后医疗器械使用前贮存时间或条件的任何限定予以说明,以确保贮存中的器械保持器械的安全性和有效性。
• 信息的表述
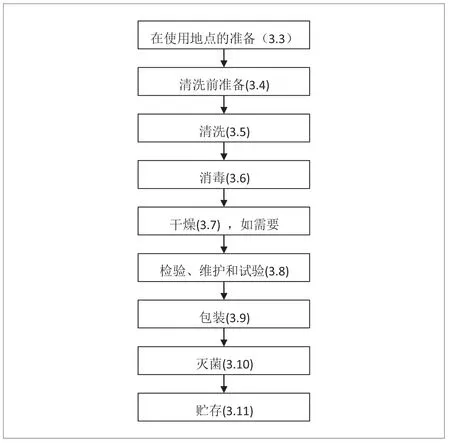
图1. 重复性使用医疗器械的再处理流程图
由于器械的属性和用途等各有不同,制造商对以上各环节所提供的再处理信息的具体内容有所不同,应在考虑以下方面后确定所提供信息的详细程度。
— 处理者所具备的基础知识;
— 处理者所接受的培训;
— 处理者所具备的(资源);
为了方便标准的使用者,标准的附录B 推荐了重复性使用医疗器械的处理信息的标准格式,并给出了示例表。该表直观、简便、规范,以便制造商参照。标准强调制造商对所提供的各项处理信息都应经过确认,这是执行该标准的难点所在。
• 提供的再处理信息的确认
制造商应对其所提供的再处理信息中的任何过程是否能使医疗器械达到预期使用予以确认。
注:在制造商提供的是一组具有共同结构和属性的多个不同医疗器械时,制造商可将这些器械作为一个组或一类一起进行确认。制造商要能证实这些医疗器械具有共性,并在这一组产品中的“最坏情况”结构或属性下开展试验和评定。
这些确认活动一般由工厂检查,审核的方式由主管当局完成,并判定是否符合。
• 风险分析
在制造商为所要提供的信息的详细内容进行风险分析时,医疗器械制造商应考虑:
— 医疗器械的性质;
— 医疗器械的预期使用;
— 处理者一般所接受的培训和知识;
— 处理者一般所具有的设备。
这些风险分析活动应在制造商的风险管理报告中涉及,并采用特定的方法对于医疗器械提出警示,避免器械的损坏或采用不安全的处理方法。
• 结论
为特定医器械识别和确认具体处理程序被认为是制造商的职责。 而处理者宜阅读并遵照医疗器械、处理设备和/或处理用化学物品制造商所提供的说明书。
对于重复灭菌医疗器械或由用户预期灭菌后一次性使用的医疗器械的制造商应通过说明书、标签、用户手册、符号、图样等方式提醒、指导、警示用户。
清洗,消毒,干燥,检验,灭菌,贮存的要求应体现在制造商提供的可重复灭菌的医疗器械的处理信息中,并由制造商对其完成过程确认。
ISO17664 已经成为各公告机构对于重复灭菌医疗器械或由用户预期灭菌后一次性使用的医疗器械审核的依据之一。
[1] GB 17665 医疗保健产品的灭菌 确认和常规控制要求 工业湿热灭菌
[2] EN 285:1996 灭菌 蒸汽灭菌器 大型灭菌器
[3] ISO11135-1 医疗器械 环氧乙烷灭菌的确认和常规控制 [4] ISO11607 最终灭菌医疗器械的包装
[5] ISO 14937:2000 医疗保健产品的灭菌 灭菌剂特性的通用要求和医疗器械灭菌过程的确认和常规控制
[6] ISO15233 医疗器械 用于医疗器械标签、标记和提供信息符号
[7] ISO 7000:1989 设备用图形符号 索引和一览表
[8] Medical Devices Agency: Sterilization, Disinfection and Cleaning of Medical Equipment: Guidance on Decontamination from Microbiology Advisory Committee to the Department of Health, Medical Devices Agency; Part 1 Principles, Part 2 Protocols, Part 3 Procedures 1993-2000 London

