LAMP®技术在肺炎支原体快速检测中的应用
辛德莉 李丹 米佳
1 首都医科大学附属友谊医院北京热带病研究所 (北京 100050)
2 北京蓝谱生物科技有限公司 (北京 100081)

与传统的核酸扩增检测的方法聚合酶链式反应(PCR)相比,LAMP®方法具有操作简便、灵敏度高、特异性强,反应结果判定简单,检测成本低等特点。LAMP®方法的检测灵敏度高于普通PCR 2~3 个数量级,而且,LAMP®的扩增是一个等温过程(60~65˚C),扩增时间短(1h),对设备的要求简单,只需要一个水浴锅或恒温装置即可完成。LAMP®反应结果的检测也很简单,不需要像普通PCR 那样进行凝胶电泳,只需要通过肉眼直接观察白色浑浊或者绿色荧光即可,是一种简便、快捷、适合进行临床及大量样品的高通量检测方法。
LAMP®技术已在医疗、动植物、水产、食品、环境领域的病毒、细菌、寄生虫等方面得到广泛应用,如Yiyue et., al 利用LAMP®技术快速检测H7N9 病毒,灵敏度可达10 拷贝,具有非常好的特异性[2]。Jianyu et., al 利用环介导等温扩增法,耐甲氧西林金黄色葡萄球菌的mecA 基因为靶基因,特异的检测出耐甲氧西林金黄色葡萄球菌的,灵敏度能达到10 拷贝DNA 或10CFU/反应[3]。Jaymin C et., al 采用环介导等温扩增法特异的检测疟原虫,灵敏度和特异性均与金标准槽式PCR 一致[4]。但是在支原体上的研究较少,李鹏等建立了猪肺炎支原体的环介导等温扩增诊断方法,其灵敏度可达6 拷贝,且具有很好的特异性[5]。谢秀兰等建立的羊丝状支原体簇的快速环介导等温扩增检测方法,检出限为10pg/µl[6]。
肺炎支原体是一种介于病毒和细菌之间,能独立生活的最小微生物,缺乏细胞壁,呈现出高度多型性,是人类支原体肺炎的病原体。肺炎支原体(Mycoplasma pneumonia, MP)是引起支原体肺炎的主要病原体,支原体肺炎约占各种肺炎的10%,已成为发病率最高的传染疾病,严重者可导致死亡,潜伏期一般为2~3 周,常见于儿童和青少年,秋冬发病较多。
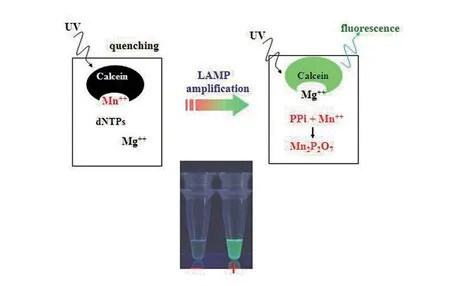
图1. 使用钙黄绿素检测LAMP®反应原理图
支原体肺炎的临床表现主要为持续发热、咳嗽、咳痰等,临床表现和胸部X 线检查并不具特征性,单凭临床表现和胸部X 线检查无法做出诊断,若要明确诊断,需要进行肺炎支原体的检测。目前,国内肺炎支原体的诊断主要依靠病原体培养、血清学检测和PCR 法。
肺炎支原体培养较困难,存在临床标本中病原体含量较少、呼吸道污染的杂菌较多、耗时及阳性率低等缺点,目前的临床检测中已很少应用。血清学检查主要有补体结合试验,冷凝集试验,凝集试验和酶联免疫吸附法(ELISA)。血清学技术主要依靠抗体进行检测,有明显的滞后性,且受个体免疫差异影响较大,检测灵敏度和特异性较低。随着分子生物学的发展,PCR 技术已在临床诊断中得到较好应用,但也存在灵敏度较低,耗时较长,操作较复杂,对技术人员的要求较高,对设备的要求较高,无法实现基层化及现场化等缺点。
近年来,支原体肺炎占了小儿肺炎的20%以上,随着诊断技术的发展,其检出率增高,发现它也是小儿呼吸道感染的重要病原体,日益得到重视。研究出一种快速、准确、简便的检测方法将有助于及时发现、及时治疗。
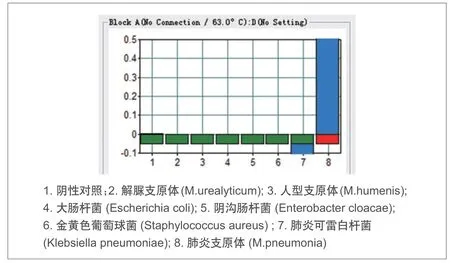
图3. MP-LAMP® 法特异性实验结果
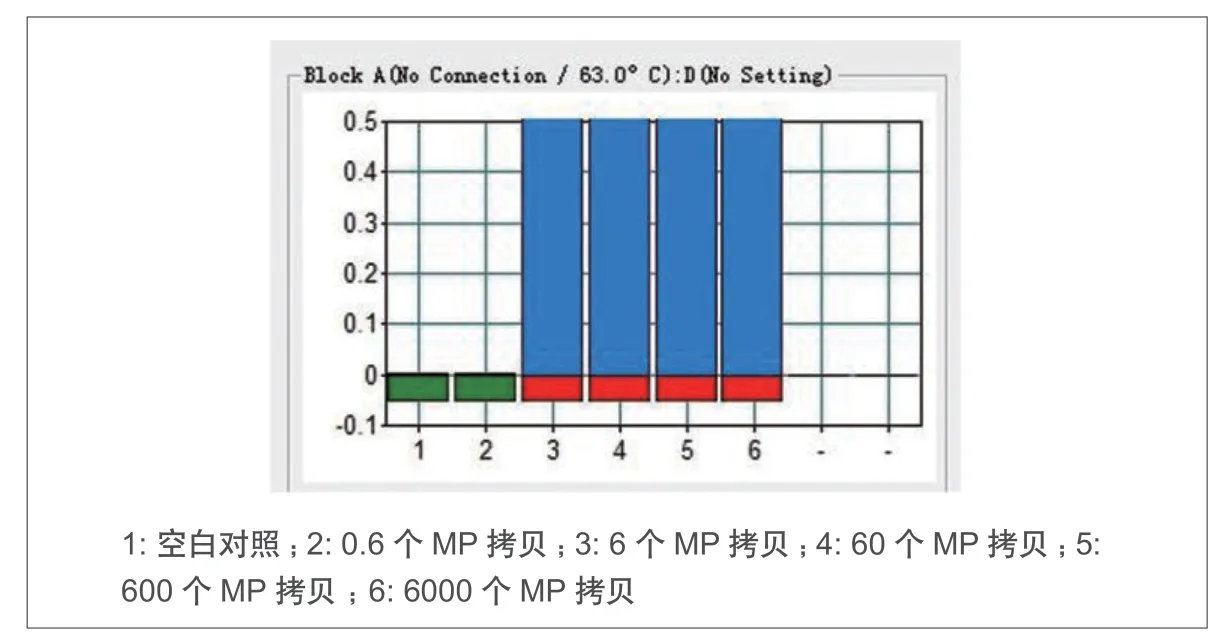
图4. MP-LAMP® 法灵敏度实验结果
本研究将环介导等温扩增技术应用于肺炎支原体的检测中,首先从NCBI 上查找肺炎支原体特异基因序列,使用LAMP®专用引物设计(http://primerexplorer.jp/elamp4.0.0/index.html)设计多组引物。为了能特异的对引物进行筛选,以及对引物工作浓度、反应时间进行控制,本实验采用日本荣研LAMP®技术的专用产品——Loopamp®DNA 扩增试剂盒(图2-A)和Loopamp®实时浊度基因快速扩增检测系统(图2-B)筛选出最佳引物,将最佳引物进行特异性、灵敏度实验。
将收集的临床样本肺炎支原体及解脲支原体、人型支原体、大肠杆菌、阴沟肠杆菌、金黄色葡萄球菌和肺炎可雷白杆菌样本进行特异性实验,采用MP-LAMP®方法进行检测,只有肺炎支原体显示为阳性,其他菌均显示为阴性(图3),表明MP-LAMP®方法具有较好的特异性。
将定量的MP 质粒进行10 倍梯度稀释后(6000copy,600copy,60copy,6copy,0.6copy)作为模板进行灵敏度实验,实验结果表明,MPLAMP®方法的灵敏度可达6 拷贝(图4)。
传统进行肺炎支原体检测的方法费时,准确度、灵敏度较低,容易漏检或误检,而MPLAMP®方法在一个小时内即可得到结果,且灵敏度和特异性高,为临床上快速、准确诊断肺炎支原体提供可能。
[1] Notomi T,Okayama H,Masubuchi H,et al. Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28( 12) : e63.
[2] Yiyue Ge, Bin Wu, Xian Qi.et al., Rapid and Sensitive Detection of Novel Avian-Origin Influenza A (H7N9) Virus by Reverse Transcription Loop-Mediated Isothermal Amplification Combined with a Lateral-Flow Device,Pols one,8(8):e69941
[3] Jianyu Su, Xiaochen Liu, Hemiao Cui, et al., Rapid and simple detection of methicillin resistance staphylococcus aureus by orfX loop-mediated isothermal amplification assay. BMC Biotechnology 2014, 14:8
[4] Jaymin C. Patel, Jenna Oberstaller, Maniphet Xayavong, et al., Real-Time Loop-Mediated Isothermal Amplification (RealAmp) for the Species-Specific Identification of Plasmodium vivax,Pols one,8(1)e54986)
[5] 李鹏,马艳娇,于剑等,猪肺炎支原体环介导等温扩增检测方法的建立. 中国生物制品学杂志,2011,4:21-24.
[6] 谢秀兰,康晓冬,储岳峰等,羊丝状支原体簇环介导等温扩增检测方法的建立. 中国畜牧兽医,2012,39(12)

