聚硅氧烷衍生的手性伯胺催化不对称aldol反应的研究
杨 伟,王彩云,黄伟升,郑战江,杨科芳,徐利文
(杭州师范大学有机硅化学及材料教育部重点实验室,浙江 杭州311121)
前 言
构建季碳手性中心是不对称合成化学的重要挑战之一,目前关于立体控制前手性酮的亲核加成反应报道较少[1-3].不对称催化aldol反应被认为是有机合成反应中构建C-C键最有效的方法之一[4-8],以酮作为亲电试剂的不对称aldol反应被广泛研究,生成的目标产物是有机合成反应的重要中间体.然而,由于酮的反应活性低,以酮为亲电试剂的研究至今仍然是一个难点,目前的研究大多采用α,α,α-三氟甲基苯乙酮,其中三氟甲基具有强烈的吸电子作用,使得与三氟甲基相连的羰基很容易受到亲核试剂进攻,但公开的报道较少[9-15].
最早报道的α,α,α-三氟苯乙酮的不对称aldol反应采用手性仲胺作为催化剂.2005年,张雅文等人首次报道了L-脯氨酸催化的α,α,α-三氟苯乙酮和丙酮的不对称aldol反应,取得了很好的产率(99%)和中等以上的对映选择性(64%ee)[16],之后陆续报道了以L-脯氨酸或L-脯氨酸的衍生物为催化剂催化类似的不对称aldol反应研究工作[17-18].2011年,Shuichi Nakamur及其同事利用脯氨酸衍生的催化剂催化该反应并得到良好的产率和中等到优秀的立体选择性(77-92%ee)[19].2012年,Berkessel等人和Kokotos分别独立地报道了用脯氨酸衍生物催化α,α,α-三氟苯乙酮和丙酮的不对称Aldol反应,均取得了较好的产率和对映选择性[20-21].
众所周知,聚硅氧烷是一种具有疏水性和化学惰性的聚合物,其分子链上含有硅、氧原子,有机基团与硅原子相连.目前聚硅氧烷在催化反应中主要是利用其硅氧骨架的柔韧多变和疏水性作为催化剂的载体,而作为有机催化剂的基团或者一部分催化有机反应的报道却非常少.Siegel[22]和Bergbreiter[23]报道了用聚硅氧烷作为Lewis碱有机催化剂(金鸡纳碱衍生物)的可溶性聚合物载体,催化硫醇与α,β-不饱和酮或酯的不对称Michael加成反应,但是仅有很低的ee值.前期工作中,课题组利用环氧聚硅氧烷和(R,R)-1,2-二苯基乙二胺(DPEN)合成了一种新的伯胺催化剂并用其催化环己酮与含吸电子基的芳香醛之间的不对称aldol反应,取得了不错的产率,获得中等到优秀的立体选择性(>99:1)和理想的对映选择性(99%ee)[24].
基于已有报道,我们希望能发展一种聚硅氧烷衍生的伯胺催化剂催化α,α,α-三氟苯乙酮的不对称aldol反应,以及高立体选择性的合成含氟季碳手性化合物的新方法.
1 实验部分
1.1 试剂与仪器
石油醚(60-90 ℃)、乙酸乙酯、二氯甲烷、乙醚等有机溶剂均为分析纯试剂,江苏永华精细化学品有限公司生产;三氟甲基苯乙酮、三氟乙醇为国产分析纯试剂,阿拉丁公司生产;环氧硅油(环氧值0.3mmol/g),杭州包尔得有机硅有限公司;薄层板采用青岛海洋化工有限公司生产的GF254,柱层析硅胶为青岛海洋化工有限公司生产,湿法装柱;核磁共振仪,Brucker公司Advance-400型400M 核磁共振仪;红外光谱仪,Nicolot公司FTIR-Nicolot-5700傅立叶变换红外分光光度仪;高效液相色谱仪,Waters公司Waters 2695 HPLC,2996UV 检测器,手性柱为日本大赛璐手性色谱柱.
1.2 催化剂的制备(以催化剂A 为例)
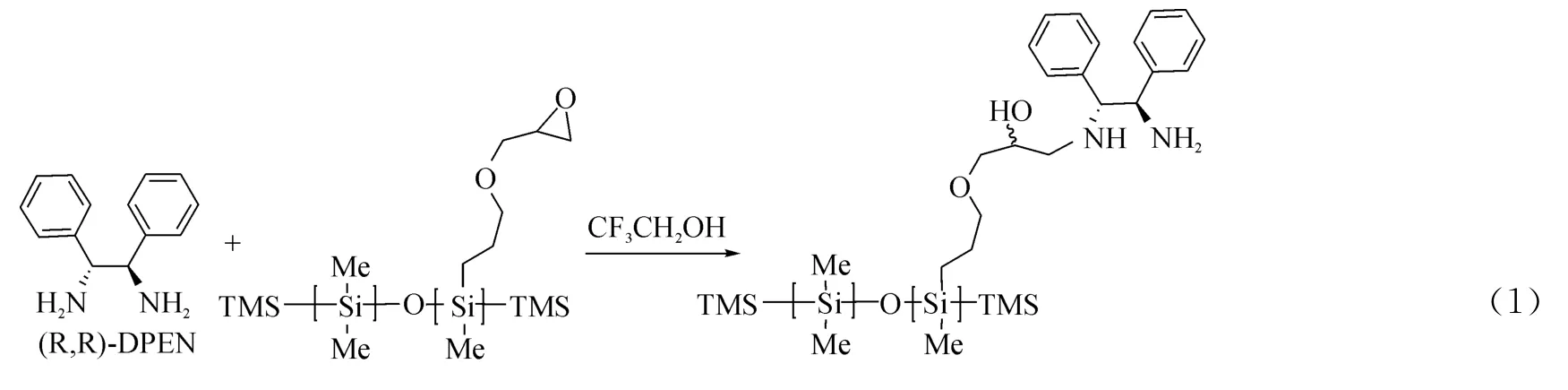
图1 催化剂A的制备Fig.1 The preparation of catalyst A
在100mL 的三口圆底烧瓶中依次加入环氧硅油(30.0g,9 mmol)、(R,R)-DPEN(1.89g,30 mmol),三氟乙醇30mL,在室温下搅拌,用TLC监测至反应完全.旋干溶剂,干燥,即得到催化剂A(见图1).1H NMR(400 MHz,CDCl3):7.30-7.28(m,1H),7.24-7.22(m,1H),7.17-7.01(m,8H),4.03-3.98(m,2H),3.93-3.87(m,1H),3.75-3.67(m,1H),3.50(s,2H),3.49(s,2H),2.84-2.46(m,5H),1.73-1.61(m,2 H),0.62-0.50(m,2H),0.22(s,2H),0.18(s,3H),0.10(s,290H).元素分析得:氮元素含量为:0.26mmol/g.
1.3 不对称有机催化三氟苯乙酮与丙酮反应的一般过程
称取10mol% 伯胺催化剂和10mol%的Boc-L-苯丙氨酸于反应小瓶中,加入水0.5mL,再加入丙酮(0.36mL,10eq),α,α,α-三氟苯乙酮(0.5mmol,70μL),反应15h.反应结束后水相用CH2Cl2萃取3次,合并有机相,水洗,盐洗,干燥,旋干溶剂,得粗产品,快速柱层析,得到目标产物,无色液体,产率90%,54%ee.=5.16(c 0.30,CHCl3).1H NMR(400MHz,CDCl3):7.48(m,2H),7.29(m,3H),5.37(s,1H),3.20(q,J=17.2 Hz,2H),2.11(s,3H);13C NMR(100MHz,CDCl3):208.6,137.0,128.4,128.1,125.7,44.74,31.7;19F NMR(376.5 MHz,CDCl3):-80.35(s);IR(KBr)(vmax/cm-1):3442.06,2925.93,2854.48,2361.57,2344.25,2069.04,1704.18,1630.33,1497.43,1451.38,1401.52,1337.98,1164.09,1061.96,1000.83,906.86,765.69,736.64,709.62,633.02,573.40,525.79;HRMS(ESI)calcd.for C11H11F3NaO2[M+Na]+:255.0603,found 255.0616.HPLC analysis:chiralcel OD-H column,i-PrOH/hexane 5:95,flow rate 1.0ml/min,λ=210nm,tmajor=14.12min,tminor=8.33min.
2 结果与讨论
制备了不同浓度、不同构型的聚硅氧烷催化剂(A-F)[25],以α,α,α-三氟苯乙酮和丙酮的不对称aldol反应为模型反应,基于聚硅氧烷的疏水性和化学惰性,考察催化剂A 与不同的酸在水相中共同催化该反应的效果.

表1 催化剂A与不同酸在水相中催化下的三氟甲基苯乙酮与丙酮的反应结果Tab.1 Evaluation of the asymmetric aldol reaction ofα,α,α-trifluoro-acetomphenone and acetone by catalyst A and different acid in water
由表1可知,三氟甲磺酸与催化剂A 共同催化时,能取得相对较好的对映选择性(59%ee),但是产率较低(序列2).当使用手性酸时,目标产物取得很好的产率,同时也能取得相对较高的对映选择性(序列5,8和9).Boc保护的不同氨基酸对催化体系的影响显著,如Boc-L-苯丙氨酸/催化剂A 体系催化三氟苯乙酮与丙酮的不对称aldol反应时,产物具有优异的产率(94%)和对映选择性(54%),而采用组氨酸与催化剂A 组成的催化体系,几乎不能得到目标产物(序列6).不同构型的手性酸与催化剂A 所组成的催化体系,催化该模型反应所得的结果有很大的差别,R-扁桃酸所得的结果明显要好于S-扁桃酸所得的结果(序列8和9).
不同结构的催化剂对该模型反应的催化效果不同,由表2可知,随着催化剂中氮含量的降低,其催化效果随之下降,当催化剂中氮含量为0.12mmol/g时,反应不能发生(序列4).催化剂的构型对反应也具有较大影响,(S,S)-DPEN 衍生的伯胺催化剂的催化效果差于(R,R)-DPEN 衍生的伯胺催化剂的催化效果(序列1和5).聚硅氧烷与L-苯丙氨酸所合成的催化剂不能有效催化该反应的进行(序列6).仅使用(R,R)-DPEN 或者采用(R,R)-DPEN 与环氧硅油共混物,反应的对映选择性均低于催化剂A 催化的反应(序列7和8).
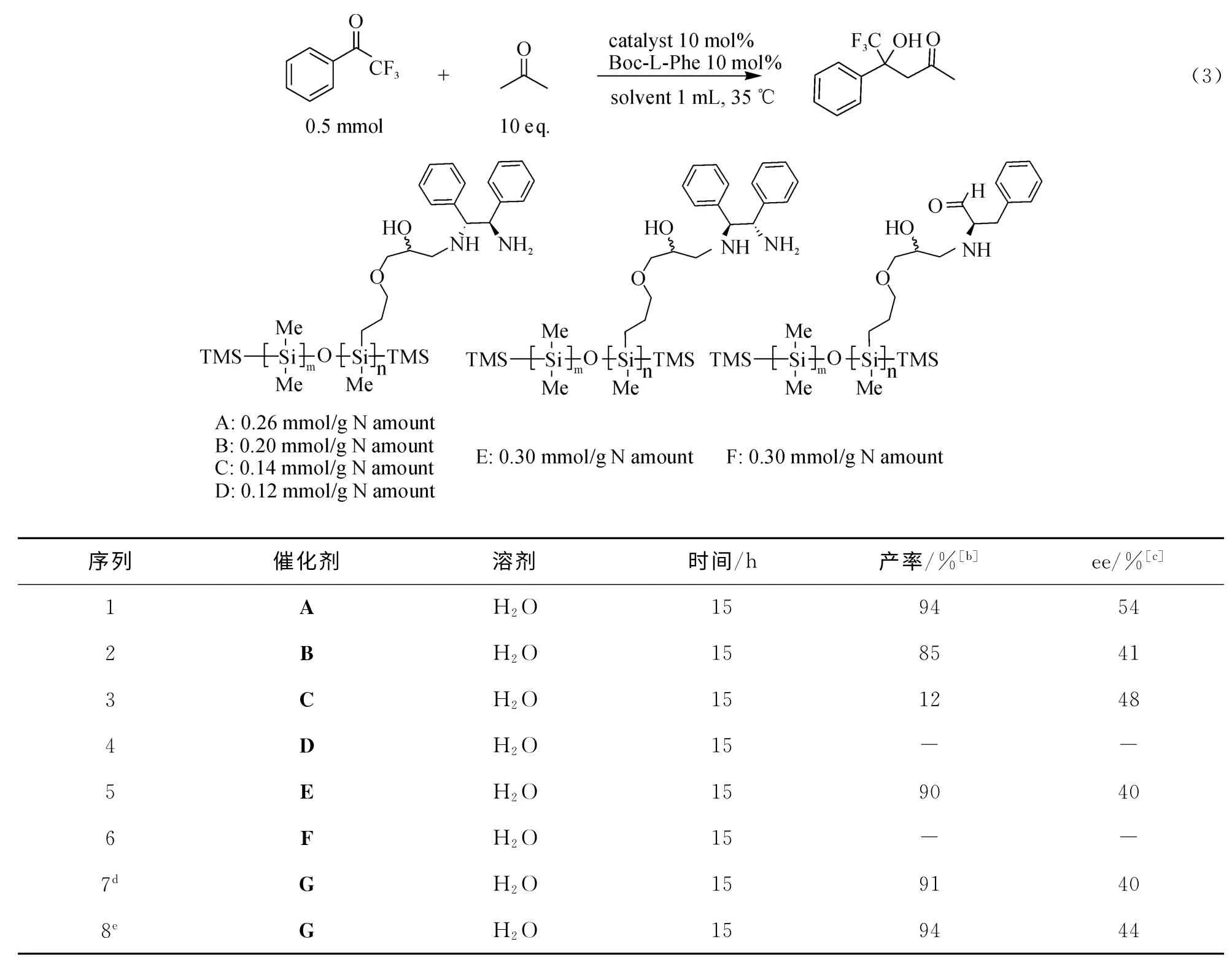
表2 不同催化剂催化下三氟甲基苯乙酮与丙酮反应的结果Tab.2 Evaluation of the asymmetric aldol reaction ofα,α,α-trifluoroacetophenone and acetone by different catalyst A and Boc-L-phenylalanine in water
基于上述最优反应条件,考察了溶剂对三氟苯乙酮与丙酮的不对称aldol反应的影响.由表3可知,在DMSO 中反应不发生;在甲醇、乙醇、四氢呋喃、DMF 和乙酸乙酯中反应的产率和对映选择性均较低,产率分别为10%、35%、4%、9%和10%,ee值分别为11%、22%、10%、4%和16%;在三氟乙醇、二氯甲烷、甲苯和三氟甲苯中产率和对映选择性中等,产率分别为48%、40%、78%和42%,ee值分别为39%、46%、37%和44%;在水、氯化钠水溶液和三氟甲苯与水的混合溶剂(v∶v=1∶1)中具有优异的产率和中等的对映选择性,产率达到94%,ee值达到54%.

表3 溶剂对三氟甲基苯乙酮与丙酮不对称aldol反应的影响Tab.3 Evaluation of the asymmetric aldol reaction ofα,α,α-trifluoroaceto-phenone and acetone by catalyst A and Boc-L-phenylalanine in different solvents
3 结 论
利用环氧硅油合成了一种含有惰性长链的手性伯胺催化剂,并成功应用于三氟苯乙酮与丙酮的反应中.通过考察酸、催化剂以及溶剂对于α,α,α-三氟苯乙酮和丙酮的不对称aldol反应的影响,最终确立出通过使用催化剂A(10mol%)和Boc-L-苯丙氨酸(10mol%)协同催化该不对称aldol反应制备含氟季碳手性中心的叔醇具有高产率和中等的对映选择性,为制备高立体选择性含氟的季碳手性中心的叔醇提供了一种新的思路.
[1]Perlmutter P.Conjugate Addition Reactions in Organic Synthesis[M].Pergamon:Oxford,1992.
[2]Bergmann E D,Ginsburg D,Pappo R.The Michael Reaction[J].Org Reactions,1959,10:179.
[3]Rossiter B E,Swingle N M.Asymmetric conjugate addition[J].Chem Rev,1992,92(5):771-806.
[4]Bach T.Katalytische varianten enantioselektiver C-C-verknüpfungen:allylübertragung und Mukaiyama-aldol reaktion[J].Angew Chem,1994,106(4):433-435.
[5]Bach T.Catalytic Enantioselective C-C coupling-allyl transfer and mukaiyama Aldol reaction[J].Angew Chem Int Ed Engl,1994,33(4):417-419.
[6]Shibasaki M,Gröger H,Vogl E M.New catalytic concepts for the asymmetric aldol reaction[J].Chem Eur J,1998,4(7):1137-1141.
[7]Nelson S G.Catalyzed enantioselective aldol additions of latent enolate equivalents[J].Tetrahedron:Asymmetry,1998,9(3):357-389.
[8]Machajewski T D,Wong C H.The catalytic asymmetric aldol reaction[J].Angew Chem Int Ed,2000,39(8):1352-1375.
[9]Guillena G,Najera C,Ramon D J.Enantioselective direct aldol reaction:the blossoming of modern organocatalysis[J].Tetrahedron Asymmetry,2007,18(19):2249-2293.
[10]Bella M,Gasperi T.Organocatalytic formation of quaternary stereocenters[J].Synthesis,2009(10):1583-1614.
[11]Adachi S,Harada T.Catalytic enantioselective aldol additions to ketones[J].European Journal of Organic Chemistry,2009(22):3661-3671.
[12]Hayashi Y,Sekizawa H,Yamaguchi J,etal.Organocatalyst-mediated enantioselective intramolecular aldol reaction featuring the rare combination of aldehyde as nucleophile and ketone as electrophile[J].J Org Chem,2007,72(17):6493-6499.
[13]Itoh T,Ishikawa H,Hayashi Y.Asymmetric aldol reaction of acetaldehyde and isatin derivatives for the total syntheses of ent-convolutamydine E and CPC-1and a half fragment of madindoline A and B[J].Org Lett,2009,11(17):3854-3857.
[14]Chen W B,Du X L,Cun L F,etal.Highly enantioselective aldol reaction of acetaldehyde and isatins only with 4-hydroxydiarylprolinol as catalyst:concise stereoselective synthesis of(R)-convolutamydines B and E,(-)-donaxaridine and(R)-chimonamidine[J].Tetrahedron,2010,66(7):1441-1446.
[15]Jiang Z Q,Lu Y X.Direct asymmetric aldol reaction of acetone withα-ketoesters catalyzed by primary–tertiary diamine organocatalysts[J].Tetrahedron Lett,2010,51(14):1884-1886.
[16]Qiu L H,Shen Z X,Shi C Q,etal.Proline catalyzed asymmetric aldol reaction between methyl ketones and 1-Aryl-2,2,2-trifluoroethanones[J].Chin J Chem,2005,23(5):584-588.
[17]Wang X J,Zhao Y,Liu J T.Regiospecific organocatalytic asymmetric aldol reaction of methyl ketones andα,β-unsaturated trifluoromethyl ketones[J].Org Lett,2007,9(7):1343-1345.
[18]Zhang D H,Yuan C Y.An enantioselective nucleophilic addition ofα,β-unsaturated trifluoromethylketones catalyzed by L-proline derivatives[J].Tetrahedron,2008,64(10):2480-2488.
[19]Hara N,Tamura R,Funahashi Y.N-(Heteroarenesulfonyl)-prolinamides-catalyzed aldol reaction between acetone and aryl trihalomethyl ketones[J].Org Lett,2011,13(7):1662-1665.
[20]Duangdee N,Harnying W,Rulli G,etal.Highly enantioselective organocatalytic trifluoromethyl carbinol synthesis:a caveat on reaction times and product isolation[J].J Am Chem Soc,2012,134(27):11196-11205.
[21]Kokotos C G.Construction of tertiary alcohols bearing perfluoroalkyl chains catalyzed by prolinamide-thioureas[J].J Org Chem,2012,77(2):1131-1135.
[22]DeClue M S,Siegel J S.Polysiloxane-bound ligand accelerated catalysis:a modular approach to heterogeneous and homogeneous macromolecular asymmetric dihydroxylation ligands[J].Org Biomol Chem,2004,2(16):2287-2298.
[23]Grunlan M A,Regan K R,Bergbreiter D E.Liquid/liquid separation of polysiloxane-supported catalysts[J].Chem Commun,2006(16):1715-1717.
[24]Xu L W,Ju Y D,Li L,etal.Homogeneous silicone modified primary amine-Brφnsted acid salt catalyzed aldol reaction:unexpected synergistic effect of polysiloxane with remarkable improvement of efficiency and stereoselectivity[J].Tetrahedron Lett,2008,49(49):7037-7041.
[25]Khaksar S,Heydari A,Tajbakhsh M,etal.A facile and efficient synthesis ofβ-amino alcohols using 2,2,2-trifluoroethanol as a metal-free and reusable medium[J].Journal of Fluorine Chemistry,2010,131(1):106-110.

