响应面法优化纤维堆囊菌SoF5-76产埃博霉素B发酵培养基
响应面法优化纤维堆囊菌SoF5-76产埃博霉素B发酵培养基
龚国利 王娜 刘丽丽
(陕西科技大学 生命科学与工程学院,西安 710021)
以纤维堆囊菌SOF5-76为试验菌株,用响应面分析法对其产埃博霉素B的培养基进行优化,以提高埃博霉素B的产量。在单因素试验的基础上,利用Plackett-Burman筛选出对埃博霉素B产量有显著影响的3个因素为马铃薯淀粉、脱脂奶粉和无水氯化钙,在此基础上通过最陡爬坡试验逼近最佳响应面区域;再运用Box-Behnken试验设计和响应面分析法进行回归分析,确定重要因素的最优浓度。得到最佳发酵培养基为:马铃薯淀粉3.9 g/L、脱脂奶粉2.2 g/L、无水氯化钙1.3 g/L、葡萄糖1 g/L,豆饼粉1.5 g/L,七水硫酸镁2.5 g/L,EDTA-Fe3+3 mL/L,微量元素(TE)0.5 mL/L,VB121 mL/L。在此最优条件下发酵埃博霉素B的产量为29.95 mg/L,与模型预测值接近,发酵产量比优化前提高了1.1倍。
埃博霉素B 纤维堆囊菌 发酵培养基 响应面法优化
埃博霉素(Epothilones)是黏细菌纤维堆囊菌产生的大环内酯类次级代谢产物[1],是一种新型的抗肿瘤药物。其作用机制与紫杉醇相同,通过促微管聚合作用从而抑制肿瘤细胞的增殖[2],并且与紫杉醇相比,埃博霉素具有毒性更小、水溶性更好[3]、对紫杉醇耐药性细胞作用更强、抗肿瘤谱更广等优点,因此埃博霉素被誉为最具有潜力的抗肿瘤新药之一[4-6]。
目前有很多种化学法可以合成埃博霉素B,但是反应条件苛刻,成本高,合成路线长,产率低,污染环境,而发酵法则可以克服上述缺点。为了实现埃博霉素的大规模生产,生物发酵是理想的途径。但是目前该法产量低,不稳定,受培养条件和环境等因素的影响较大,所以在发酵生产过程中,主要通过菌种选育和优化发酵工艺条件来提高埃博霉素的产量。
本研究以纤维堆囊菌SOF5-76为试验菌株,该菌株是由本实验室从土壤中筛选,经基因重组技术选育获得的遗传稳定的高产菌株之一,经过为期1年的观察,此菌株产量较其他菌株(SoF5-09)稳定,埃博霉素产量不稳定是其研究的一大难题。虽然实验室前期已采用正交法研究了另一高产菌株SoF5-09的发酵工艺[7,8],分别对埃博霉素B的发酵培养基和培养条件进行优化,使埃博霉素产量分别达到27.5 mg/L、33.5 mg/L。由于菌株的特异性,且试验菌株稳定性较好,因此对其发酵合成埃博霉素B的营养条件进行优化具有一定的意义。诸景光等[6]曾采用响应面法对埃博霉素发酵工艺进行优化,筛选出的重要因素皆为培养条件相关的因素,不能实现对营养条件系统优化的目的。本研究则着重考虑营养条件对埃博霉素产量的影响,对其进行系统的优化。目前,统计学试验设计已经成功应用于一些培养基组分和培养条件的优化[9-13],本研究采用统计学试验设计对纤维堆囊菌发酵培养基进行系统的优化,旨在提高埃博霉素B产量,且为其规模化生产奠定试验基础。
1 材料与方法
1.1 材料
1.1.1 菌种 纤维堆囊菌SoF5-76(Sorangium cellulosumSoF5-76)由本实验室从土壤中筛选,经过基因组重组技术选育获得,埃博霉素B产量为14.2 mg/L[14]。
1.1.2 培养基 CNST培养基:KNO30.05%,Na2HPO40.025%,MgSO47H2O 0.1%,FeCl30.001%,琼脂 2%,微量元素液 1 mL/L,pH7.2。1×105Pa高压蒸汽灭菌20 min。
M26培养基:土豆淀粉8.0 g/L,大豆蛋白胨2.0 g/L,葡萄糖2.0 g/L,酵母粉2.0 g/L,MgSO4·7H2O 1.0 g/L,CaCl21.0 g/L,EDTA-Fe3+1 mL/L,微量元素1 mL/L,以KOH调节pH值为 7.2。
初始发酵培养基:糊精0.3%,蔗糖0.07%,葡萄糖0.02%,豆饼粉0.17%,七水硫酸镁0.17%,无水氯化钙0.3%,EDTA-Fe3+2 mL/L,微量元素(TE)0.5 mL/L,pH7.2,树脂XAD-16 2%。1×105Pa高压蒸汽灭菌20 min[13]。
1.1.3 试剂 EPothilone B标准品购于Singma公司;XAD-16树脂购于德国Sigma公司;马铃薯淀粉、脱脂奶粉、豆饼粉为食品级,市场购买,其余试剂均为分析纯。
1.1.4 仪器 Waters-2487-2420-1525高效液相色谱
仪,美国waters公司。
1.2 方法
1.2.1 培养方法 种子培养:将保藏在固体斜面培养基的菌种接入放有已灭菌滤纸片的CNST平板上,倒置于恒温培养箱中在30℃条件下培养5-7 d后,转接于 M26培养基中,装液量为50 mL/250 mL三角瓶,在30℃、170 r/min的条件下摇床培养72 h后,得到作为发酵培养的种子液。
发酵培养:以5%(V/V)接种量将所得种子液接种到发酵培养基中进行摇床培养,发酵体系为300 mL三角瓶装液量为50 mL,在30℃、170 r/min的条件下摇床培养5 d。
1.2.2 埃博霉素B提取及含量测定 埃博霉素B提取:发酵结束后,过滤收集树脂,用10倍体积甲醇振荡浸提24 h后,弃去树脂,甲醇浸提液放入真空干燥箱中烘干,再加入500 μL甲醇复溶,转移到离心管中。
埃博霉素B检测:采用HPLC定量分析。液相色谱条件:色谱柱:YWG,C18,10 μm,250×4.6 mm;Waters-2487高效液相色谱仪;UV紫外检测器;检测波长:249 nm,流动相:甲醇∶水=65∶35(体积比);上样体积:20 μL,时间:30 min,流速:1 mL/min。埃博霉素B的定量采用本实验室用的标准曲线。方程为:y=0.132x+0.0035。
采用HPLC检测埃博霉素B所得的峰面积,根据标准曲线换算成埃博霉素B产量。
1.2.3 Plackett-Burman设计 Plackett-Burman设计用来确定对埃博霉素B产量有显著影响作用的因子以及去除一些可有可无的因子。每个因子设置高低两个水平,分别用“+”、“-“表示,设定高水平为低水平的2倍。根据前期单因子试验的结果,影响埃博霉素B产量的因素有单因子试验初步确定的最佳碳源(马铃薯淀粉、葡萄糖)、氮源(豆饼粉、脱脂奶粉、乙酸铵)、生长因子VB12、无机盐(七水
硫酸镁、无水氯化钙)铁离子(EDTA-Fe3+)。 选用N=12的Plackett-Burman设计,考察上述9个因素对埃博霉素B产量影响的重要性。
1.2.4 最陡爬坡试验 由于响应面拟合多项式模型只有在考察的紧接邻域里才充分近似真实情形,所以应先使得显著因素的水平尽量逼近最佳区域再建立有效的拟合方程,最陡爬坡试验可以实现。根据Plackett-Burman试验结果,对筛选出的显著因素的变化方向、步长作了相应的设计。
1.2.5 Box-Behnken试验 逼近最大响应区域后,应用Box-Behnken设计对显著因子进行优化,寻找菌种发酵使得EpoB产量达到最大的最优条件。根据最陡爬坡试验结果,确定显著因子的高、中、低水平,表征为1、0、-1,使用SAS9.2软件试验设计及响应面分析。
2 结果
2.1 Plackett-Burman设计筛选重要影响因素
自变量编码和水平因素见表1,Plackett-Burman试验设计结果见表2。使用SAS9.2软件对试验结果进行回归分析得到了回归方程以及各影响因子的显著性(表3)。由表3可知,马铃薯淀粉(A)、脱脂奶粉(D)和无水氯化钙(G)为影响埃博霉素B产量的显著因素,除了确定这3个重要影响因子之外,还据此对初始发酵培养基做出相应的改变和调整,氮源中由于乙酸铵对埃博霉素B 产量的影响甚小,故在后续试验发酵培养基去掉这一成分,其余不显著的变量的取值结合效应的正负和节约正本的原则,进行调整。
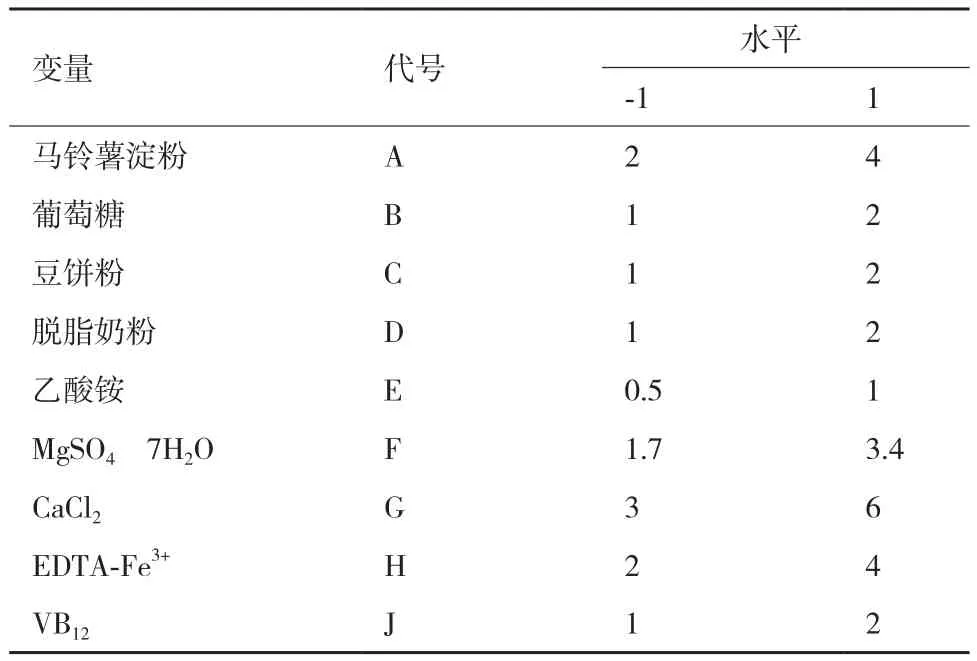
表1 Plackett-Burman试验设计水平及编码
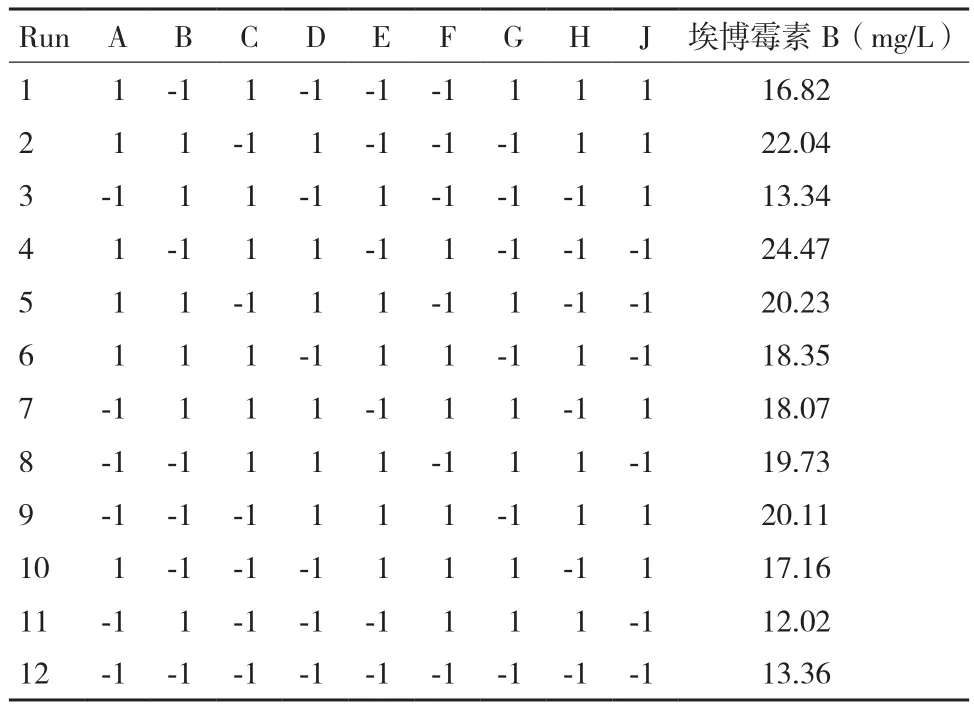
表2 Plackett-Burman试验设计结果及响应值
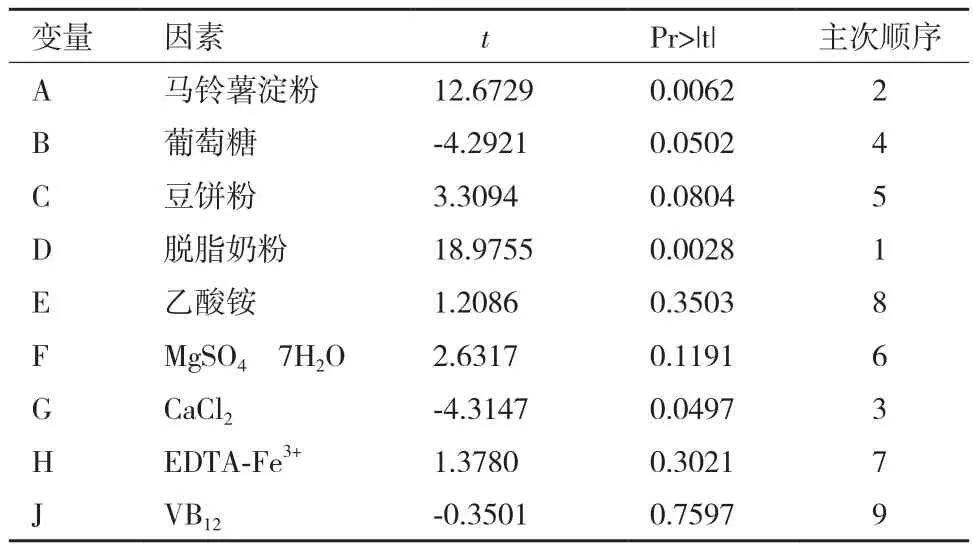
表3 Plackett-Burman试验中各因素的效应分析
2.2 最陡爬坡试验
根据Plackett-Burman试验分析的结果,结合试验的实际需要,在最陡爬坡试验中对埃博霉素B产量影响显著的因素的变化方向、步长作了相应的设计,具体取值和试验结果见表4。由表4可知,埃博霉素B产量的变化趋势是先上升后下降,其中从中心点开始到3Δ之间都显著增加,在0+3Δ水平上达到最大值,3Δ以后埃博霉素B产量开始下降,
由此判断出最佳发酵条件在0+3Δ水平附近,故以0+3Δ水平为后续试验的中心点。

表4 最陡爬坡试验设计与结果
2.3 Box-Behnken试验设计及响应面分析
2.3.1 二次回归模型拟合及方差分析 以马铃薯淀粉、脱脂奶粉和氯化钙3个重要因素为自变量,以埃博霉素B产量为响应值。各因素编码水平见表5,试验设计及结果见表6。

表5 Box-Behnken试验因素水平及编码
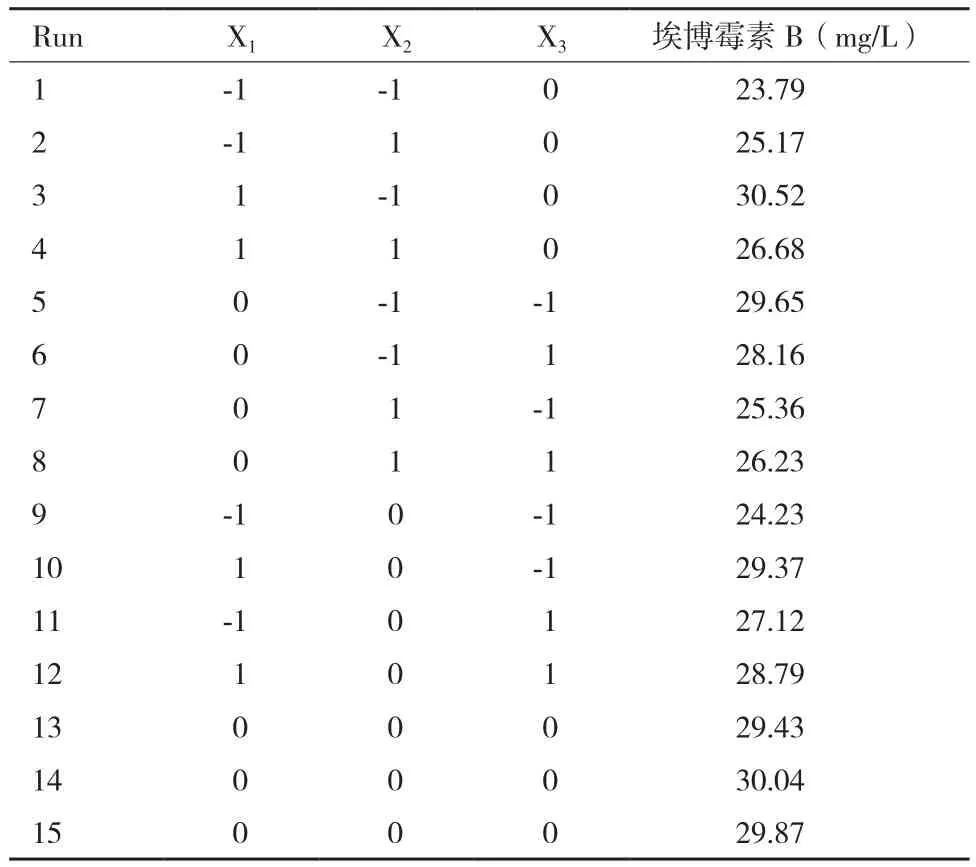
表6 Box-Behnken试验设计及结果
根据表6中试验结果,利用SAS软件对结果进行二次回归分析,获得的回归方程为:
Y=29.78+1.88125X1-1.085X2+0.21125X3-1.6 0 6 2 5 X1X1-1.3 0 5 X1X2-0.8 6 7 5 X1X3-1.63375X2X2+0.59X2X3-0.79625X3X3
对该模型进行方差分析,结果见表7,模型系数显著性检验见表8。
从表7中可以看出模型在α=0.01水平上回归显著(Pr>F小于0.01);失拟项(P=0.0889>0.05),失拟项不显著,因此模型选择正确,复相关系数的平方R2=0.9541,说明模型可以解释95.41%试验所得埃博霉素B产量的变化,表明方程拟合较好,试验结果和预测值之间具有较好的一致性。Y的变异系数CV表示试验的精确度,CV值越高,试验的可靠性越低,本试验中CV值相对较低,说明了试验操作可靠。

表7 回归方程的方差分析

表8 回归系数的t值检验
回归方程的回归系数显著性检验表明,模型一次项X1极显著,X2显著;二次项X1X1、X1X2、X2X2对响应值有显著的影响,且X1(土豆淀粉)X2(脱脂奶粉)有交互作用,交互作用显著,说明土豆淀粉、脱脂奶粉是该发酵过程的重要影响因素。
2.3.2 响应面分析及最佳培养基成分确定 利用SAS软件根据回归方程进行响应面分析,绘制响应面分析图及其等高线图,结果见图1-3,考察所拟合的响应曲面的形状,每个响应面分析图分别代表着两个独立变量之间的相互作用,此时第3个变量保持在中心点水平不变。从其等高线图可以直观看出两因素的交互作用,等高线的形状反映出交互作用效应的强弱,圆形表示两因素交互作用不显著,等高线形状越接近椭圆形表示交互作用越强。
回归方程存在稳定点,即存在极值点(X1,X2,X3)使得响应变量Y取得最大值。通过岭脊分析(ridge analysis)得到极大值所对应的各主要因素(X1,X2,
X3)的编码值分别为(0.747817,-0.57091,-0.33886),即马铃薯淀粉、脱脂奶粉、无水氯化钙的最佳浓度为3.8739 g/L、2.2145 g/L、1.3306 g/L,此时埃博霉素B产量达到最高为31.1036 mg/L。

图1 Y= f(X1,X2)响应面立体分析图

图2 Y= f(X1,X3)响应面立体分析图
图3 Y= f(X2,X3)响应面立体分析图
2.4 模型的验证
在以上确定的最优条件下进行3次平行验证试验,同时将优化前培养基作为对照。优化培养基埃博霉素B的平均产量为29.95 mg/L,预测结果31.1036与验证试验平均值十分接近,说明了试验值和预测值之间具有良好的拟合性,模型的有效性,同时与初始发酵培养基产生的埃博霉素B(14.2 mg/L)相比产量提高了1.1倍。
3 讨论
目前已有一些关于埃博霉素发酵合成的报道。韩莉莉等[3]采用单因子法研究培养基组成对埃博霉素产量的影响,使埃博霉素B产量达到7 mg/L左右,比原始条件提高了2.88倍;本实验室前期通过正交实验优化纤维堆囊菌SoF5-09产埃博霉素B发酵培养基,埃博霉素B产量为27.5 mg/L,提高了74%[7];诸景光等[6]采用响应面法优化埃博霉素的发酵条件,埃博霉素产量为14.12 mg/L,提高了18%。曹文瑞等[15]通过多步骤响应面法优化So0157-2合成埃博霉素营养条件,使埃博霉素B产量达到82 mg/L,比优化前提高了7.2倍,充分表明了响应面法优化纤维堆囊菌野生菌合成埃博霉素营养条件的有效可行性。国外则更多的关注埃博霉素合成基因的易源表达及其临床研究,关于发酵工艺方面报道较少。Lau等[16]采用半连续发酵法以及添加吸附树脂等方法试图提高异源菌株合成埃博霉素产量;Regentin等[4]对比了本源菌和异源宿主发酵合成埃博霉素过程中对铵离子、磷酸盐以及铁离子的耐受程度。然而埃博霉素产量的不稳定性及产量有待进一步提高的问题仍是目前备受关注的焦点。由于纤维堆囊菌易受外界环境条件的影响,且表现出明显的菌株特异性,为了提高纤维堆囊菌SoF5-76发酵产埃博霉素B的水平以降低生产成本,本研究从营养条件着手,在单因素试验的基础上通过Plackett-Burman设计从可能影响埃博霉素B产量的9个因素中筛选出3个显著因素,并通过响应面法对其水平进行了优化,最终得到纤维堆囊菌SoF5-76的最佳发酵培养基。在此最优条件下,埃博霉素B产量(29.95mg/L)比优化前(14.2 mg/L)提高了1.1倍。横向比较,本试验优化水平还有提高的空间,且本试验菌株的产量较稳定。得到的优化培养基相比初始培养基增加了VB12和脱脂奶粉两个成分。VB12作为生长因子有利于菌体的生长,上述试验表明脱脂奶粉是影响埃博霉素B产量的重要因素,这可能是
因为脱脂奶粉含有一些有利于菌体生长或埃博霉素B产生的氨基酸类,氨基酸可以提供大环内酯类抗生素生物合成过程中所需要的前体物质。据文献报道[17],前体氨基酸能促进大环内酯类抗生素合成,但是没有有关埃博霉素的报道,后续工作将基于埃博霉素B的生物合成途径对埃博霉素B的发酵工艺进一步优化,预期将获得更高的发酵水平。
4 结论
对埃博霉素产量有显著影响的3个因素为马铃薯淀粉、脱脂奶粉和无水氯化钙;在此最优条件下,埃博霉素B产量可达到29.95 mg/L,发酵产量比优化前提高了1.1倍。用响应面法优化纤维堆囊菌产埃博霉素B的发酵培养基是有效可行的。
[1] Meng FX, Li YX, Guo WL, et al. Optimization of fermentation medium for Epothilones production with sequential statistical approach[J]. Chemical Research in Chinese Universities, 2010, 26(1):86-91.
[2] 罗立新, 汪薇, 陆一鸣, 等. 纤维堆囊菌发酵产生epothilone条件的优化[J]. 华南理工大学学报:自然科学版, 2006, 34(5):48-52.
[3] 韩莉莉, 卢育新, 王赫, 等. 培养基组成对纤维堆壤菌产epothilone的影响[J]. 微生物学杂志, 2008, 28(6):103-106.
[4] Regentin R, Frykman S, Lau J, et al. Nutrient regulation of epothilone biosynthesis in heterologous and native production strains[J]. Applied Microbiology and Biotechnology, 2003(61):451-455.
[5] 李越中, Gerth K, Reichenbach H. 纤维堆囊菌Soce 90菌株发酵合成新型抗癌物质epothilone的营养控制[J]. 中国抗生素杂志, 1998, 23(6):420-424.
[6] 诸景光, 罗立新. 基于响应面法的Epothilone发酵优化[J].现代食品科技, 2009, 25(7):771-774.
[7] 龚国利, 陈松, 李慧, 等. 纤维堆囊菌产埃博霉素B发酵培养基的优化[J]. 中国酿造, 2012, 31(10):30-42.
[8] 龚国利, 陈松, 王娜, 等. 埃博霉素B高产菌株的诱变育种及其发酵条件的优化[J]. 中国酿造, 2012, 31(12):33-36.
[9] Xu YX, Li YL, Xu SC, et al. Improvement of xylanase production by Aspergillus niger XY-1 using response surface methodology for optimizing the medium composition[J]. Journal of Zhejiang University Science B, 2008, 9(7):558-566.
[10] Ye D, Xu ZN, Cen PL. Medium optimization for enhanced production of cytosine-substituted mildiomycin analogue(MIL-C)by Streptoverticillium rimofaciens ZJU 5119[J]. Journal of Zhejiang University Science B, 2008, 9(1):77-84.
[11] Li PQ, Xu L, Mou Y, et al. Medium optimization for exopolysaccharide production in liquid culture of endophytic fungus Berkleasmium sp. Dzf12[J]. International Journal of Molecular Sciences, 2012(13):11411-11426.
[12] Puri M, Kaur A, Singh RS, et al. Response surface optimization of medium components for Naringinase production from Staphylococcus xylosus MAK2[J]. Applied Biochemisty and Biotechnology, 2010(162):181-191.
[13] Zhang YJ, Li Q, Zhang YX, et al. Optimization of succinic acid fermentation with Actinobacillus succinogenes by response surface methodology(RSM)[J]. Journal of Zhejiang University Science B(Biomed & Biotechnol), 2012, 13(2):103-110.
[14] 龚国利, 陈松, 李慧, 等. 基因重组技术选育埃博霉素B高产菌株[J]. 中国抗生素杂志, 2013, 38(2):106-110.
[15] Cao WR, Gong GL, Liu XL, et al. Optimization of epothilone B production by Sorangium cellulosum using multiple steps of the response surface methodology[J]. African Journal of Biotechnology, 2011, 10(53):11058-11070.
[16] Lau J, Frykman S, Regentin R, et al. Optimizing the heterologous Production of epothilone D in Myxococcus xanthus[J]. Biotechnol Bioeng., 2002, 78:281-288.
[17] 胡景, 储炬, 谌颉, 等. 前体氨基酸对avermectin 生物合成的影响[J].中国抗生素杂志, 2004, 29(7):388-390.
Medium Optimization for Enhanced Production of Epothilone B by Sorangium cellulosum SoF5-76 Using Response Surface Methodology
Gong Guoli Wang Na Liu Lili
(College of Life Science and Engineering,Shaanxi University of Science and Technology,Xi’an 710021)
The response surface methodology(RSM)was employed to optimize the medium composition for Epothilone B produced by Sorangium cellulosum SoF5-76. On the basis of one-variable-at-a-time design, using Plackett-Burman design, potato starch, skimmed milk powder and calcium chloride were screened out of 9 factors as main affecting variables of Epothilone B production, and then steepest ascent method was used to approach their maximum response regions, followed by Box-Behnken design, multiple regression analysis and response surface analysis. The optimum medium formula determined was composed of potato starch 3.9 g/L, skim milk powder 2.2 g /L, chlorine calcium 1.3 g/L, glucose 1 g/L, soybean powder 1.5 g/L, magnesium sulfate 2.5 g/L, EDTA-Fe3+3 mL/L, trace elements 0.5 mL/L, VB121 mL/L. Under this optimal conditions, Epothilone B production reached up to 29.95 mg/L and increased 1.1 times in average as compared with preliminary culture and consistent with the maxmum predicted value.
Epothilone B Sorangium cellulosum Fermentation medium Response surface methodology optimization
2013-08-15
陕西省教育厅自然科学专项(12JK1023),国家自然科学基金项目(20906058)
龚国利,男,副教授,硕士生导师,研究方向:生物制药技术;E-mail:gongguoli@sust.edu.cn

