水稻白叶枯病抗性基因Xa21的分子生物学研究进展
水稻白叶枯病抗性基因Xa21的分子生物学研究进展
陈小林 颜群 高利军 高汉亮
(广西作物病虫害生物学重点实验室 广西农业科学院植物保护研究所,南宁 530007)
由黄单胞杆菌水稻致病变种Xanthomonas oryzae pv. oryzae(Xoo)引起的白叶枯病是水稻重要细菌性病害之一。迄今,已有7个水稻白叶枯病抗性基因被克隆。Xa21是第一个被克隆的白叶枯病抗性基因,因具有广谱抗性而受到广泛的关注。对Xa21的发现、定位及克隆、表达特征、编码产物XA21的生化特性、作用与调控以及XA21介导的免疫反应模式等方面的研究结果进行综述,并对今后的研究方向进行展望。
水稻 白叶枯病 抗性基因 Xa21
由黄单胞杆菌水稻致病变种(Xanthomonas oryzaepv.oryzae,Xoo)引起的水稻白叶枯病是水稻最严重的细菌性病害之一[1,2]。受白叶枯病危害的田块一般减产10%-20%,严重的减产50%以上,甚至绝收[3]。白叶枯病1909年首次在日本福冈地区出现,随后在亚洲各国以及非洲、美洲和澳洲等地的水稻产区被发现,已成为一种世界性的水稻病害[4]。目前,我国除了新疆、西藏和东北北部以外,其余各稻区均有发生,尤其在南方稻区危害更为严重[3]。抗性基因的研究一直以来都是水稻白叶枯病防治的重要内容之一,并且已取得较大的成果。到目前为止,经注册确认的和期刊报道的水稻白叶枯病抗性基因共38个,其中,Xa1、xa5、xa13,Xa21、Xa23、Xa26和Xa27等7个基因已成功被克隆[5-11]。Xa21是第一个被克隆出来的水稻白叶枯病抗性基因,因其广谱的抗性而受到广泛的关注。
1 Xa21的发现、定位及克隆
Khush等[12]发现西非长药野生稻(Oryza longistaminata)在分蘖后期抗当时菲律宾的全部6个小种。随后经杂交将其导入感病籼稻品种IR24,通过回交、杂交获得BC4F2群体,分析其中两个F2群体对菲律宾小种的抗性遗传,表明其广谱抗性由
一对显性基因控制,为区别于已鉴定的抗性基因,命名为Xa21。后来进一步育成以IR24为遗传背景携有Xa21的近等基因系IRBB21。
随着分子生物学技术的不断发展和完善,各种DNA分子标记技术包括RFLP、RAPD、SSR等相继出现,为基因的定位、克隆打下了坚实的基础。Xa21基因发现后,许多科研工作者纷纷开展其分子标记定位工作。Ronald等[13]首先利用123个DNA标记和985条随机引物对含有Xa21的近等基因系进行RFLP和RAPD分析发现,位于第11号染色体的标记RG103和引物RAPD248、RAPD818与Xa21共分离,从而将Xa21定位在第11号染色体上;进一步的遗传作图表明,3个DNA标记与Xa21的遗传距离均不超过1.2 cM。随后,Song等[8]以RG103作为杂交探针从IRBB21的细菌人工染色体(BAC)和柯斯质粒(cosmid)文库中筛选出7个亚克隆,将亚克隆通过基因枪法导入到感病水稻品种TP309,获得转化植株。对转化植株进行Xoo接种试验,最后从1 500株转化植株中筛选出50株转化植株具有白叶枯病抗性,这50株转化植株均携带有9.6 kb的KpnI亚克隆片段。进一步的试验发现,9.6 kb的KpnI基因组片段包含一个2.3 kb的HindIII DNA片段是水稻白叶枯病抗性所必需的。序列分析表明,9.6 kb的KpI片段包含一个3 075 bp的ORF以及一个843 bp的内含子,即Xa21基因。
Xa21是水稻第11号染色体上多基因家族的一个成员,该家族包含至少8个成员[8,13]。随后Song等又从水稻中克隆了6个Xa21基因家族成员,并将7个已克隆成员分别命名为A1、A2、B(Xa21)、C、D、E和F[8,14,15]。
2 Xa21分子生物学特性
2.1 Xa21的表达特征
许多水稻品系对病原菌的抗病反应受水稻发育时期控制[16-19]。Century等[20]发现,Xa21介导的抗性强弱与水稻不同发育时期有关,从幼苗易受感染的2叶期开始至5叶期,Xa21抗性表现逐渐增强,5叶期达到完全抗性的75%(9-10叶期表现完全抗性);分析水稻不同发育时期Xa21的转录水平,结果发现Xa21在不同发育时期的转录水平无明显差异,且不依赖于Xoo侵染或创伤,因此推测Xa21介导的抗病反应调控在转录后水平。而Zhao等[21]研究却发现,Xa21转录在水稻2叶期处于低水平,随发育时期逐渐升高,在分蘖盛期达到最高水平,与Xa21介导的抗性表达结果一致,据此推测Xa21抗性表达与Xa21转录水平有关,与Century等的研究结果相矛盾。前者采用的是半定量RT-PCR,而后者采用的灵敏度更高的qRT-PCR,且采取分期种植,同时取样,降低环境因素的影响,结果更为可靠。
将带有自身启动子和玉米启动子Ubi的Xa21分别导入水稻品种Kitaake获得转化植株,检测转化植株接种Xoo后不同时间点Xa21的表达,结果表明,Xa21的表达受Xoo侵染或创伤诱导;Ubi启动子驱动的Xa21呈组成型过量表达;接种试验表明组成型过量表达Xa21可以克服水稻白叶枯病抗性受发育时期的控制,使其水稻在苗期即表现出较强的抗性[22]。
2.2 编码产物XA21的生化特性
Xa21编码产物XA21是一个由1 025个氨基酸组成的类受体蛋白激酶,包括几个重要部分:LRR,跨膜区,近膜区和胞内激酶结构域[8]。其结构特点前人已进行综述[23],在此不再赘述。
XA21的胞内结构域(XA21K)包含丝氨酸-苏氨酸激酶的所有保守氨基酸残基特征。体外试验表明,大肠杆菌中表达的XA21K融合蛋白能够自磷酸化;磷酸化氨基酸分析结果显示,只有丝氨酸和苏氨酸残基能发生磷酸化,说明XA21K是一类丝氨酸/苏氨酸蛋白激酶;XA21K在含有10 mmol/L锰离子的缓冲液中的活性是含有镁离子缓冲液的15倍以上;XA21对ATP的Km和Vmax分别是0.4 μm和8.4 nmol(mg·min);XA21K自磷酸化反应通过分子内机制来实现,并且发生在多个丝氨酸和苏氨酸残基。此外,将保守的Lys736残基置换成谷氨酸导致XA21的自磷酸化功能完全丧失[24,25]。
将野生型XA21和XA21K736E(Lys736置换成Glu736)分别导入水稻品种TP309中,通过免疫共沉淀将XA21和XA21K736E分别从转基因植株总蛋白中分离出来,进行自磷酸化检测,结果发现野生型XA21能发生自磷酸化,而XA21K736E不能发生自磷酸化,表明该位点的突变导致XA21激酶功能失
活,进一步的试验发现该位点的置换导致突变蛋白XA21K736E稳定性降低。磷酸化位点分析表明XA21近膜(JM)结构域的Ser686,Thr688及Ser689残基均能发生自磷酸化,3个位点同时被丙氨酸置换后导致突变后的蛋白XA21S686A/T688A/S689A稳定性降低。上述结果表明,水稻发育过程中XA21的Ser686,Thr688和Ser689自磷酸化功能对自身稳定性具有保护作用,减弱蛋白酶对XA21的水解作用[26]。
3 Xa21的抗病分子机理
早在20世纪40年代Flor[27]就提出了植物与病原菌互作的“基因对基因(Gene-for-gene)假说”。该假说的建立,为从分子生物学角度解释寄主抗性奠定了理论基础[27-29]。植物抗性基因与病原菌无毒基因产物之间互作而产生的抗性是植物抗病性的重要形式。植物模式识别受体(Pattern recognition receptors,PRRs)识别病原相关分子模式(Pathogen associated molecular patterns,PAMPs),激活体内信号途径,诱导防卫反应,限制病原物的入侵,这种PRRs对病原物的PAMPs识别引起的植物抗性,称为植物免疫[30-32]。
3.1 Ax21的鉴定
带有Xa21的水稻对白叶枯病菌的P6小种表现抗性[8,13],根据基因对基因假说,P6小种理论上应存在XA21专一性识别的无毒因子(avrXa21)。因此,自Xa21被克隆出来后,avrXa21的鉴定成为研究Xa21抗病分子机制的重要内容。先后从白叶枯病菌P6小种中克隆了8个对avrXa21活性必需的基因[33-35]。根据序列特征和功能,这些基因可分为3类:第一类是硫代谢相关基因,包括raxP、raxQ和raxST;第二类I型分泌系统基因(Type one secretion systems,TOSS),包括raxA、raxB和raxC;第三类双组分系统基因,包括raxH和raxR。根据影响avrXa21活性的基因产物的功能,推测avrXa21很可能是一个通过I型分泌系统分泌并且硫化的多肽。生物测定avrXa21活性试验进一步证明avrXa21通过I型而不是III型分泌系统分泌[36]。
Lee等[37]采用反向高效液相色谱法(RP-HPLC)从P6小种的上清培养物中分离并获得1种能够引起XA21介导的免疫反应的组分,将该组分通过液相质谱联用(LC-MS/MS)分析鉴定出8种对应于Xoo的蛋白质共15条多肽,其中2条多肽对应于PXO_03968的N端和C端肽段。分别构建8种蛋白质编码基因的P6突变体并进行接种试验,结果发现PXO_03968基因突变后,造成带有Xa21的水稻感病,最后确定PXO_03968基因编码avrXa21,并重新命名 为 Ax21(Activator of XA21-mediated immunity)。Ax21由194个氨基酸组成,其N端硫化的17肽(axYs22)是引起水稻白叶枯病抗性的活性多肽,是识别和结合XA21所必需的。
序列分析表明,Ax21同源序列存在于所有已测序的Xanthomonas菌株、苛养木杆菌(Xylella fastidiosa)、嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia) 中;axYS22多 肽 序 列 在 已 测 序Xanthomonas菌株中高度保守,从而确定了Ax21是病原相关分子模式,XA21是模式识别受体,同时也解释了XA21具有广谱抗性的原因[37]。
3.2 XA21的作用与调控
激酶包括精氨酸-天冬氨酸(RD)和非RD激酶。RD激酶带有一个保守的精氨酸残基位于具有催化性的天冬氨酸残基前面;而非RD激酶则缺少保守的精氨酸,取而代之的是半胱氨酸或甘氨酸。植物基因组分析显示水稻基因组存在328个编码非RD激酶的基因,这些激酶主要位于细胞表面[38],包括XA26,Pid2及XA21[8,39,40]。动植物细胞表面的模式识别受体(PRRs)通常都带有非RD激酶或与之相关,从而控制先天免疫信号传导的早期事件[38,41,42]。模式识别受体FLS2是一个非RD激酶,它通过与RD激酶BAK1互作从而启动拟南芥防御反应[41],暗示了XA21可能与RD激酶互作从而介导水稻免疫反应。
XA21家族成员XA21D,缺少跨膜区和激酶结构域,对Xoo的抗性与XA21的抗谱相同,但抗性水平下降。Xa21与Xa21D LRR核苷酸序列具有99%的一致性,暗示XA21的LRR决定了水稻对病原菌种的特异性识别[43]。XA21识别Ax21,从而激活下游的磷酸化反应[4]。有趣的是,XA21胞内激酶结构域保守的Lys736残基(XA21K736E)突变导致XA21激酶功能失活,但能表现出类似于XA21D
的抗性水平[25],表明XA21的激酶功能似乎不是介导先天免疫反应所必需的,暗示可能存在与XA21共同发挥功能的调节子。
此外,近膜区的Ser686/Thr688/Ser689残基突变导致XA21稳定性下降,抗性减弱[25],以及Thr705残基突变导致XA21不能自磷酸化[44]等,表明XA21-Ax21的结合通过近膜区的调控来激活非RD激酶结构域,引起XA21自磷酸化和激活下游蛋白,从而介导免疫反应信号传导。
XA21作用过程复杂,受到多基因的调控。目前,已报道的XA21结合蛋白有XB3[45]、XB10[46]、XB15[47]、XB24[48]和BiP3[49]。XB3具有E3泛素连接酶活性,是XA21苏氨酸-丝氨酸蛋白激酶的作用底物。当病原菌侵染时,XB3与XA21复合物的形成,促进了XB3的磷酸化,从而引起下游信号及抗病反应,是XA21介导的免疫反应的正调控因子[45]。具有ATP酶活性的XB24能够结合并促进XA21的自磷酸化。Xb24沉默植株增强XA21介导的免疫反应;反之,Xb24过表达植株则减弱XA21介导的免疫反应[48]。Xb10编码转录因子OsWRKY62,XB10与XA21结合,能够抑制病原菌诱导的防卫基因表达,从而负调控XA21介导的免疫反应[46,50]。XB15是一类PP2C蛋白磷酸酶,负调控细胞死亡和XA21介导的免疫反应[47]。此外,BiP3是一类内质网伴侣蛋白,过表达Bip3水稻植株导致XA21稳定性降低,蛋白酶裂解被抑制,XA21介导的免疫反应减弱[49]。
3.3 XA21介导的免疫反应模式
2010年,Park等[51]综合已有的研究结果提出了XA21介导的免疫反应模式:XA21多肽合成后经过内质网加工,然后运输到质膜后发挥功能。Ax21不存在时,ATP酶XB24结合于XA21的胞内近膜区,促使XA21特定丝氨酸/苏氨酸残基发生自磷酸化而处于失活状态;当Ax21识别并结合到XA21胞外LRR区域时,促使XA21从XB24/XA21蛋白复合体中解离出来,同时激活XA21的非RD激酶域。自磷酸化的Thr705 将磷酰基转移给XA21的另一个残基,从而激活了XA21。推测XA21可能将磷酰基团转移给XB3,从而激活下游的有丝分裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)级联反应,并将信号传递到核内WRKY转录因子,从而调控防御相关基因的表达。随后XB15结合到XA21胞内近膜区的Ser697位点,使XA21已磷酸化的氨基酸残基去磷酸化,从而减弱XA21介导的免疫反应(图1)。
最近的研究发现,XA21识别Ax21后,其胞内激酶结构域被剪切释放并定位转移到细胞核内,这一过程是引起XA21介导的免疫反应所必需的[39]。由于转录调节子OsWRKY62(XB10)负调控XA21介导的免疫反应[46],因此推测位于细胞核的XA21激酶结构域与转录调节子结合从而调控转录重新编程。双分子荧光互补(Bimolecular fluorescence complementation,BiFC)分析表明水稻原生质体细胞核内,XA21激酶结构域与转录调节子OsWRKY62在细胞核内确实存在直接的相互作用[52]。这些研究结果表明一种新的免疫受体作用模式:受体识别保守的微生物特征标签,相关激酶转移到细胞核内直接与转录调节子相互作用。
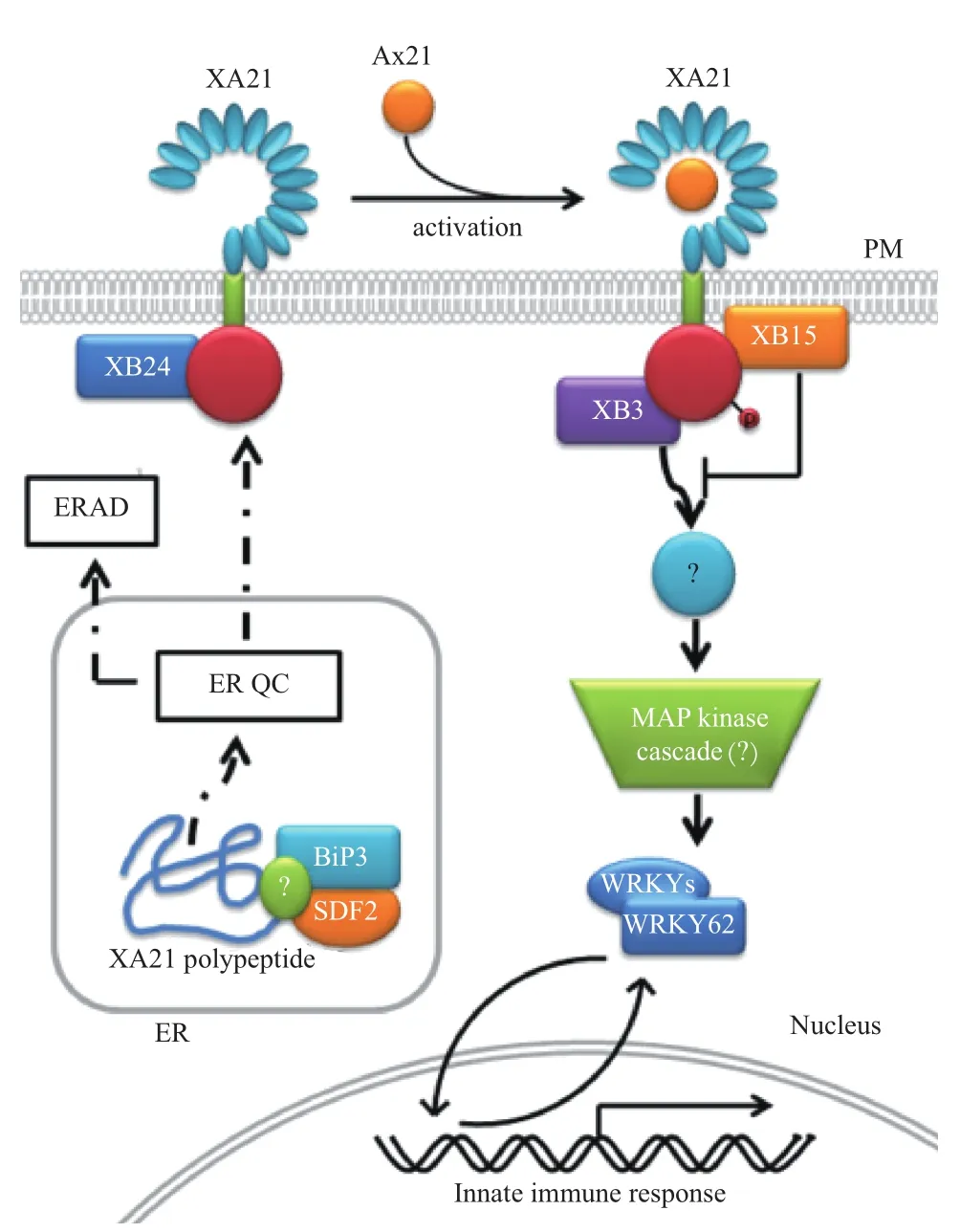
图1 XA21介导的免疫反应模型[50]
4 展望
Xa21是第一个被克隆的具有广谱抗性的水稻白叶枯病抗性基因,对其进行深入研究对植物抗病性理论的发展和水稻抗病育种应用均具有重要的指导意义。尽管人们早已认识植物对疾病的抗性反应是R基因与avr基因产物互作的结果,但是关于寄主与病原菌的信号识别、传递以及防御反应等复杂过程目前了解较少。研究XA21与Ax21之间的互作对于病原菌与寄主互作模型的建立、互作机理的认识具有十分重要意义。目前,对XA21的分子生物学特性和抗病分子机理等已有较为深入的了解,但还有很多问题未回答。例如,XA21对Xoo的抗性涉及信号通路,具体的调控网络仍需继续探索;除了已知的结合蛋白外,XA21是否还存在其他直接作用的靶标,数量有多少;XA21磷酸化是如何激活离子通道和NADPH氧化酶复合体等问题有待进一步研究。尽管Xa21能抗当时印度和菲律宾的所有小种[12],但是随着Xa21在抗病育种中的应用,单一抗源的水稻品种在局部地区产生了新的致病菌株,或者地区间不同水稻种质资源与不同病原菌小种的互作常表现出不同的抗性反应。例如,IRBB21对广东、广西及浙江等地的白叶枯病小种IV、V及VI均不抵抗[53-55],因此,IRBB21应慎用于当地的抗白叶枯病育种。聚合多个抗病基因或发掘新的广谱抗性基因应用于水稻育种具有重要的意义。此外,以高度保守的信号分子Ax21作为药物靶标应用于水稻白叶枯病防治是一个重要的研究方向。
[1] Huang X, Kurata N, Wei X, et al. A map of rice genome variation reveals the origin of cultivated rice[J]. Nature, 2012, 490(7421):497-501.
[2] Mew TW. Current status and future prospects of research on bacterial blight of rice[J]. Annu Rev Phytopathol, 1987, 25(1):359-382.
[3] 章琦. 水稻白叶枯病抗性的遗传与改良[M]. 北京:科学出版社, 2007:2.
[4] Ronald PC. The molecular basis of disease resistance in rice[J]. Plant Mol Biol, 1997, 35(1-2):179-186.
[5] Yoshimura S, Yamanouchi U, Katayose Y, et al. Expression of Xa1, a bacterial blight-resistance gene in rice, is induced by bacterial inoculation[J]. PNAS, 1998, 95:1663-1668.
[6] Iyer AS, McCouch SR. The rice bacterial blight resistance gene xa5 encodes a novel form of disease resistance[J]. Mol Plant Microbe Interact, 2004, 17:1348-1354.
[7] Chu Z, Ouyang Y, Zhang J, et al. Genome-wide analysis of defenseresponsive genes in bacterial blight resistance of rice mediated by the recessive R gene xa13[J]. Mol Genet Genomics, 2004, 271:111-120.
[8] Song WY, Wang GL, Chen L, et al. A receptor kinase-like protein encoded by the rice disease resistance gene Xa21[J]. Science, 1995, 270:1804-1806.
[9] 王春连. 水稻抗白叶枯病基因Xa23的图位克隆[D]. 北京:中国农业科学院研究生院, 2006.
[10] Sun X, Cao Y, Yang Z, et al. Xa26, a gene conferring resistance to Xanthomonas oryzae pv. oryzae in rice, encodes an LRR receptor kinase-like protein[J]. Plant J, 2004, 37:517-527.
[11] Gu K, Tian D, Yang F, et al. High-resolution genetic mapping of Xa27(t), a new bacterial blight resistance gene in rice, Oryza sativa L[J]. Theor Appl Genet, 2004, 108(5):800-807.
[12] Khush GS, Bacalangco E, Ogawa T. A new gene for resistance to bacterial blight from O. longistaminate[J]. Rice Genet News Lett, 1990, 7:121-122.
[13] Ronald PC, Albano B, Tabien R, et al. Genetic and physical analysis of the rice bacterial blight disease resistance locus, Xa21[J]. Mol Gen Genet, 1992, 236(1):113-120.
[14] Wang GL, Holsten TE, Song WY, et al. Construction of a rice bacterial artificial chromosome library and identification of clones linked to the Xa27 disease resistance locus[J]. Plant J, 1995, 7:525-533.
[15] Song WY, Pi LY, Wang GL, et al. Evolution of the rice Xa21 disease resistance gene family[J]. Plant Cell, 1997, 9:1279-1287.
[16] Goel RK, Gupta AK. Host age in relation to resistance in rice to bacterial blight caused by Xanthomonas campestris pv. oryzae[J]. Trop Agric, 1990, 67:368-370.
[17] Kim KD, Hwang BK, Koh YJ. Evaluation of rice cultivars under greenhouse conditions for adult-plant resistance to Pyricularia oryzae[J]. J Phytopath, 1987, 120:310-316.
[18] Ogawa T. Methods and strategy for monitoring race distribution and identification of resistance to bacterial leaf blight(Xanthomonas
campestris pv. oryzae)in rice[J]. Japan Agric Res Quart, 1993, 27:71-80.
[19] Yeh WH, Bonman JM, Lee EJ. Effects of temperature, leaf wetness duration, and leaf age on partial resistance to rice blast[J]. J Plant Prot Trop, 1989, 6:223-230.
[20] Century KS, Lagman RA, Adkisson M, et al. Short communication:developmental control of Xa21-mediated disease resistance in rice[J]. Plant J, 1999, 20(2):231-236.
[21] Zhao J, Fu J, Li X, et al. Dissection of the factors affecting development-controlled and race-specific disease resistance conferred by leucine-rich repeat receptor kinase-type R genes in rice[J]. TAG Theoretical and Applied Genetics, 2009, 119:231-239.
[22] Park CJ, Lee SW, Chern M, et al. Ectopic expression of rice Xa21 overcomes developmentally controlled resistance to Xanthomonas oryzae pv. Oryzae[J]. Plant Sci, 2010, 179(5):466-471.
[23] 万丙良, 张献龙. Xa21基因的分子生物学研究进展[J].中国水稻科学, 1998, 12(2):115-118.
[24] 白辉, 李莉云, 刘国振. 水稻抗白叶枯病基因Xa21的研究进展[J].遗传, 2006, 28(6):745-753.
[25] Liu GZ, Pi LY, Walker JC, et al. Biochemical characterization of the kinase domain of the rice disease resistance receptor-like kinase XA21[J]. J Biol Chem, 2002, 277(23):20264-20269.
[26] Xu WH, Wang YS, Liu GZ, et al. The autophosphorylated Ser686, Thr688, and Ser689 residues in the intracellular juxtamembrane domain of XA21 are implicated in stability control of rice receptorlike kinase[J]. Plant J, 2006, 45(5):740-751.
[27] Flor HH. Inheritance of pathogenicity in Melampsora lini[J]. Phytopathology, 1942, 32:653-669.
[28] Flor HH. Current status of the gene-for-gene concept[J]. Annual Review of Phytopathology, 1971, 9(1):275-296.
[29] 王育鹏, 刘登义, 李征, 等. 自然植物种群中病原菌与寄主植物相互作用的遗传学[J]. 生态学杂志, 2005, 24(2):190-194.
[30] Medzhitov R, Janeway CA Jr. Innate immunity:impact on the adaptive immune response[J]. Curr Opin Immunol, 1997, 9(1):4-9.
[31] Medzhitov R. Toll-like receptors and innate immunity[J]. Nat Rev Immunol, 2001, 1(2):135-145.
[32] Boller T, Felix G. A renaissance of elicitors:perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors[J]. Annu Rev Plant Biol, 2009, 60:379-406.
[33] Shen Y, Sharma P, da Silva FG, et al. The Xanthomonas oryzae pv. lozengeoryzae raxP and raxQ genes encode an ATP sulphurylase and adenosine-5'-phosphosulphate kinase that are required for AvrXa21 avirulence activity[J]. Mol Microbiol, 2002, 44(1):37-48.
[34] da Silva FG, Shen YW, Dardick C, et al. Bacterial genes involved in type I secretion and sulfation are required to elicit the rice Xa21-mediated innate immune response[J]. Mol Plant Microbe Interact, 2004, 17(6):593-601.
[35] Burdman S, Shen Y, Lee SW, et al. RaxH/RaxR:a two-component regulatory system in Xanthomonas oryzae pv. oryzae required for AvrXa21 activity[J]. Mol Plant Microbe Interact, 2004, 17(6):602-612.
[36] Lee SW, Han SW, Bartley LE, et al. From the Academy:Colloquium review. Unique characteristics of Xanthomonas oryzae pv. oryzae AvrXa21 and implications for plant innate immunity[J]. PNAS, 2006, 103:18395-18400.
[37] Lee SW, Han SW, Sririyanum M, et al. A type I-secreted, sulfated peptide triggers XA21-mediated innate immunity[J]. Science, 2009, 326(5954):850-853.
[38] Dardick C, Ronald P. Plant and animal pathogen recognition receptors signal through non-RD kinases[J]. PLoS Patho, 2006, 2:e2.
[39] Chen X, Shang J, Chen D, et al. A B-lectin receptor kinase gene conferring rice blast resistance[J]. Plant J, 2006, 46:794-804.
[40] Sun X, Cao Y, Yang Z, et al. Xa26, a gene conferring resistance to Xanthomonas oryzae pv. oryzae in rice, encodes an LRR receptor kinase-like protein[J]. Plant J, 2004, 37:517-527.
[41] Chinchilla D, Zipfel C, Robatzek S, et al. A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence[J]. Nature, 2007, 448:497-500.
[42] Wan J, Zhang XC, Neece D, et al. A LysM receptor-like kinase plays a critical role in chitin signaling and fungal resistance in Arabidopsis[J]. The Plant Cell, 2008, 20:471-481.
[43] Wang GL, Ruan DL, Song WY, et al. Xa21D encodes a receptorlike molecule with a leucine-rich repeat domain that determines race-specific recognition and is subject to adaptive evolution[J].
The Plant Cell, 1998, 10:765-779.
[44] Chen X, Chern M, Canlas PE, et al. A conserved threonine residue in the juxtamembrane domain of the XA21 pattern recognition receptor is critical for kinase autophosphorylation and XA21-mediated immunity[J]. J Biol Chem, 2010, 285(14):10454-10463.
[45] Wang Y, Pi L, Chen X, et al. Rice XA21 binding protein 3 is a ubiquitin ligase required for full Xa21-mediated disease resistance[J]. The Plant Cell, 2006, 18:3635-3646.
[46] Peng Y, Bartley LE, Chen X, et al. OsWRKY62 is a negative regulator of basal and Xa21-mediated defense against Xanthomonas oryzae pv. oryzae in rice[J]. Molecular Plant, 2008, 1(3):446-458.
[47] Park C, Peng Y, Chen X, et al. Rice XB15, a protein phosphatase 2C, negatively regulates cell death and XA21-mediated innate immunity[J]. PLoS Biology, 2008, 6(9):e231.
[48] Chen X, Chern M, Canlas PE, et al. An ATPase promotes autophosphorylation of the pattern recognition receptor XA21 and inhibits XA21-mediated immunity[J]. PNAS, 2010, 107(17):8029-8034.
[49] Park CJ, Bart R, Chern M, et al. Overexpression of the endoplasmic reticulum chaperone BiP3 regulates XA21-mediated innate immunity in rice[J]. PLoS One, 2010, 5(2):e9262.
[50] Peng Y, Bartley LE, Canlas P, et al. OsWRKY IIa transcription factors modulate rice innate immunity[J]. Rice, 2010, 3:36-42.
[51] Park CJ, Han SW, Chen X, et al. Elucidation of XA21-mediated innate immunity[J]. Cellular Microbiology, 2010, 12:1017-1025.
[52] Park CJ, Ronald PC. Cleavage and nuclear localization of the rice XA21 immune receptor[J]. Nat Commun, 2012, 3:920.
[53] 曾列先, 黄少华, 伍尚忠. IRBB21(Xa21)对广东稻白叶枯病菌5个小种的抗性反应[J]. 植物保护学报, 2002, 2(29):97-100.
[54] 何翎, 高利军, 邓国富, 等. 广西水稻白叶枯病有效抗病基因和抗性亲本的筛选[J]. 安徽农业科学, 2011, 39(27):16604-16605.
[55] 郑康乐, 庄杰云, 王汉荣. 基因聚合提高了水稻对白叶枯病的抗性[J]. 遗传, 1998(4):4-6.
(责任编辑 狄艳红)
Advances of Molecular Biology Researches on Rice Bacterial Blight Disease Resistance Gene Xa21
Chen Xiaolin Yan Qun Gao Lijun Gao Hanliang
(Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests,Plant Protection Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007)
The bacterial blight of rice caused by Xanthomonas oryzae pv. oryzae(Xoo)is one of the most destructive diseases in the world. Up to now, 7 bacterial blight resistance genes have been cloned. Xa21 is the first bacterial blight disease resistance gene cloned from rice and it has drawn great attention because of its broad spectrum resistance against Xoo. This paper briefly reviewed the discovery, mapping, cloning, expression properties of Xa21, biochemical properties, action and regulation of XA21 and XA21-mediated immunity. Future perspective on Xa21-related research were also discussed.
Rice Bacterial blight Resistance gene Xa21
2013-09-10
国家科技支撑计划子课题(2012BAD19B03),国家现代农业产业技术体系广西(水稻)创新团队项目,广西作物病虫害生物学重点实验室基金项目(13-051-47-ST-3),广西“特聘专家”专项经费资助
陈小林,女,博士,研究方向:病原菌与植物的分子互作;E-mail:56297244@qq.com
高汉亮,男,研究员,研究方向:水稻抗病育种;E-mail:gxdwb2008@163.com

