香山黄栌叶片内生细菌的分离与鉴定
香山黄栌叶片内生细菌的分离与鉴定
左山1刘洋2周肖红3沈悦1李哲1彭程1陈亮3程池2
(1. 北京市广渠门中学,北京 100062;2. 中国食品发酵工业研究院 中国工业微生物菌种保藏管理中心,北京 100027;3. 北京市香山公园管理处,北京 100093)
通过微生物培养方法对北京香山黄栌叶片内生细菌进行分离及筛选,共得到81株内生细菌,经形态学观察、16S rDNA扩增及系统发育分析,将其归为变形菌门(Proteobacteria)中的欧文氏菌属(Erwinia)和志贺氏菌属(Shigella);厚壁菌门(Firmicutes)中的芽孢杆菌属(Bacillus)、柯恩氏菌属(Cohnella)、类芽孢杆菌属(Paenibacillus)和葡萄球菌属(Staphylococcus);放线菌门(Actinobacteria)中的短小杆菌属(Curtobacterium)。这是国内外首次利用培养方法针对黄栌叶片内生细菌进行研究的报道。
黄栌 叶 内生细菌 培养方法
植物内生细菌是指能定殖在健康植物组织内,并与植物建立和谐联合关系的一类微生物,它们可以通过生物防治、植物促生和内生固氮等作用直接或者间接影响植物的生长发育,是植物维持自身健康生长与适应环境的重要因素之一[1]。目前认为,植物内生细菌与植物生长发育、抗病害能力、功效性成分产生以及生境生态平衡稳定都具有重要作用,成为当前微生物生态学研究的一个热点领域[1]。
黄栌是优良的秋季红叶树种,也是我国长江流域、华北、华中地区常见的荒山绿化树种,具有生长强健及耐贫瘠等特性。黄栌(Cotinus coggygriavar.cinerea)是构成香山红叶景观的主体树种,香山
1 材料与方法
1.1 材料
黄栌叶片于2013年7月采集自北京市香山公园,
具体位置为东经116.19°,北纬39.99°,海拔181 m。采集所得样品于4℃保存。
1.2 方法
1.2.1 培养基及试剂 LB及R2A成品培养基,购自北京陆桥公司;细菌基因组DNA提取试剂盒及PCR相关试剂购自TIANGEN公司;PCR引物由北京诺赛生物公司合成。
1.2.2 样品表面灭菌 称取1 g叶片样品,并用无菌水冲洗,之后依次用70%乙醇,次氯酸钠溶液(2.5%有效Cl-),70%乙醇浸泡3 min,5 min,30 s,再用无菌水淋洗6次,并于无菌条件下晾干;同时取最后一次淋洗水120 μL涂于LB固体培养基平板上,28℃培养72 h,以检测表面灭菌效果[3]。
1.2.3 内生细菌的分离与纯化 采用刘琳等[4]方法进行。将表面灭菌处理的黄栌叶片置于无菌研钵中研磨成粉末,然后依次用无菌水稀释成浓度为10-1、10-2和10-3悬液。分别取200 μL涂布于R2A和LB平板上,每个处理3个平行。28℃培养2-3 d。根据菌落形态(大小、形状、颜色、表面光泽度、边缘整齐度、透明度等),随机挑取平板上具有差异的代表性菌落,纯化后将其接种于斜面培养基,并4℃保存备用。
1.2.4 内生细菌的16S rDNA序列分析 采用细菌基因组DNA提取试剂盒(TIANGEN)提取菌株基因组DNA作为PCR反应的模板。采用细菌通用引物27F(5'-AGAGTTTCATCTGGCTCAG-3') 和1 492R(5'-GGTTACCTTGTTACGAC-TT-3')[5]对菌株16S rDNA片段进行PCR扩增。PCR反应体系(50 μL):10×buffer 5 μL、dNTP(2.5 mmol/L)4 μL、引物27F(10 mmol/L)1 μL、引物1 492R(10 mmol/L)1 μL、Taq酶(5 U/L)0.25 μL、DNA模板3 μL、ddH2O补足至50 μL。PCR反应程序:94℃ 5 min;94℃ 1 min,55℃ 1 min,72℃ 1 min,30个循环;72℃ 10min。1%琼脂糖检测凝胶电泳检测PCR扩增产物。
1.2.5 核糖体DNA扩增片段限制性内切酶分型(Amplifed ribosomal DNA restriction analysis,ARDRA) 用HaeIII(TaKaRa)和Hin6I(TaKaRa)两种内切酶对PCR产物进行酶切分型,两种酶带型完全一致则认为是同一种或同一类型的细菌[4]。酶切反应体系为 0.4 μL内切酶HaeIII(或Hin6I),1.5 μL酶切缓冲液,400 ng PCR产物,最后加灭菌水至15 μL。37℃ 酶切4 h,1.0%的琼脂糖凝胶电泳分离酶切片段,100 V电泳60 min。比较各菌株的酶切图谱并归类。
1.2.6 细菌16S rDNA序列测定与同源性比对 经ARDRA 初步分型,选取代表菌株进行16S rDNA 全长片段进行扩增(引物及方法同上)。PCR扩增产物约1.5 kb,采用ABI 3730型DNA测序仪测序,将序列信息提交至NCBI,并将测序得到的结果在EzTaxon server 2.1进行比对[6],确定与已知序列的同源关系。
2 结果
2.1 黄栌叶片内生细菌分离及基因组DNA提取
通过传统微生物分离培养,共获得黄栌叶片内生细菌81株。利用细菌基因组DNA提取试剂盒提取黄栌叶片内生细菌基因组DNA,1%凝胶电泳结果(图1)显示总DNA大小约为23 kb。

图1 部分黄栌叶片内生细菌的基因组DNA
2.2 黄栌叶片内生细菌16S rDNA PCR扩增及ARDRA 分型
采用细菌通用引物27F和1492R对黄栌叶片内生细菌16S rDNA 进行PCR扩增,得到长度约1 500 bp的扩增片段,图2为部分细菌的16S rDNA PCR产物电泳图谱。将扩增的 PCR 产物用HaeIII和Hin6I两种内切酶进行酶切分型(ARDRA分型),将两个酶切图谱类型完全相同的细菌划分为一个操作分类
单元(Operational taxonomy unit,OTU)(图3)。每种OTU选定1-2个代表菌株再次进行16S rDNA PCR扩增以备用测序。
图2 部分黄栌内生细菌的16S rDNA片段扩增结果
图3 部分黄栌内生细菌的ARDRA酶切分型结果
2.3 黄栌叶片内生细菌多样性及系统发育分析
黄栌叶片内生细菌的16S rDNA序列比对及其群落多样性分析结果如表1所示。经16S rDNA序列比对及其系统发育分析(图4),内生细菌群落共包含11个OTU,分属变形菌门(Proteobacteria)中的欧文氏菌属(Erwinia)和志贺氏菌属(Shigella);厚壁菌门(Firmicutes)中的芽孢杆菌属(Bacillus)、柯恩氏菌属(Cohnella)、类芽孢杆菌属(Paenibacillus)和葡萄球菌属(Staphylococcus);放线菌门(Actinobacteria)中的短小杆菌属(Curtobacterium)。在所分离的得到的81株内生细菌中,厚壁菌门(Firmicutes)为优势菌门;芽孢杆菌属(Bacillus)及葡萄球菌属(Staphylococcus)为优势菌属,丰度分别为53.09%和30.86%。其中,R-54所代表的OTU为该黄栌叶片内生细菌群落中的第一优势种群;L-20所代表的OTU为该黄栌叶片内生细菌群落中的第二优势种群(表1)。
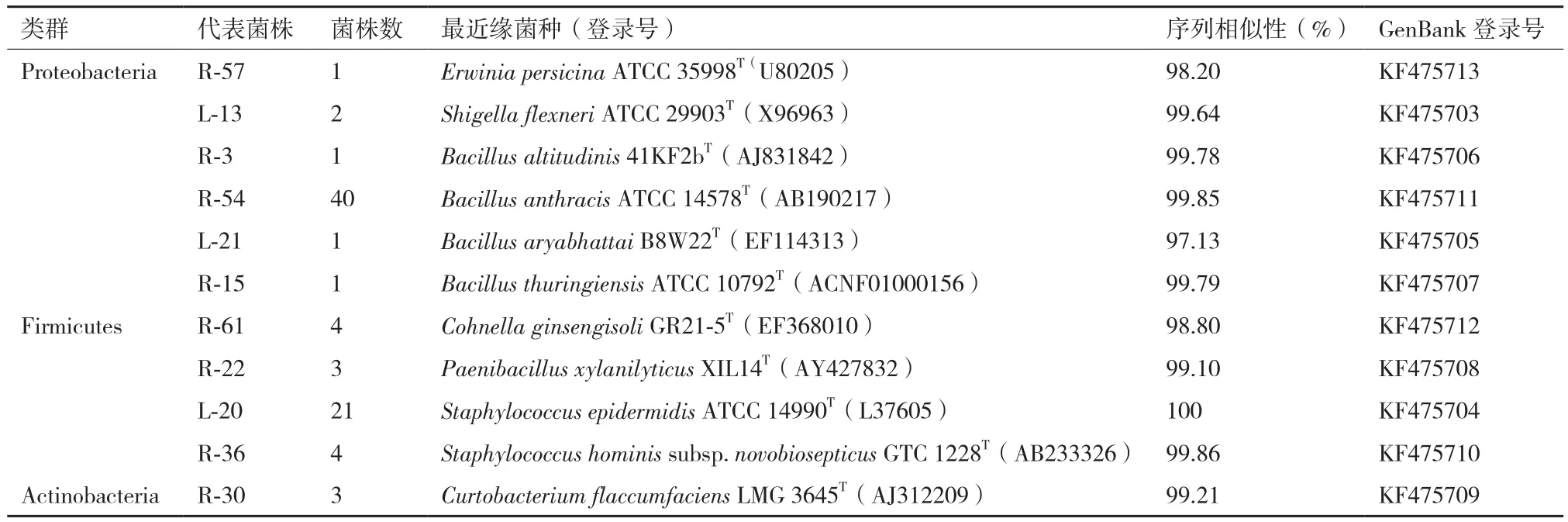
表1 黄栌叶片内生细菌多样性统计
3 讨论
植物内生细菌[7-11]存在于植物的根、茎、叶、花果实及种子中[12,13],其中不乏一些能够对植物生长和健康起到直接或者间接促进作用的细菌种类,已有很多关于这些有益内生细菌生态功能的报道,其中对植物的直接促生作用主要包括生物固氮[14,15]、分泌和诱导产生植物生长调节物质[16,17]、改善植物对矿物质的利用率[18]及改变宿主植物对霜冻等有害环境条件的敏感性等[19,20]。对植物具有间接促生作用有益内生细菌的生态功能主要是植物内生细菌的生防作用,到目前为止已从众多植物体中分离得到了具有良好抑制效果的植物内生细菌[12,15,21,22]。
本研究自北京香山红叶景观的主体树种—黄栌叶片中分离培养得到7个内生细菌菌属,其中以芽孢杆菌属(Bacillus)最为优势,该属中许多细菌种类是常见的植物促生细菌[23]。本研究分离得到的菌株L-21所对应的最近缘菌种Bacillus aryabhattai是拮抗烟草黑胫病(Phytophthora parasiticavar.nicotianae)的生防菌[24];R-15所对应的最近缘菌种苏云金芽孢杆菌(Bacillus thuringiensis)是目前世界上产量最大、使用最广的生物杀虫剂,对鳞翅目、鞘翅
目、双翅目、膜翅目和同翅目等昆虫,以及动植物线虫、蜱螨等节肢动物都有特异性的毒杀活性,而对非目标生物具有较高的安全性,因此在国内外植物保护相关领域的科研与实践中备受人们关注[25]。此外,菌株R-22所对应的最近缘菌种解木聚糖类芽孢杆菌(Paenibacillus xylanilyticus)对由大丽轮枝菌(Verticillium dahliae)所引起的棉花黄萎病具有明显的拮抗作用,可用于棉花黄萎病的生物防治[26]。类芽孢杆菌属中不乏具有生防促生作用的细菌种类,宋未等(2007)自水稻根际分离得到多黏类芽孢杆菌(Paenibacillus polymyxa)WY110,该菌对水稻的三种主要病原菌——稻瘟病、水稻纹枯病及水稻白叶枯病均具有很高的体外特异性拮抗活性,且拮抗谱较宽,并兼具固氮活性及生产生长素作用,在温室实验中表现较好的植株防病效果,普遍达到50%以上,具有良好的研究与应用价值[27]。宋顺华等[28]经研究发现多黏类芽孢杆菌(Paenibacillus polymyxa)WY110对西瓜枯萎病亦有良好的防治作用。本课题组新近自诺尼(Morinda citrifoliaL.)植物中分离获得类芽孢杆菌CICC 10580,其对小麦根腐病、稻瘟病菌及棉花黄萎病等多种病原真菌具有明显的拮抗作用(数据尚未发表)。
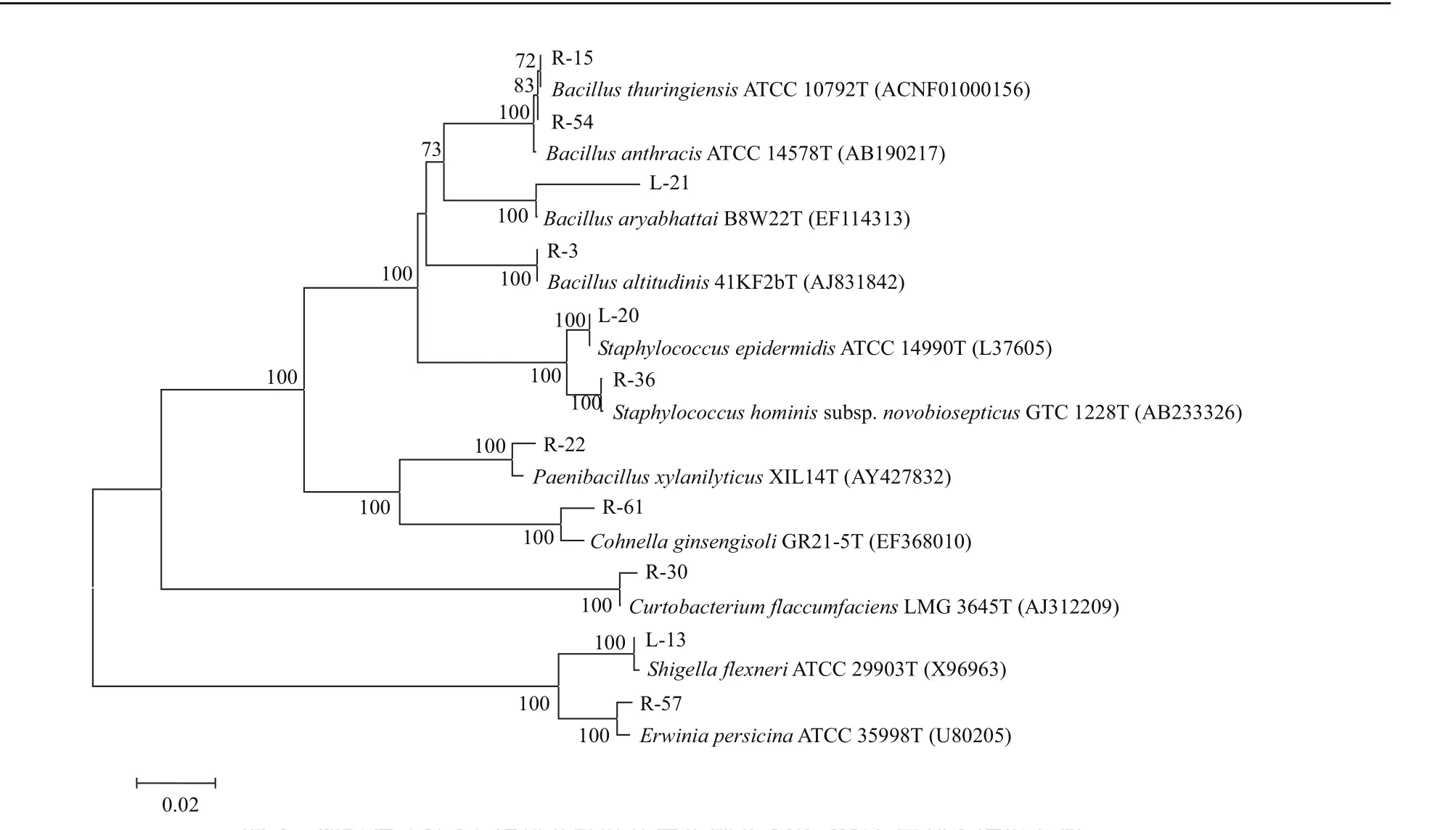
图4 邻接法(N-J)构建黄栌叶片内生细菌16S rDNA序列系统发育树
由此可见,香山黄栌叶片内生细菌群落中存在有益细菌资源。因此,利用多种培养条件进一步分离筛选其内生细菌,以获得种类更为丰富的内生菌资源,为进一步研究其中的有益功能菌种与黄栌植物的生长健康及其景观效果之间的相关性奠定了微生物资源基础。
4 结论
国内外首次利用微生物培养方法分离筛选黄栌叶片的内生细菌,分属变形菌门中的欧文氏菌属和志贺氏菌属,厚壁菌门中的芽孢杆菌属、柯恩氏菌属、类芽孢杆菌属和葡萄球菌属,放线菌门中的短小杆菌属,其中包含植物生防促生细菌种类。
[1] 刘洋, 左山, 邹媛媛, 等. 杂交玉米农大108及其亲本种子内生细菌群落多样性的研究[J]. 中国农业科学, 2011, 44(23):4763-4771.
[2] 宋立洲, 杜万光, 李维维. 香山公园黄栌枯萎病防治技术研究[J]. 北京园林, 2011, 27(96):51-56.
[3] Liu Y, Zuo S, Zou YY, et al. Investigation on diversity and population succession dynamics of endophytic bacteria from seeds of maize(Zea mays L., Nongda108)at different growth stages[J]. Annals
of Microbiology, 2013, 63:71-79.
[4] 刘琳, 刘洋, 宋未. 杂交水稻种子固有细菌群落多样性探究[J]. 生物技术通报, 2009(1):95-99.
[5] Liu Y, Liu L, Qiu FB, et al. Paenibacillus hunanensis sp. nov., isolated from rice seeds[J]. Int J Syst Evol Microbiol, 2010, 60:1266-1270.
[6] Chun J, Lee JH, Jung Y, et al. EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J]. In J Syst Evol Microbiol, 2007, 57:2259-2261.
[7] 陈声明, 林海萍, 张立钦. 微生物生态学导论[J]. 北京:高等教育出版社, 2007:4-5.
[8] 康白. 正常微生物生态学研究进展[J].大连医科大学学报, 1984, 6:116-126.
[9] 蔡元呈. 植物微生态学与植物微生态制剂的应用[J]. 中国生态农业学报, 2002, 10(2):106-108.
[10] 梅汝鸿. 植物微生态学的定义[J]. 中国微生态学杂志, 1991, 3(2):94-96.
[11] Beattie GA. Survey, molecular phylogeny, genomics and recent advances[M]// Gnanamanickam SS. Plant-associated bacteria. Dordrecht:Spring, 2006:1-56.
[12] Sturz AV, Christie BR, Nowak J. Bacterial endophytes:potential role in developing sustainable systems of cropproduction[J]. Crit Rev Plant Sci, 2000, 19(1):1-30.
[13] 鲍敏, 康明浩. 植物内生菌研究发展现状[J]. 青海草业, 2011, 20(1):21-25.
[14] Azevedo JL, Water MJ, Jose OP, et al. Endophytic microorganisms:a review on insect control and recent advances on tropical plants[J]. Electronic J Biotechnol, 2000, 3(1):40-65.
[15] 何红, 邱思鑫, 胡方平, 等. 植物内生细菌生物学作用研究进展[J]. 微生物学杂志, 2004, 24(3):40-45.
[16] Pan B, Vessey JK. Response of the endophytic diazotroph Gluconacetobacter diazotrophicus on solid media to changes in atmospheric partial O2pressure[J]. Appl Environ Microbiol, 2001, 67(10):4694-4700.
[17] Lazarovits G, Nowak J. Rhizobacteria for improvement of plant growth and establishment[J]. Hortscience, 1997, 32:188-192.
[18] Murty MG, Ladha JK. Influence of Azospirillum inoculation on the mineral uptake and growth of rice under hytroponic conditions[J]. Plant Soil, 1988, 108:281-285.
[19] Xu H, Griffith M, Patten CL, et al. Isolation and characterization of an antifreeze protein with ice nucleation activity from the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J]. Can J Microbiol, 1998, 44:64-73.
[20] 蔡学清, 林彩萍, 何红, 等. 内生枯草芽孢杆菌BS-2对水稻苗生长的效应[J]. 福建农林大学学报:自然科学版, 2005, 34(2):189-194.
[21] Zehnder GW, Murphy JF, Sikora EJ, et al. Application of rhzobacteria for induced resistance[J]. Eur J Plant Pathol, 2001, 107:39-50.
[22] 杨海莲, 孙晓璐, 宋未. 植物根际促生细菌和内生细菌的诱导抗病性的研究进展[J]. 植物病理学, 2000, 30(2):106-110.
[23] Lucy M, Reed E, Glick BR. Applications of free living plant growthpromoting rhizobacteria[J]. Antonie Van Leeuwenhoke, 2004, 86:1-25.
[24] 冯云利, 奚家勤, 马莉, 等. 烤烟品种NC297内生细菌中拮抗烟草黑胫病的生防菌筛选及种群组成分析[J]. 云南大学学报:自然科学版, 2011, 33(4):488-496.
[25] 喻子牛, 王阶平, 何进. 苏云金芽孢杆菌基因组研究[J]. 微生物学杂志, 2013, 33(2):1-6.
[26] 周燚, 杨廷宪, 王斌先, 等. 棉花内生拮抗菌Paenibacillus xylanilyticus YUPP-1抗黄萎病研究[J]. 棉花学报, 2012, 24(1):71-77.
[27] 王云山, 韩继刚, 杨海莲, 等. 水稻生防新菌株多粘类芽孢杆菌WY110的分离筛选和鉴定[M]//朱昌雄.农业生物资源与环境调控. 北京:中国农业科学技术出版社, 2007:271-281.
[28] 宋顺华, 吴萍, 邢宝田, 等. 多粘类芽孢杆菌WY110对西瓜枯萎病的控制作用[J]. 植物保护学报, 2011, 38(6):571-572.
(责任编辑 狄艳红)
Isolation and Identification of Endophytic Bacteria in Leaf from Xiangshan Smoke Tree( Cotinus coggygria var. cinerea)
Zuo Shan1Liu Yang2Zhou Xiaohong3Shen Yue1Li Zhe1Peng Cheng1Chen Liang3Cheng Chi2
(1. Beijing Guang Qumen Middle School,Beijing 100062;2. China Center of Industrial Culture Collection,China National Research Institute of Food and Fermentation Industries,Beijing 100027;3. Beijing Xiangshan Park Management Office,Beijing 100093)
The endophytic bacteria in leaf of Xiangshan smoke tree were isolated, screened and identified by the microbial culturedependent method combing with morphological observation, 16S rDNA amplification and phylogenetic analysis, indicated that the total 81 strains from the leaves were clustered into 7 genus:Erwinia and Shigella, Bacillus, Cohnella, Paenibacillus and Staphylococcus, and Curtobacterium belonging to Proteobacteria, Firmicutes and Actinobacteria, respectively. This is the first report about investigation on the endophytic bacteria in leaf of Xiangshan smoke tree using culture-dependent method.
Smoke tree Leaf Endophytic bacteria Culture-dependent method公园面积约160 hm2,黄栌数量约10万余株,主要分布于香山马蹄形山坳的西南部[2]。近年来,香山红叶的培育和病害防治引起广泛关注。本项目首次以香山黄栌叶片为研究对象,采用微生物培养方法和分子生物学技术对其内生细菌群落结构多样性进行分析,为进一步研究这些内生细菌菌种的生物学功能,以及香山红叶植物的生长健康与病害防治奠定微生物资源基础。
2013-09-04
北京市青少年科学探索专项资金项目,中国食品发酵工业研究院科技发展基金(博士基金)项目(2012KJFZ-BS-01)
左山,女,硕士,研究方向:植物微生物生态学,E-mail:zuoshanwork@163.com;刘洋同为本文第一作者
程池,男,教授级高工,博士生导师,研究方向:微生物学;E-mail:cheng100027@163.com

