利用发酵法生产氨基葡萄糖的研究进展
利用发酵法生产氨基葡萄糖的研究进展
王升 李丕武 刘佃磊 李以明 林晶晶
(齐鲁工业大学食品与生物工程学院 山东省微生物工程重点实验室,济南 250353)
氨基葡萄糖(GlcN)是一种重要的氨基己糖。它由葡萄糖的一个羟基被氨基取代形成,能够有效作用于软骨组织治疗风湿性关节炎,并被视为天然无害的食品及保健品配料,市场应用前景广阔。目前,生产GlcN的方法主要有酸水解法、酶解法及微生物发酵法。由于酸水解法及酶解法生产GlcN会对环境造成不利影响及生产效率低等原因,微生物发酵法生产GlcN得到了越来越多研究者的关注。对微生物代谢产GlcN的合成途径、霉菌发酵产GlcN及工程菌发酵产GlcN等方面进行了概述,并对微生物发酵法生产GlcN的研究方向进行了展望。
氨基葡萄糖 合成途径 微生物发酵
氨基葡萄糖(2-amino-2-deoxy-D-glucose,GlcN)是一种重要的氨基己糖,由葡萄糖的一个羟基被氨基取代形成,分子式为C6H13O5N,易溶于水及亲水性溶剂。GlcN广泛存在于真菌细胞壁及虾蟹的外骨骼中,是甲壳素与壳聚糖的组成成分[1]。在自然界中,细菌、酵母、真菌、植物及动物体内也广泛存在GlcN[2,3]。GlcN也是糖蛋白和蛋白聚糖的主要成分,在人与动物的关节软骨组织中起着重要作用[4],并大量存在于人类眼睛晶状体中[5,6]。早在20个世纪60年代,GlcN就已被大量用于骨关节炎的治疗。研究表明,它能够有效作用于软骨组织治疗风湿性关节炎[7,8],其次对白血病癌细胞具有抑制作用,并有消炎护肝的功效[9,10]。GlcN在食品保健领域也有着广泛的应用,在一些欧美国家GlcN被视为天然无害的食品及保健品配料而得到大量推广,而目前国内相关产品较少[7]。目前,生产GlcN的方法主要有3种,即酸水解法、酶解法[11,12]及微生物发酵法。前两种方法的生产原料基本上来源于虾蟹的外骨骼,即从虾蟹壳中提取甲壳素与壳聚糖,再经酸解或酶解获得GlcN。高浓度的盐酸在一定的反应条件下能够将虾蟹壳中的甲壳素与壳聚糖降解为GlcN,但由于浓盐酸的大量使用会带来严重的环境问题,将逐步受到国家相关政策的限制;酶解法是利用壳聚糖酶对虾蟹壳进行降解,现在面临的最大问题是生产
效率低下,表现为壳聚糖酶价格较高、转化时间较长及生产成本较高。且来源于虾蟹壳的GlcN在临床应用过程中会引起过敏体质患者的过敏反应[13]。所以微生物发酵法生产GlcN得到了越来越多研究者的关注。相较于酸水解法与酶解法,微生物发酵法生产GlcN具有以下优点:消除了地域季节对原料来源的限制,产品无鱼腥味;生产周期短,强度高;对环境污染较小;不产生过敏反应[14]。
目前,国内外对微生物发酵法生产GlcN的研究相对较少,相关产业尚未形成工业化生产规模。所以,着重对微生物代谢产GlcN的合成途径、霉菌发酵产GlcN及工程菌发酵产GlcN等方面进行了概述,并对微生物发酵法生产GlcN的研究方向进行了展望,以期对相关研究起到积极的推动作用。
1 GlcN生物合成途径

图1 氨基葡萄糖生物合成途径
在生物体内GlcN通过氨基己糖途径(图1)合成,此途径起始于糖酵解产生的Fru6P。Fru6P在磷酸氨基葡萄糖合成酶,也称为谷氨酰胺磷酸果糖氨基转移酶(Glutamine fructose-6P amidotransferase,GAT)作用下转化为GlcN6P[15]。对于细菌与真菌,磷酸氨基葡萄糖合成酶为重要的限速酶分别由glmS与gfa1编码。磷酸氨基葡萄糖合成酶位于氨基糖生物合成的起始位置,控制着氨基糖生物合成途径,所以有必要对磷酸氨基葡萄糖合成酶进行深入研究[15,16]。对大肠杆菌(Escherichia coli)与假丝酵母(Candida albicans)的研究表明,磷酸氨基葡萄糖合成酶是L-谷氨酰胺依赖性氨基转移酶(L-glutamine-dependent amidotransferases,GATs)家族的一员。GATs催化L-谷氨酰胺上的氨基氮转移到相应受体上[15]。对融合酶进行的生物化学以及X-射线晶体衍射分析进一步揭示了GATs的生物化学特性及物理特性[15]。磷酸氨基葡萄糖合成酶催化过
程中,通过酶上的微小通道将L-谷氨酰胺上的氨基转移至Fru6P[17],且获得的催化过程中结构域的晶体结构,为阐明磷酸氨基葡萄糖合成酶的催化过程奠定了理论基础[17]。GlcN6P可在磷酸氨基葡萄糖脱氨酶催化下转化为Fru6P,此步是生物体利用氨基糖作为碳源的最重要途径,即当胞内的GlcN6P含量过高时,会有过量Fru6P生成进入糖酵解途径[18]。磷酸氨基葡萄糖合成酶催化的反应是将Fru6P转化为GlcN6P,L-谷氨酰胺作为氨基氮的供体,而磷酸氨基葡萄糖脱氨酶与磷酸氨基葡萄糖合成酶的催化反应方向相反,它催化GlcN6P转化为Fru6P与氨基[19]。磷酸氨基葡萄糖脱氨酶序列的分析表明磷酸氨基葡萄糖脱氨酶是3个簇组成的超家族蛋白,具有一定的多样性与复杂性[20]。而相关研究报道了对来源于枯草芽孢杆菌(Bacillus subtilis)的磷酸氨基葡萄糖脱氨酶进行三维结构及动力学分析的研究,则揭示了磷酸氨基葡萄糖脱氨酶的物理化学性质[21]。GATs催化生成的GlcN6P在下游两种酶的作用下生成GlcNAc1P后,1-磷酸乙酰尿苷转移酶催化GlcNAc1P生成UDP-GlcNAc。UDP-GlcNAc可形成细菌细胞壁的肽聚糖,革兰氏阴性菌的脂多糖以及真菌细胞壁中的几丁质[15]。对于细菌与真菌,GlcN生物合成途径的不同之处在于上述两种酶的差异。细菌中为避免生成的GlcN6P转化为Fru6P以及GlcN6P自身对细胞的毒害作用,在磷酸氨基葡萄糖变位酶[22]的作用下GlcN6P被转化为GlcN1P。GlcN1P又在磷酸氨基葡萄糖酰基转移酶催化下生成GlcNAc1P。GlcNAc1P对细胞无毒害作用,则消除了对细胞的不利影响[23]。因此,磷酸氨基葡萄糖变位酶是细菌细胞内合成UDP-GlcNAc的关键酶[24,25]。研究表明,磷酸氨基葡萄糖变位酶的编码基因发生突变将影响细菌细胞的正常生长,形态学特征以及对青霉素的敏感性[25]。目前,对来源于大肠杆菌、绿脓假单胞菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)等的磷酸氨基葡萄糖变位酶进行的研究进一步表明,将磷酸氨基葡萄糖变位酶编码基因敲除后,细胞毒性会降低,对抗生素的相容性增加。而在真菌细胞内,GlcN6P依次在6-磷酸氨基葡萄糖乙酰转移酶与磷酸乙酰氨基葡萄糖变位酶催化下最终也转化为GlcNAc1P[26]。据研究报道,在细胞膜上还存在控制磷酸化GlcN及乙酰化GlcN进出细胞的载体蛋白,若能够通过基因工程手段,控制此载体蛋白的运载功能,则对于提高发酵法生产的GlcN在胞外的累积量至关重要[15]。GlcN的代谢过程是多种酶参与的催化过程。如何有效控制代谢过程中的酶,是微生物代谢工程研究的重要内容,所以利用多基因表达的控制策略进行微生物代谢产GlcN的研究将对发酵法生产GlcN起到积极的推动作用[27]。在构建高产GlcN工程菌过程中,对关键酶基因进行过量表达或对抑制基因进行失活处理,将有可能提高目的产物的量。
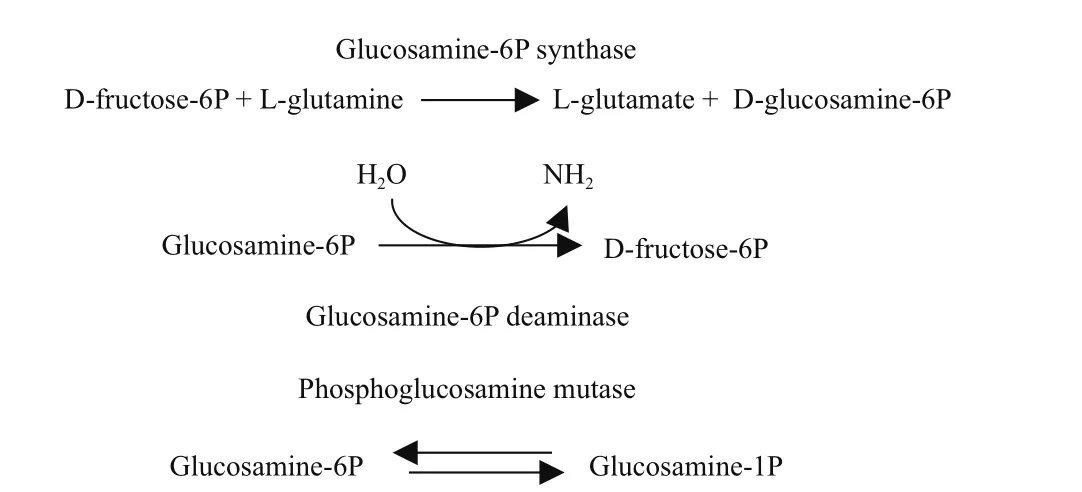
图2 磷酸氨基葡萄糖合酶、磷酸氨基葡萄糖脱胺酶 及磷酸氨基葡萄糖变位酶的催化反应
2 霉菌发酵产GlcN
用于GlcN发酵研究的霉菌包括根霉、毛霉及曲霉。霉菌是真菌的一个大类,霉菌细胞壁中的几丁质含量相对较高,因而霉菌成为GlcN研究的重要菌种。据相关报道,野生型的毛霉(Monascus pilosus)发酵产GlcN的量只有264 mg/L[1]。但由于运用野生型菌株进行发酵生产具有稳定性好,发酵条件易控制等优势,使得霉菌发酵产GlcN的研究得到重视。研究表明曲霉(Aspergillussp.BCRC31742)、毛霉(Monascus pilosusBCRC31527)及根霉(Rhizopus oligosorusBCRC 31996)产GlcN的能力逐步递减,对发酵条件进行优化后Aspergillussp.BCRC31742产GlcN的量可达到3.43 g/L[1]。所以Aspergillussp.BCRC31742被广泛用作发酵产GlcN的原始菌株。在霉菌发酵过程中,由于菌丝球会使发酵液黏度增大,搅拌速度与溶氧率就变得至关重要,因其直接影响氧的传递及发酵产物的量[28,29]。Zhang等[28]以Aspergillussp.BCRC31742为发酵菌株,研究了溶氧对GlcN产量的影响。通过对不同溶氧条件下产
GlcN的动力学分析,发现通过二级溶氧控制,可有效提高GlcN的产量。不但溶氧能够影响发酵产物的水平,发酵时菌丝体形态及刺激因子也会对发酵过程产生较大影响。相关研究通过对Aspergillussp.BCRC31742菌株进行产GlcN深层发酵,控制霉菌菌丝球的大小与刺激因子的种类提高了GlcN的产量,在菌丝球直径为2.15 mm,50 mL装液量(250 mL发酵摇瓶),30℃,200 r/min.,pH7.0 条件下发酵5天,最高生物量达到33.82 g/L,GlcN的浓度达到7.05 g/L[30]。并发现甲醇相对于谷氨酸、放线菌酮及乙醇对GlcN的产量具有明显的提升作用,当甲醇的添加量为1.5%(V/V)时,GlcN的最大浓度达到7.48 g/L[30]。在提取工艺方面,利用霉菌发酵产GlcN的提取过程是对霉菌发酵产生的含有大量几丁质的菌丝体进行酸碱降解,获得游离的GlcN,所以此过程的关键是控制好酸水解过程[31](图3)。但在菌丝体处理过程中,涉及到酸与碱的使用,酸与碱的过量使用会对环境造成不利影响。使用几丁质酶代替酸碱处理成为越来越迫切的需要。表1列出了近些年霉菌发酵产GlcN研究的部分成果。Aspergillussp.BCRC31742作为重要的产GlcN菌株,随着研究的深入,有望成为高产GlcN的优良工业菌株。

图3 霉菌发酵产GlcN的菌丝体处理流程
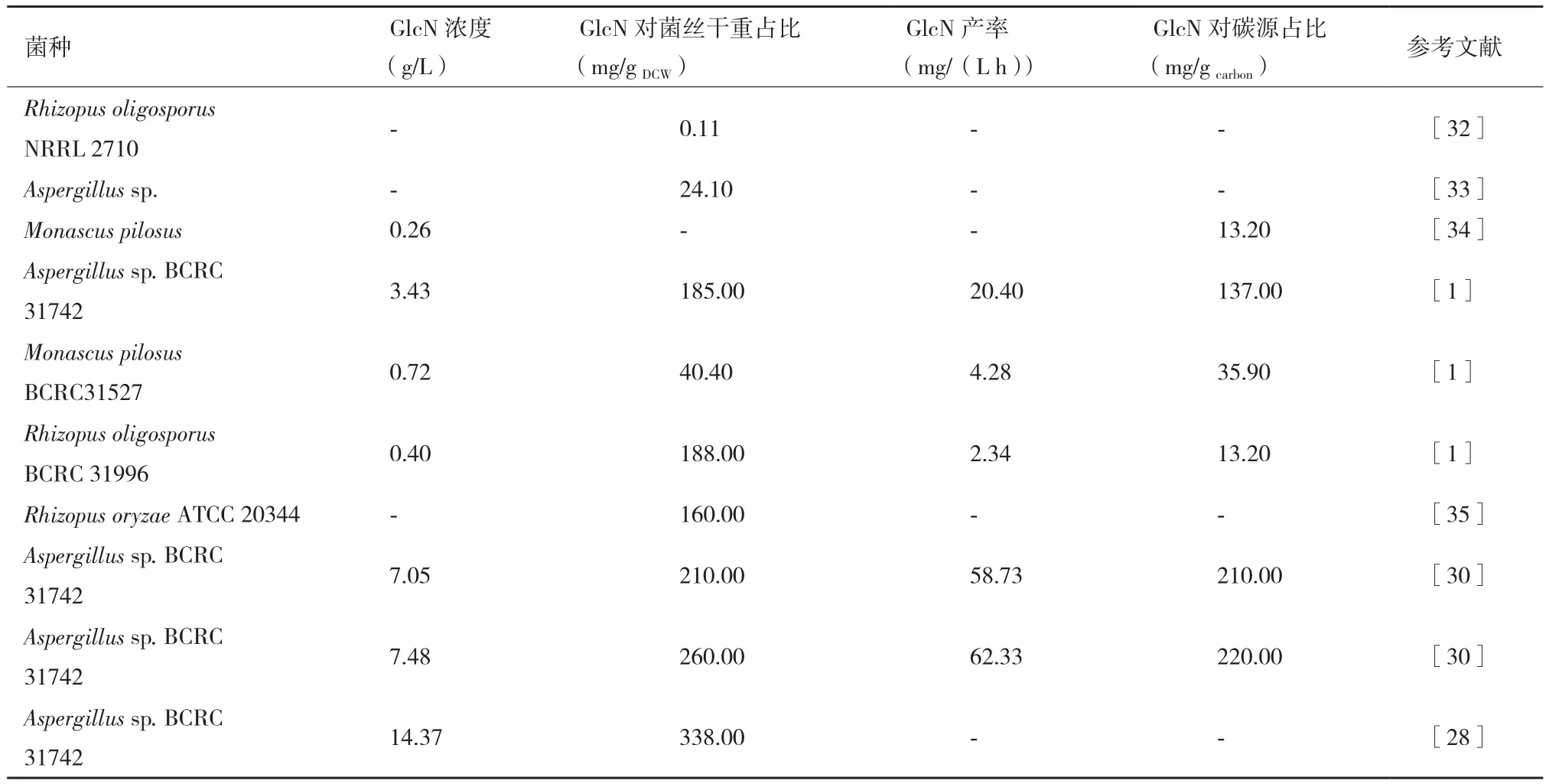
表1 霉菌发酵产GlcN的研究
3 大肠杆菌高产GlcN工程菌的构建及发酵
就目前发酵法生产GlcN的研究状况来看,工程菌发酵在产量上相对于野生菌具有明显优势。研究者已对大肠杆菌进行了构建工程菌研究,并对大肠杆菌中氨基糖代谢途径、代谢过程中涉及的酶及对应的编码基因进行了深入研究[26](图4)。
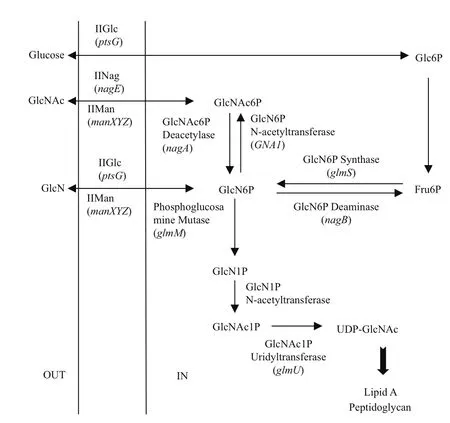
图4 大肠杆菌中GlcN的代谢途径
通过对大肠杆菌氨基己糖代谢途径进行修饰,即对酶的编码基因进行过量表达、失活或敲除处理,构建高产GlcN的工程菌,可以有效提高GlcN的产量。由于GlcN6P强烈抑制glmS的活性,且若在胞内大量积累则对细胞有毒害作用,而GlcNAc的性质较稳定,对代谢过程无抑制作用,在酸性条件下可水解为GlcN,所以在胞内过量表达GNA1,使GlcNAc大量积累,再对GlcNAc进行酸水解处理,即可获得GlcN。Deng等[26]通过过量表达glmS及对分解代谢基因nagB进行失活处理将GlcN的产量提高到17 g/L,并研究了酿酒酵母(Saccharomyces cerevisiae)的GNA1在大肠杆菌中的过量表达,使GlcNAc产量达到110 g/L以上。同时,研究发现GlcN与 GlcNAc从胞外向胞内转运依靠的是甘露糖磷酸转移系统(IIMan,mannose transporter),由manXYZ操纵子编码。manXYZ操纵子由 X、Y和Z 三个基因构成,其中manX的缺失对甘露糖特异性磷酸转移复合酶活性影响较大。如果将manX从基因组中敲除可阻断GlcN与 GlcNAc从胞外向胞内转运,提高GlcN与 GlcNAc在胞外的积累量[15,26]。国内江南大学的陈欣等[14]将glmS与GNA1导入大肠杆菌过量表达,获得了一株高产GlcN及GlcNAc工程菌,并运用Red同源重组技术敲除nagE与manX,研究其对发酵产GlcN的影响。nagE与manX双基因敲除菌株培养10 h后,GlcN 产量达到最大值 4.82 g/L,GlcNAc 产量达到最大值 118.78 g/L。这表明nagE与manX基因的敲除可显著降低 GlcN与GlcNAc 向胞内的转运,提高GlcN与GlcNAc在胞外的量积量[14]。在提取工艺方面,利用工程菌发酵生产GlcN的提取方法与霉菌发酵的提取方法的区别在于工程菌发酵产生的GlcN与GlcNAc存在于发酵液中。利用离子交换法从发酵液中提取GlcN被认为是较理想的方法[36,37]。表2概括
了近几年国内外工程菌发酵产GlcN的研究状况,相信随着研究的深入,GlcN的产量还将得到大幅提高。

表2 工程菌发酵产GlcN的研究*
4 展望
目前,发酵法产GlcN的研究集中在霉菌发酵与重组大肠杆菌研究上,已对Aspergillussp.BCRC31742菌株发酵产GlcN进行了深入的研究,并且国内外已构建成功了几株高产GlcN的大肠杆菌工程菌。笔者认为今后的研究重点主要有以下几个方面,第一,有效利用现有的Aspergillussp.BCRC31742菌株进行微生物代谢工程研究,如利用基因工程技术对菌种代谢过程进行控制,将酿酒酵母中的GFA1整合到Aspergillussp.BCRC31742的基因组中,从而有效提高GlcN的产量。第二,对Aspergillussp.BCRC31742菌株进行诱变研究,以HNO2-UV与UV-5BU复合处理,筛选出优良的适合工业生产的GlcN产生菌。第三,现有的大肠杆菌工程菌在GlcN的产量上表现出明显优势,有必要加大对大肠杆菌基因工程菌的研究,如在原有高产GlcN工程菌内过量表达磷酸葡萄糖异构酶,催化糖酵解途径中的Glc6P大量转化为Fru6P,使过量的Fru6P流入GlcN合成途径,进一步提高GlcN的产量。但大肠杆菌不是公认的安全生产菌种,且易受噬菌体感染。所以,枯草芽孢杆菌工程菌与酿酒酵母工程菌将成为GlcN研究的重要方向。第四,重视GlcN发酵的下游提取工艺研究,提高GlcN的得率与纯度。相信随着市场对GlcN需求量不断增加,人们环保意识逐步增强,微生物发酵法生产GlcN的研究将受到越来越多的关注。随着研究的深入,微生物发酵法将会成为最有前景的GlcN工业化生产方法。
[1] Hsieh JW, Wu HS, Wei YH, et al. Determination and kinetics of producing glucosamine using fungi[J].Biotechnology Progress, 2007, 23(5):1009-1016.
[2] Deng MD, Severson DK, Grund AD, et al. Metabolic engineering of Escherichia coli for industrial production of glucosamine and N-acetylglucosamine[J].Metabo Eng, 2005, 7(3):201-214.
[3] Subramanyam C, Rao SLN. An enzymic method for the determination of chitin and chitosan in fungal cell walls[J].Journal of Biosciences, 1987, 12(2):125-129.
[4] Dahmer S, Schiller RM. Glucosamine[J].American Family Physician, 2008, 78(4):471-476.
[5] Anderson JW, Nicolosi RJ. Glucosamine effects in humans:a review of effects on glucose metabolism, side effects, safety considerations and efficacy[J].Food Chem Toxicol, 2005, 43(3):187-201.
[6] Reginster JY, Deroisy R, Rovati LC, et al. Long-term effects of glucosamine sulphate on osteoarthritis progression:a randomised, placebo-controlled clinical trial[J]. Lancet, 2001, 357:251-256.
[7] Nakanura H.Application of glucosamine on human disease—Osteoarthritis[J].Carbohydrate Polymers, 2011, 84(2):835-839.
[8] Mennini T.Controversy on glucosamine[J].Nutrafoods, 2012, 11:37-41.
[9] Sachadyn P, Jedrzejczak R, Milewski S, et al. Purification to homogeneity of Candida albicans glucosamine-6-phosphate synthase overexpressed in Escherichia coli[J].Protein Expression and Purification, 2000, 19(3):343-349.
[10] Teplyakov A, Leriche C, Obmolova G, et al. From Lobry de Bruyn to enzyme-catalyzed ammonia channelling:molecular studies of D-glucosamine-6P synthase[J].Nat Prod Rep, 2002, 19:60-69.
[11] Sashiwa H, Fujishima S, Yamano N. Production of N-acetyl-D-glucosamine from α-chitin by crude enzymes from Aeromonas hydrophila H-2330[J].Carbohydr Res, 2002, 337(8):761-763.
[12] Kuk JH, Jung WJ, Jo GH. Production of N-acetyl-β-D-glucosamine from chitin by Aeromonas sp. GJ-18 crude enzyme[J].Applied Microbiology and Biotechnology, 2005, 68(3):384-389.
[13] Donzelli BG, Ostroff G, Harman GE. Enhanced enzymatic hydrolysis of langostino shell chitin with mixtures of enzymes from bacterial and fungal sources[J].Carbohydrate Research, 2003, 338(18):1823-1833.
[14] 陈欣, 刘龙, 李江华, 等. Red同源重组敲除nagE和manX对大肠杆菌发酵生产氨基葡萄糖的影响[J].生物工程学报, 2012, 28(3):305-319.
[15] Durand P, Golinelli-Pimpaneau B, Mouilleron S, et al. Highlights of glucosamine-6P synthase catalysis[J]. Archives of Biochemistry and Biophysics, 2008, 474(2):302-317.
[16] Chevreux G, Atmanene C, Lopez P, et al. Monitoring the dynamics of monomer exchange using electrospray mass spectrometry:the case of the dimeric glucosamiine-6-phosphate synthase[J]. American Society for Mass Spectrometry, 2011, 22(7):431-439.
[17] Mouilleron S, Badet-Denisot MA, Golinelli-Pimpaneau B. Glutamine binding opens the ammonia channel and activates glucosamine-6P synthase[J]. J Biolo Chem, 2006, 281(7):4404-4412.
[18] Uhde A, Youn JW, Maeda T, et al. Glucosamine as carbon source for amino acid-producing Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2013, 97(4):1679-1687.
[19] Tanaka T, Takahashi F, Fukui T, et al. Characterization of a novel glucosamine-6-phosphate deaminase from a Hyperthermophilic Archaeon[J]. J Bacteriol, 2005, 187(20):7038-7044.
[20] Vincent F, Davies GJ, Brannigan JA. Structure and kinetics of a monomeric glucosamine 6-phosphate deaminase[J].The Journal of Biologcal Chemistry, 2005, 280(20):19649-19655.
[21] Hu GJ, Li LF, Li D, et al. Protein preparation and preliminary X-ray crystallographic analysis of a putative glucosamine 6-phosphate deaminase from Streptococcus mutants[J]. Structural Biology and Crystallization Communications, 2007, 63(9):809-811.
[22] Barreteau H, Kovac A, Boniface A, et al. Cytoplasmic steps of peptidoglycan biosynthesis[J].FEMS Microbiology Reviews, 2008, 32(2):168-207.
[23] Mehra-Chaudhary R, Mick J, Beamer LJ. Crystal Structure of Bacillus anthracis phosphoglucosamine mutase, an enzyme in the peptidoglycan biosynthetic pathway[J]. Journal of Bacteriology, 2011, 193(16):4081-4087.
[24] Shimazu K, Takahashi Y, Karibe H, et al. Contribution of phosphoglucosamine mutase to determination of bacterial cell morphology in Streptococcus gordonii[J]. Odontology, 2012, 100(1):28-33.
[25] Mehra-Chaudhary R, Mick J, Tanner JJ, et al.Quaternary structure, conformational variability and global motions of phosphoglucosamine mutase[J]. FEBS Journal, 2011, 278(18):3298-3307.
[26] Deng MD, Wassink S, Grunda A. Engineering a new pathway for N-acetylglucosamine production-coupling a catabolic enzyme, glucosamine-6-phosphate deaminase, with a biosynthetic enzyme, glucosamine-6-phosphate N-acetyltransferase[J]. Enzyme and Microbial Technology, 2006, 39(4):828-834.
[27] 姜天翼, 李理想, 马翠卿, 等.微生物细胞工厂中多基因表达的控制策略[J].生物工程学报, 2010, 26(10):1419-1425.
[28] Zhang JX, Liu L, Li JH, et al. Enhanced glucosamine production by Aspergillus sp. BCRC 31742 based on the time-variant kinetics analysis of dissolved oxygen level[J].Bioresource Technology, 2012, 111(6):507-511.
[29] Bodizs L, Titica M, Faria N, et al. Oxygen control for an industrial pilot-scale fed-batch filamentous fungal fermentation[J].Journal of Process Control, 2007, 17(7):595-606.
[30] Sitanggang AB, Wu HS, Wang S, et al. Effect of pellet size and stimulating factor on the glucosamine production using Aspergillus sp. BCRC 31742[J].Bioresour Technol, 2010, 101:3595-3601.
[31] Einbu A, Varum KM. Characterization of chitin and its hydrolysis to GlcNAc and GlcN[J]. Biomacromolecules, 2008, 9(7):1870-1875.
[32] Sparringa RA, Owens JD. Short communication:glucosamine content of tempe mould, Rhizopus oligosporus[J].International Journal of Microbiology, 1999, 47(2):153-157.
[33] Carter SB, Nokes SE, Crofcheck CL, et al.The in uence of environmental temperature and substrate initial moisture content on Aspergillus niger growth and phytase production in solid state cultivation[J].Transactions of the American Society of Agricultural Engineers, 2004, 47(6):945-949.
[34] Yu KW, Kim YS, Shin KS, et al. Macrophage stimulating activity of exo-biopolymer from cultured rice bran with Monascus pilosus[J]. Applied Biochemistry and Biotechnology, 2005, 126(4):35-48.
[35] Liao W, Liu Y, Frear C, et al. Co-production of fumaric acid and chitin from a nitrogen-rich lignocellulosic material-dairy manure using a pelletized filamentous fungus Rhizopus oryzae ATCC 2034[J].Bioresource Technology, 2008, 99(2):5859-5866.
[36] 梁芳, 刘龙, 李江华, 等.离子交换法纯化氨基葡萄糖[J].食品与发酵工业, 2012, 38(5):213-217.
[37] Chmielowski RA, Wu HS, Wang SS. Scale-up of upstream and downstream operations for the production of glucosamine using microbial fermentation[J].Biotechnol J, 2007, 2(2):996-1006.
[38] Chen X, Liu L, Li JH, et al. Improved glucosamine and N-acetylglucosamine production by an engineered Escherichia coli via step-wise regulation of dissolved oxygen level[J].Bioresource Technology, 2012, 110(2):534-538.
[39] Chen X, Liu L, Li JH, et al. Optimization of glucose feeding approaches for enhanced glucosamine and N-acetylglucosamine production by an engineered Escherichia coli[J]. J Ind Microbiol Biotechnol, 2012, 39(2):359-365.
(责任编辑 狄艳红)
Review on Research Progresses in the Fermentation Methods to Produce Glucosamine
Wang Sheng Li Piwu Liu Dianlei Li Yiming Lin Jingjing
(Shandong Provincial Key Laboratory of Microbial Engineering,School of Food and Bioengineering, Qilu University of Technology Ji’nan 250353)
Glucosamine(GlcN)is an important hexosamine. It is formed by one hydroxyl group of glucose substituted by amino and has an effective role in the treatment of rheumatoid arthritis in the cartilage tissue. Besides, it is regarded as the natural harmless ingredients for food and health products. Currently, the methods for the production of GlcN include acid hydrolysis, enzymatic hydrolysis and microbial fermentation. For acid hydrolysis and enzymatic hydrolysis to product GlcN can lead to some adverse effects, such as environmental pollution, microbial fermentation is getting more attention from researchers. This overview focused on the biosynthetic pathway of microbial metabolism, microbial production of GlcN, and the direction of research for GlcN fermentation.
Glucosamine Biosynthetic pathway Microbial fermentation
国家“863计划”项目(2012AA021504)
王升,男,硕士研究生,研究方向:发酵工程;E-mail:wangshengshow@sina.com
李丕武,男,副教授,研究方向:发酵工程;E-mail:piwuli@126.com

