柚皮果胶理化性质的研究
田宝明,彭 林,吴金松,李 俊,刘 雄,王倩倩
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆400715)
柚皮果胶理化性质的研究
田宝明,彭 林,吴金松,李 俊,刘 雄*,王倩倩
(西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆400715)
以柚皮干粉为原料提取果胶,采用正交实验优化柚皮果胶提取工艺,并对其理化性质进行检测。研究表明在提取温度100℃,pH2.0,时间60min,料液比1∶50(g/mL)的条件下柚皮果胶的得率最高,为27.06%,纯度达84.3%,酯化度为73.75%,所得果胶为淡黄色。常温下pH为4.86,属于酸性高酯果胶。柚皮果胶的溶解度随温度升高而增大、随着pH增大,溶解度有下降的趋势;柚皮果胶的热稳定性优于商品果胶,但随着时间增加迅速降低,15min后趋于稳定;柚皮果胶粘度与果胶浓度和蔗糖浓度的正相关,随pH的增大和温度的升高而下降;柚皮果胶理化性质与商品柑橘果胶相似,柚皮果胶的粘度和乳化性能优于商品柑橘果胶。实验结果表明柚皮果胶是一种优质的果胶。
柚皮,果胶,提取率,理化性质
柚(Citrus grandis)是芸香科柑橘亚科柑橘属水果,在我国福建、江西、广东、广西等南方地区大量种植,柚皮是柚子加工所产生的副产品,占整个柚子的43%~48%,除含有水分、矿物质、维生素等体必需的营养要素外,还含有多种对人体健康有益的非营养性生理活性物质[1]。柚皮通常被直接丢弃,资源浪费严重且污染环境,开展柚皮渣的综合利用,不仅可以提高原料的综合利用率,降低生产成本,而且可以减少环境污染,具有良好的社会效益和经济效益。目前,国外用柚皮提取膳食纤维[2-3]、制备重金属离子吸附剂[4-5]、制作成糖果和吸附碱性染料[6]。国内已有柚皮果胶[7-8]、纤维素[9-10]、柚皮甙[8]、黄酮及其他活性物质的提取以及柚皮纤维素改性方面的研究[10-11],如王凤舞等[12]用超声波辅助法提取柚皮果胶提取率为17.13%,余先纯等[13]用超声波联合果胶酸酶提取柚皮果胶,柚皮果胶的平均提取量236.2mg/g,但应用于实际生产的还较少。
果胶是一种重要的水溶性膳食纤维,作为天然的功能因子添加到食品中不仅可以起到稳定剂、乳化剂、增稠剂的作用,还可以降血糖、降血脂、降胆固醇等,商品果胶主要从柑橘渣、苹果渣等原料中提取,对柚皮果胶的提取工艺研究很多,而对柚皮果胶性质方面的系统研究鲜有报道。本研究以梁平柚皮为原料制备干粉,采用酸水解乙醇沉淀法来制备柚皮果胶,对柚皮果胶的基本成分、色差值、粘度、热稳定性、溶解度、乳化性等进行研究,以期为柚皮果胶的商品化应用提供理论指导。
1 材料与方法
1.1 材料与仪器
梁平柚柚皮 北碚市场收集;商品柑橘果胶 浙江省衢州果胶有限公司(纯度80%);半乳糖醛酸色谱纯 Sigma北京拜尔迪生物公司;氢氧化钠(固体)、硫酸、咔唑、氯化钙、氯化钠、乙酸乙酯、无水乙醇 成都市科龙化工试剂厂;盐酸、高氯酸 重庆川东化工有限公司;金龙鱼大豆油 益海嘉里(重庆)粮油有限公司;以上试剂 均为分析纯或食品级。
PF6-3原子吸收分光光度仪 北京普析公司;UltraScan色差仪 HunterLab;FM200均质机 上海弗鲁克流体机械制造有限公司;SHZ-Ⅱ循环水真空抽滤机、RE52CS-1旋转蒸发仪 上海亚荣生化仪器厂;PHS-3精密酸度计 上海大普仪器有限公司;centrifuge 5810台式高速离心机 德国艾本德股份公司;NDJ-5S数字式粘度计 上海精天电子仪器有限公司。
1.2 实验方法
1.2.1 柚皮果胶提取工艺 除去油胞层的干柚皮95℃热水灭酶10min,蒸馏水反复漂洗(尽可能除去色素、苦味、糖分等)用干燥箱以105℃烘干,粉碎过45目筛,用4倍体积于样品的乙酸乙酯或汽油在25℃下浸泡实验样品3h,用蒸馏水清洗出残留有机溶剂,抽滤,清洗,烘干(102℃),得脱脂柚皮干粉。
取5g柚皮干粉按不同料液比加入蒸馏水,用1mol/L盐酸调节pH,在一定温度下水浴搅拌提取一定时间,重复提取3次,用四层纱布过滤,滤液用旋转蒸发仪浓缩后加入等体积的无水乙醇充分搅拌溶解,静置30min,用1mol/L NaOH调节pH为7,过滤后滤渣用70%~80%的乙醇洗涤3次,5000r/min离心6min,将果胶置于55℃电热恒温鼓风干燥箱中干燥至恒重,称量。计算公式为:提取率(%)=提取果胶的质量(g)/柚皮干粉的质量(g)×100。
1.2.2 果胶提取工艺的优化 在已有研究[14-15]单因素实验的基础上,以提取率为指标,选择提取温度(A)、pH(B)、提取时间(C)、料液比(D)4因素,每个因素3个水平设计正交实验L9(34)见表1,考察各因素对提取率的影响。

表1 L9(34)正交实验因素水平表Table 1 Factors and levels in the L9(34)orthogonal array design
1.2.3 柚皮果胶的理化指标
1.2.3.1 柚皮果胶的成分测定 根据QB2484-2000果胶产品质量指标法规定,测定柚皮果胶和商品柑橘果胶的干燥失重、粗灰分、酯化度、总半乳糖醛酸、盐酸不溶物和pH;根据GB/T5009.11-2003、GB/ T5009.12-2003、GB/T5009.5-2003、GB/T5009.6-2003分别测定砷、铅、蛋白质、脂肪的含量。
1.2.3.2 柚皮果胶色差值的测定 使用UltraScan色差仪,仪器采用标准白瓷板外部校准,用三色协调系统L*、a*、b*表示颜色。分别测定柚皮果胶和商品柑橘果胶的颜色,Averaging mode测定每个样品的L*、a*、b*值,每个样品读数5次,取平均值。
1.2.3.3 柚皮果胶溶解度的测定 a.温度对柚皮果胶溶解度影响的测定:分别称取0.5g柚皮果胶和商品柑橘果胶置于不同的烧杯中,加入50mL蒸馏水溶解,搅拌混匀,分别在20、40、60、80、100℃水浴下充分搅拌30min后取出,3000r/min离心20min,将上清液倒入已恒重的铝盒中,90℃的水浴蒸干,于烘箱中105℃烘干至恒重。
b.pH对柚皮果胶溶解度影响的测定:参照a中的前处理方法,溶解后用0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液把样品溶液的pH分别调至2、4、6、8和10,计算果胶的溶解度,如式(1)所示:

式中:M1:上清液烘干至恒重的重量,g;M2:果胶样品干重,g。
1.2.3.4 柚皮果胶热稳定性的测定 在两组具塞试管(每组7支)中,分别加入浓度为2%的柚皮果胶和2%的商品柑橘果胶溶液,密封后放入95℃的烘箱中。分别于0、5、10、15、20、30、60min取出具塞试管,利用粘度计测其相对粘度,记录数值并绘制热稳定性曲线。
1.2.3.5 柚皮果胶粘流性能的测定 粘流性能常用粘度来衡量,本实验研究浓度、温度、pH、添加剂对果胶粘度的影响。分别称取一定量的柚皮果胶和商品柑橘果胶配制果胶溶液,研究不同的添加剂(浓度为0%、10%、20%、30%、40%、50%、60%的蔗糖和0%、10%、20%、30%、40%、50%、60%的氯化钙)、果胶浓度(0.5%、1%、1.5%、2%、2.5%和3%)、pH(pH为2、4、6、8、10和12)、温度(30、40、60、80、100℃)对果胶粘度的影响。
1.2.3.6 柚皮果胶乳化性的测定 参照Yapo等[16]的方法对果胶乳化液的乳化活性(EA)和乳化稳定性(ES)进行测定。将一定体积(V1)的新鲜乳化液置于透明带刻度试管中。室温下3000r/min离心5min。记录初始乳脂层的体积V2;将上述离心后的乳化液室温下放置7d,于室温3000r/min离心5min,记录最终乳脂层体积V3,按式(2)、式(3)计算EA和ES:

1.3 统计分析
所有实验组进行3次平行实验,根据3次实验结果计算相应的标准偏差。结果以均值或均值±标准偏差的形式表示,并通过Origin软件对结果进行统计分析。
2 结果与分析
2.1 果胶酸法提取工艺的确定
正交实验结果与极差分析见表2,由极差分析结果可知,以柚皮果胶提取率为指标,4个影响因素的主次关系为B>A>D>C,即pH>提取温度>料液比>提取时间,从而可选取出最优组合为A3B2C2D3,据此确定柚皮果胶提取的最佳条件为pH为2,提取温度100℃,料液比1∶50(g/mL),提取时间60min。在上述最优条件下,3次验证实验得到的柚皮果胶提取率均值为27.06%,高于表2中其他组合的提取率,表明其重复性较好。

表2 L9(34)正交实验设计结果Table 2 The L9(34)orthogonal array design matrix and experimental results
2.2 柚皮果胶的理化性质
2.2.1 柚皮果胶基本成分及表观鉴定 参照QB2484-2000国家标准对果胶进行表观鉴别,结果提取的柚皮果胶符合果胶的表观特征。
从表3可以看出,所提取的柚皮果胶的各项指标均符合QB/T2484-2000对商品果胶的规定,除柚皮果胶的总灰分较大外,其余指标均优于商品柑橘果胶,灰分大可能由于调pH时混入小分子盐,从而使灰分增大。其中酯化度为73.75%,属于高酯果胶,柚皮果胶的酯化度比柑橘果胶高6.96%,果胶溶液的比粘度和胶凝能力优于柑橘果胶;常温下的pH为4.86,属于酸性可溶性膳食纤维,与QB/T2484-2000上高酯果胶pH不同的原因是提取中调pH的原因,而GB25533-2010没有对pH作要求,若省略调pH步骤测得pH为2.69,柚皮果胶的粗蛋白和脂肪含量比较高。
2.2.2 柚皮果胶的色差值 GB25533-2010中规定标准果胶应为白色、淡黄色、浅灰色或浅棕色粉末,一般来说,果胶颜色越白其商业价值就越高,本实验所提取的果胶为淡黄色粉末。由表4可知,将所提取的柚皮果胶与商品柑橘果胶相比较,柚皮果胶的L*值明显大于商品柑橘果胶,说明柚皮果胶的亮度比商品柑橘果胶好;而a*值和b*值均明显低于商品柑橘果胶,说明商品柑橘果胶颜色偏红、偏黄,而所提取的柚皮果胶相比颜色较浅,为淡黄色。若洗涤次数增多,颜色会逐渐变白,但会增加提取果胶成本。

表4 柚皮果胶的色差值Table 4 Colour and aberration analyse of the pomelo peel pectin

表3 柚皮果胶和柑橘果胶的基本成分对照表Table 3 The comparison index of ingredient of the pectin from pomelo peel and citrus
2.2.3 柚皮果胶的溶解度
2.2.3.1 温度对柚皮果胶溶解度的影响 由图1可知,同温度下柚皮果胶的溶解度小于商品柑橘果胶的溶解度。这可能是柚皮果胶在干燥过程中,果胶分子逐渐靠近,分子间的羟基和羟基、羧基和羧基、羧基和羟基形成氢键作用,使干燥后的果胶分子间作用力大大增加,水分子与果胶分子的作用力不易破坏果胶大分子间的相互作用力,从而使果胶的溶解度降低。
随着温度的升高,柚皮果胶和商品柑橘果胶的溶解度均有所上升,且柚皮果胶的上升趋势更为明显。因为柑橘果胶在常温下溶解的比较完全,所以温度对其影响不大,而柚皮果胶在常温下溶解度较小,当温度升高时能够加速破坏其多糖分子间的氢键作用,增加柚皮果胶的溶解度。此外,样品的粉碎程度以及干燥时间也会影响果胶的溶解度[17]。
2.2.3.2 pH对柚皮果胶溶解度的影响 由图2可知,随着pH的增大,柚皮果胶的溶解度下降的趋势很明显,而商品果胶随pH的增加有增加的趋势。pH=2时溶解度为84%,略高于商品果胶,当pH>2.1时,柑橘果胶的溶解度大于柚皮果胶。可能是由于柚皮果胶的组成中含有大量酸溶性的原果胶,原果胶在pH较大的溶液中不易溶解。而商品柑橘果胶的溶解度随着pH的增大呈上升的趋势,是因为柑橘果胶在溶液中呈弱酸性,随着pH的增大,OH-离子增加,使果胶的电离度增大,从而增大了果胶的溶解度。
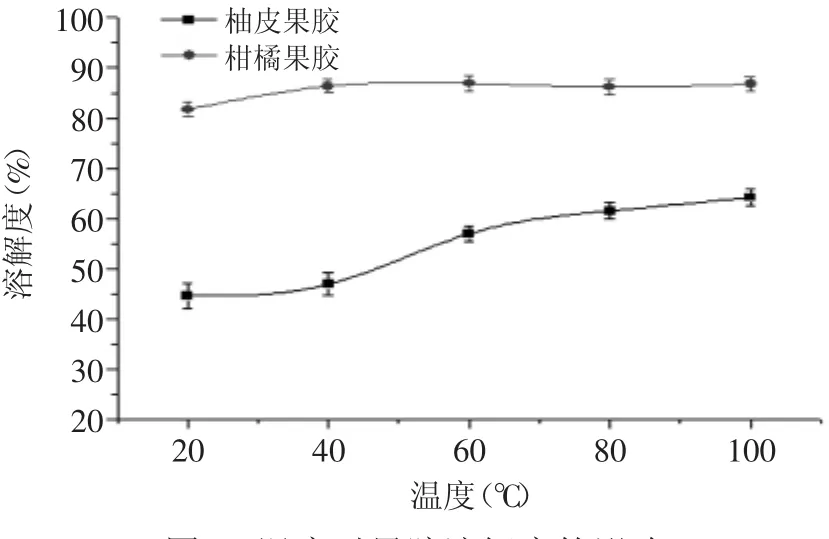
图1 温度对果胶溶解度的影响Fig.1 Effect of temperature on the solubility of the pectin
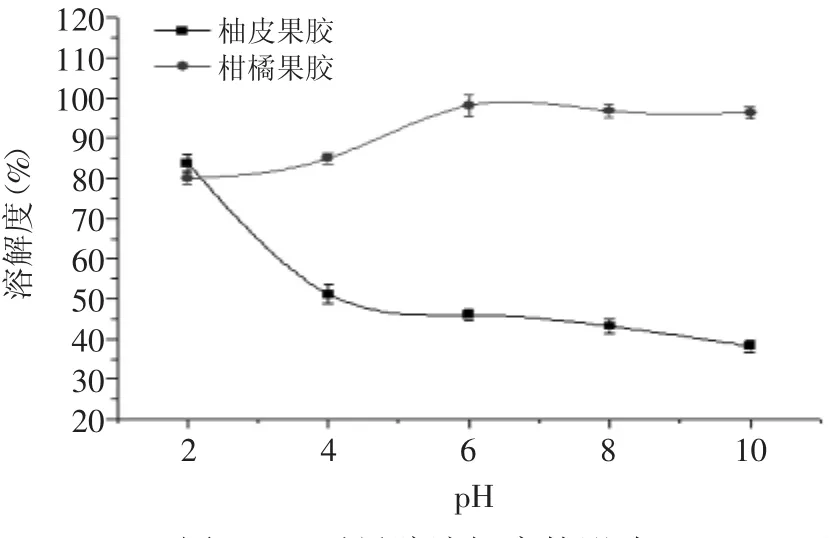
图2 pH对果胶溶解度的影响Fig.2 Effect of pH value on the solubility of the pectin
2.2.4 柚皮果胶的热稳定性 相对粘度可在一定程度上反映物质的热稳定性。由图3可知,柚皮果胶在热力作用下,粘度迅速下降,大约15min后果胶的粘度趋于平缓。而柑橘果胶的受温度的影响较小,常温下基本没有变化。可能在进行热力处理开始的几分钟,热力破坏了果胶分子链的交联作用,增大了分子间分散度,从而导致粘度迅速下降,当热力作用达到一定时间后不再对果胶的分子结构产生影响,粘度趋于稳定。
2.2.5 柚皮果胶的粘度
2.2.5.1 浓度对柚皮果胶粘度的影响 由图4可以看出,两种果胶的粘度均随果胶浓度的增大呈近似直线状增加;果胶浓度相同时,柚皮果胶的粘度更大。一方面,果胶是长链大分子物质,具有较强的分子间作用力,果胶浓度的增大使分子链间的氢键和疏水作用发生的机率变大,发生交联作用形成结构复杂的聚合物,导致果胶粘度变大;另一方面,随着浓度的增大,其活化能增大,增加了流体流动的阻力,导致果胶的流动性变差[18]。

图3 95℃下处理时间对果胶粘度的影响Fig.3 Effect of time on solution viscisity of the pectin(95℃)

图4 浓度对果胶粘度的影响Fig.4 Effect of viscosity of the pectin under different concentration
2.2.5.2 温度对柚皮果胶粘度的影响 由图5可以看出,相同温度下,柚皮果胶的粘度高于柑橘果胶粘度,如在30℃柚皮果胶的粘度是柑橘果胶的2.04倍。随着温度的升高,柚皮果胶和柑橘果胶的粘度逐渐降低。可能是随着温度的升高,果胶分子链的柔顺程度增强,导致流动能力提高,使果胶粘度下降。也可能是因为热力作用破坏了果胶分子链间的氢键,使分子间斥力增强,电离度减小,交联作用也逐渐减小,导致果胶粘度的减小[19]。
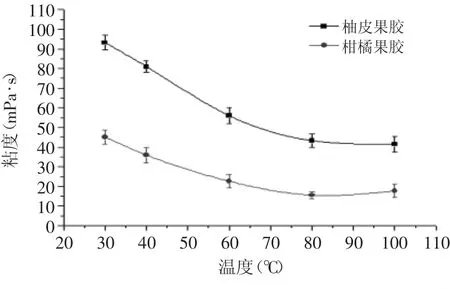
图5 温度对果胶粘度的影响Fig.5 Effect of temperature on viscosity of the pectin
2.2.5.3 pH对柚皮果胶粘度的影响 由图6可以看出,柚皮果胶和商品柑橘果胶的粘度均随pH的增大而逐渐下降,且柚皮果胶的粘度高于柑橘果胶。可能在pH较低时柚皮果胶的溶解度较大,且H+较多时,可以增强分子间氢键的结合,使果胶分子团体积增大,使得溶液粘度增大[19]。而当pH增大时,造成溶液中的OH-增加,一方面OH-与果胶分子相互吸引,使果胶分子发生卷曲,另一方面果胶发生水解,这些原因导致果胶粘度下降,影响果胶质量[20]。

图6 pH对果胶粘度的影响Fig.6 Effect of pH value on viscosity of the pectin
2.2.5.4 添加蔗糖浓度对柚皮果胶粘度的影响 由图7可以看出,柚皮果胶和商品柑橘果胶的粘度均随蔗糖浓度的增加而增加。因为蔗糖含有很多强亲水能力的OH-,蔗糖的竞争作用使果胶的水合作用大大降低,也加剧了果胶分子间的相互作用,另一方面蔗糖可以与果胶分子通过氢建结合,使果胶溶液粘度升高。蔗糖浓度越高,这两方面的作用也越明显,因此粘度随蔗糖浓度的升高而升高。
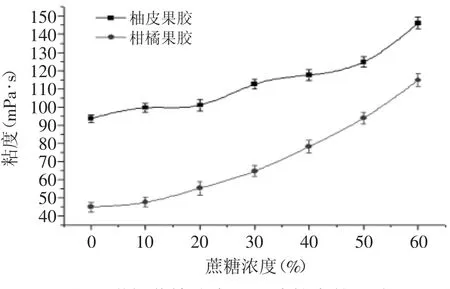
图7 增加蔗糖浓度对果胶粘度的影响Fig.7 Effect of sucrose concentration on viscosity of the pectin
2.2.5.5 添加氯化钙对柚皮果胶粘度的影响 由图8可以看出,柚皮果胶和商品柑橘果胶的粘度随着Ca2+的添加刚开始呈下降的趋势,当钙离子浓度为20%时,柚皮果胶和商品果胶溶液的粘度最低分别为47mPa·s和38mPa·s,然后开始迅速上升,到钙离子大约为40%时粘度达到最大值分别为109mPa·s和57mPa·s,之后粘度又开始下降,但柚皮果胶Ca2+敏感性更强。可能是果胶分子结构中较多的羧酸基团未被甲基化,钙离子与果胶分子间羧基的结合起到桥梁的作用。但随着钙离子浓度的增加,果胶分子链上的羧基通过与大量的Ca2+发生桥联作用,凝聚成较强的网络结构,使得果胶的粘度上升。但是当钙离子的浓度过高时,钙离子反而会破坏果胶分子链之间的桥联作用,造成果胶分子链发生不规则排序,导致果胶溶液粘度的下降[21]。
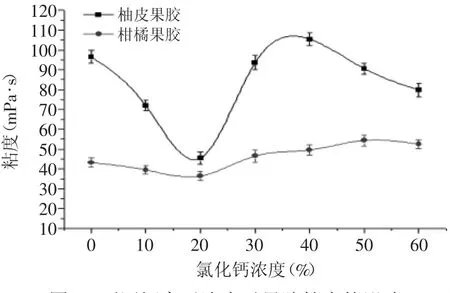
图8 不同钙离子浓度对果胶粘度的影响Fig.8 Effect of different concentration of Ca2+on viscosity of the pectin
2.2.6 柚皮果胶的乳化性能 果胶是水溶性物质且分子量比较大,粘度也较大,能够锁住油脂,大量研究证明果胶具有较强的乳化能力。由表5可知,将所提取的柚皮果胶与商品柑橘果胶的乳化能力相比较,柚皮果胶的乳化活性(EA)和乳化稳定性(ES)均优于商品柑橘果胶,推测其可作为一种新型的乳化剂或乳化稳定剂应用于食品工业中。

表5 柚皮果胶的乳化性能Table 5 Emulsifying property of the pomelo peel pectin
3 结论
利用正交实验优化了柚皮果胶的提取工艺,在提取温度100℃,pH2.0,时间60min,料液比1∶50(g/mL)的条件下柚皮果胶的提取率最高,为27.06%,纯度达84.3%,酯化度为73.75%,属于酸性高酯果胶。柚皮果胶的质量指标优于食品添加剂标准中规定的范围,属于高酯果胶,同时提取的柚皮果胶理化特性与商业果胶基本一致,粘度和乳化性能优于商品柑橘果胶,是一种优质的果胶。本研究结果说明柚皮果胶与国内同类产品相比具有一定的优势,具有较好的商业价值。所以柚子产品加工过程中的柚皮渣等废弃资源可作为很好的提取果胶原料资源,为柚果资源的综合开发利用提供了理论指导。
[1]邓婷婷,刘素纯,贺建华.柚皮提取物有效成分的研究概况[J].中国食物与营养,2008(6):16-19.
[2]Marín F R,Soler-Rivas C,Benavente-García O,et al.By-products from different citrus processes as a source of customized functional fibres[J].Food Chemistry,2007,100(2):736-741.
[3]Figuerola F,Hurtado M L,Estévez A M,et al.Fibre concentrates from apple pomace and citrus peel as potential fibre sources for food enrichment[J].Food Chemistry,2005,91(3):395-401.
[4]Schiewer S,Patil S B.Modeling the effect of pH on biosorption of heavy metals by citrus peels[J].Journal of Hazardous Materials,2008,157(1):8-17.
[5]Schiewer S,Balaria A.Biosorption of Pb2+by original and protonated citrus peels:Equilibrium,kinetics,and mechanism[J]. Chemical Engineering Journal,2009,146(2):211-219.
[6]Hameed B H,Mahmoud D K,Ahmad A L.Sorption of basic dye from aqueous solution by pomelo(Citrus grandis)peel in a batch system[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2008,316(1):78-84.
[7]周尽花,周春山,吴宇雄,等.柚皮果胶的提取方法比较及其粘流性能研究[J].食品科学,2006,27(5):167-171.
[8]黄小茉,陈仪本,欧阳友生,等.柚皮中同时提取柚皮甙和果胶工艺研究[J].现代食品科技,2009,25(11):1286-1290.
[9]罗均,李小定,何旭,等.柚皮纤维素的提取工艺研究[J].食品工业科技,2010,31(4):273-276.
[10]罗均.柚皮纤维素的制备、琥珀酸酐改性及其对重金属离子的吸附性能研究[D].武汉:华中农业大学,2010.
[11]王志丹.柚皮中黄酮类化合物的提取与分离研究[D].长春:东北师范大学,2009.
[12]王凤舞,朴美子.超声波辅助法提取柚皮果胶的工艺研究[J].青岛农业大学学报:自然科学版,2012,29(4):285-288.
[13]余先纯,李湘苏,韩大良,等.超声波联合果胶酸酶提取柚皮果胶的工艺研究[J].食品工业科技,2013,34(1):164-167. [14]储君,王海鸥.乙醇沉淀法提取柚皮果胶的工艺研究[J].安徽农业科学,2008,36(18):7526-7528.
[15]陈发河,吴光斌,陈旭.瑖溪蜜柚果皮中果胶提取工艺优化研究[J].食品科学,2006,27(11):387-390.
[16]Yapo B M,Robert C,Etienne I,et al.Effect of extraction conditions on the yield,purity and surface properties of sugar beet pulp pectin extracts[J].Food Chemistry,2007,100(4):1356-1364.
[17]Kunzek H,Kruse R,Neumann A.Low residue apple processing II.Manufacture of pectin and a low pectin material with cellular structure from stored wet apple pomace[J].Flussiges Obst,1996,63(6):314-319.
[18]Kar F,Arslan N.Effect of temperature and concentration on viscosity of orange peel pectin solutions and intrinsic viscositymolecular weight relationship[J].Carbohydrate Polymers,1999,40(4):277-284.
[19]梅新.甘薯膳食纤维、果胶制备及物化特性研究[D].北京:中国农业科学院农产品加工研究所,2010.
[20]张兆琴,梁瑞红,刘伟,等.橙皮果胶流变学性质的影响因素[J].食品研究与开发,2010,31(1):31-35.
[21]Löfgren C,Guillotin S,Evenbratt H,et al.Effects of calcium,pH,and blockiness on kinetic rheological behavior and microstructure of HM pectin gels[J].Biomacromolecules,2005,6(2):646-652.
Study on physicochemical properties of pomelo peel pectin
TIAN Bao-ming,PENG Lin,WU Jin-song,LI Jun,LIU Xiong*,WANG Qian-qian
(College of Food Science,Southwest University,Chongqing Key Laboratory of Produce Processing and Storage,Chongqing 400715,China)
Taking pomelo peel dried powder as raw material,research of the best process to extract pomelo peel pectin which was conducted through orthogonal experiment and then to study on the physicochemical property of the pectin.It comed to a conclusion that the best condition to extract pomelo peel pectin was in the temperature of 100℃,pH2,60min and the best solid-liquid ratio was 1∶50(g/mL).Under the condition,the yield of pomelo peel pectin was 27.06%.The reseach of the physicochemical property of pomelo peel pectin showed that the purity of pomelo peel pectin was 84.3%,the esterification degree of it was 73.75%.The extracted pectin was yellow,powdery bulky material.Normally,the pH of pomelo peel pectin stayed at 4.86,showed as acidity high-fat pectin,which met the standard of commercial pectin.As the temperature gone up,the solubility went down,and with the pH value gone up,the solubility tended to go down.The thermal stability of pomelo peel pectin better than commercial pectin,but manifested it dropped rapidly along with the time tended to be stable after 15min.Its viscosity went up with the increase of pectin concentration,decreased when pH and temperature went up and rose along with the increase of the concentration of sucrose.The pectin of emulsifying properties and viscosity was superior than citrus pectin.Physicochemical properties of pomelo peel pectin similar to commercial pectin that was a high quality resource.
pomelo peel;pectin;the yield of pomelo peel pectin;physicochemical properties
TS202.3
A
1002-0306(2014)08-0313-06
10.13386/j.issn1002-0306.2014.08.063
2013-10-10 *通讯联系人
田宝明(1987-),男,硕士研究生,研究方向:食品化学与营养学。

