应用响应面法优化黑曲霉固态发酵稻谷壳产木聚糖酶条件
郑虹
(福建师范大学福清分校生物与化学工程系,福建福清350300)
应用响应面法优化黑曲霉固态发酵稻谷壳产木聚糖酶条件
郑虹
(福建师范大学福清分校生物与化学工程系,福建福清350300)
对黑曲霉产木聚糖酶发酵工艺进行优化研究。在单因素实验的基础上,采用Box-Benhnken实验设计,对黑曲霉发酵稻谷壳产木聚糖酶的最佳碳源及其添加量、培养时间、水的添加量进行优化,建立了木聚糖酶产量随蔗糖添加量、培养时间和水的添加量变化的多项二次回归方程,并得到最佳的发酵工艺条件是:培养时间为78h,水的添加量为57%,蔗糖添加量为1.3g时,木聚糖酶的酶活力可达221.5U/g,比优化前提高了1.76倍,预测模型可靠,可利用该模型对黑曲霉产木聚糖酶的最优发酵条件进行理论预测。
黑曲霉,木聚糖酶,固态发酵,Box-Benhnken实验设计
木聚糖酶(Xylanase)是指将木聚糖降解成低聚糖和木糖的一组酶的总称,主要包括外切β-1,4-木聚糖酶,内切β-1,4-木聚糖酶和β-木糖苷酶[1-2],其中内切β-1,4-D-木聚糖酶(endo-β-1,4-D-xylanase)(EC.3.2.1.8)是木聚糖降解酶系中最关键的酶,该酶在饲料、食品、造纸、纺织、医药及能源等领域有着广泛的应用[3-5]。
微生物、动物、植物均能生产木聚糖酶,而微生物由于其生长快、便于提纯,是木聚糖酶的主要来源。目前,自然界中已知能产木聚糖酶的微生物主要有真菌、放线菌、细菌、酵母菌、藻类等[3]。国内研究较多的是木霉、青霉、黑曲霉等霉菌[6-7]。其中由于黑曲霉具有生长迅速、发酵周期短,发酵过程中不产生毒素等优点,在木聚糖酶的大规模生产中备受人们的关注[8]。
在木聚糖酶生产中,麸皮、麦秆、玉米芯、稻秆、甘蔗渣等农业废弃物是常见的木聚糖酶诱导物[9-10],也有人以豆皮[11]为原料对黑曲霉产木聚糖酶的发酵条件进行研究,目前国内研究较多的是以玉米芯、麸皮作为产木聚糖酶的原料[12],而以稻谷壳作为其发酵介质目前还未见报道。本研究以稻谷壳作为黑曲霉产木聚糖酶的培养介质,并在单因素基础上,运用响应面分析方法优化其培养条件,为今后的放大研究提供一定的参考价值。
1 材料与方法
1.1 材料与仪器
黑曲霉 本实验室保藏;斜面培养基 马铃薯琼脂培养基(PDA培养基);液体种子培养基 稻谷壳2g,葡萄糖3g,(NH4)2SO41.5g,KH2PO40.2g,MgSO4·7H2O 0.05g,pH6.0,水100mL;固体发酵培养基 250mL三角瓶中加入10g稻谷壳,再加入10mL蒸馏水,搅拌均匀,121℃灭菌30min。
SPX-150B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;SWCJ-IFD型超净工作台 苏净集团安泰公司;THZ-25型大容量恒温振荡器 太仓市华美生化仪器厂;BS224S电子天平 北京赛多利斯仪器系统有限公司;DZX-40BI型立式自动电热压力蒸汽灭菌器 上海申安医疗器械厂;HH-4型数显恒温水浴锅 国华电器有限公司;H1850R型高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;DHG-9070A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;7200型可见分光光度计 尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 操作流程 4℃冰箱保存的菌株接种于新鲜试管斜面,30℃培养5~7d,加入无菌生理盐水,刮下孢子并稀释至孢子液浓度为107个/mL。取5mL孢子悬液接入100mL种子培养基,30℃120r/min振荡培养3d。再按10%接种量接种于固体发酵培养基,搅拌均匀,30℃静止培养,取样测酶活。
1.2.2 粗酶液的制备 将黑曲霉固态发酵后的培养物在50℃下烘24h后,称取1.0g培养物,加蒸馏水20mL,置于摇床(120r/min,30℃)中浸提1h后,4℃4000r/min离心5min,上清液即为粗酶液。
1.2.3 木聚糖酶活力测定方法 采用DNS法[13-15]。
1.2.3.1 标准曲线的制作 将烘至恒重的木糖用蒸馏水配制成浓度为1mg/mL的母液,4℃冰箱保存。按表1顺序加入各试剂,沸水浴保温5min,迅速冷却至室温,最后定容至25mL。定容后将以上各管溶液混合均匀,用1#管调零点,于λ=540nm处测吸光值,以木糖含量为横坐标,OD540为纵坐标绘制出标准曲线,结果见图1。

表1 木糖标准曲线的制作Table 1 Facture of standard curve of xylose

图1 木糖标准曲线的绘制Fig.1 Standard curve of xylose
1.2.3.2 样品中酶活力的测定 在25mL容量瓶中加入1.8mL 1%木聚糖底物溶液,50℃水浴锅中保温5min后,加入0.2mL适当稀释的酶液,充分混匀,50℃水浴15min,立即加入1.5mL DNS试剂并混合均匀,沸水浴5min显色,迅速冷却,最后以蒸馏水定容至25mL。以灭活酶液为空白管作为对照。测定λ= 540nm处的OD值。每个实验做3个重复,每个重复测3次酶活。
酶活单位定义为:以木聚糖为底物,每分钟释放1μmol相当于木糖的还原糖所需的酶量为一个酶活单位(U)。酶活力计算公式如下:
酶活力(U/g)=W×N×1000/(M×T×V)
式中:W—酶解反应产生的木糖量(mg),从木糖标准曲线上查得;N—酶液稀释倍数;M—木糖分子量,150.13g/mol;T—反应时间(min),15min;V—酶用量(mL),0.2mL。
1.3 实验设计
1.3.1 单因素实验设计
1.3.1.1 不同碳源的单因素实验 在基础固体发酵培养基中分别加入2%的碳源(乳糖、可溶性淀粉、葡萄糖、蔗糖、羧甲基纤维素钠(CMC-Na))。
1.3.1.2 蔗糖添加量的单因素实验 在基础固体发酵培养基中加入不同浓度的蔗糖,100mL发酵培养基中蔗糖含量分别为0.5、1、1.5、2、2.5、3g,取样测酶活。
1.3.1.3 培养时间的单因素实验 制备基础固体发酵培养基,灭菌接种后,30℃恒温培养,每隔12h取样测定发酵物的木聚糖酶含量,即24、36、48、60、72、84、96h取样测定其酶活。
1.3.1.4 水的添加量的单因素实验 配制不同水的添加量的基础固体发酵培养基,水的添加量分别为45%、50%、55%、60%、65%、70%。
1.3.2 响应面实验设计 采用Design Expert 8.05软件设计实验[16-18]。采用Box-Benhnken的中心组合实验设计,在单因素实验基础上,选取蔗糖添加量、培养时间、水的添加量3个因子,设计3因素3水平的响应面分析实验,因素及水平见表2。

表2 响应面实验因素水平表Table 2 Factors and levels of response surface experiment
2 结果与分析
2.1 单因素实验
2.1.1 碳源对黑曲霉产木聚糖酶量的影响 在基础固态发酵培养基中加入不同的碳源,培养72h后测定其酶活,结果见图2。
基础发酵培养基是以稻谷壳作为培养基质,稻谷壳的主要成分是木质素、木纤维,而蛋白质及脂类物质含量较低,高含量的木质素有利于黑曲霉诱导合成木聚糖酶,外加碳源的目的主要是为菌体提供生长养分。由图2可见,添加有2%蔗糖的基础发酵培养基,木聚糖酶的产量最高,可达156.67U/g,而可溶性淀粉的产酶量最低,只有111.70U/g,黑曲霉对几种实验碳源的利用顺序为:蔗糖>葡萄糖>CMC-Na>乳糖>可溶性淀粉。可能是因为黑曲霉对蔗糖、葡萄糖等高效碳源利用率较高,有利于菌体生长,进而有利于木聚糖酶的积累,而黑曲霉对淀粉利用低,菌体生长不好,因此也不利于木聚糖酶的积累。
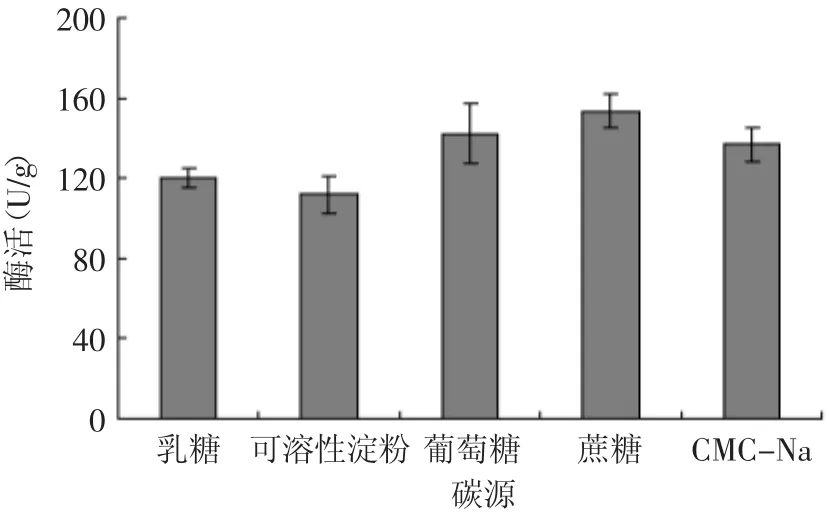
图2 不同碳源对产木聚糖酶的影响Fig.2 Effect of carbon sourse on xylanase production
2.1.2 蔗糖添加量对黑曲霉产木聚糖酶量的影响 在基础固态发酵培养基中加入不同克数的蔗糖,培养72h后测定其酶活,结果见图3。

图3 蔗糖添加量对产木聚糖酶的影响Fig.3 Effect of sucrose concentration on xylanase production
由图3可见,不同浓度的蔗糖添加量对菌株产木聚糖酶有明显的影响,木聚糖酶的产量随蔗糖添加量的增加呈先增后减的趋势,当蔗糖添加为1.5g时,产酶量达到最大值,即162.73U/g。每一种微生物都有自身最适的碳氮源添加量,太高太低都不利于菌体或其代谢产物的产生。太低的蔗糖含量,不利于菌体生长,进而影响微生物合成木聚糖酶,而太高的蔗糖添加量,也不利于木聚糖酶的积累,因此最适的蔗糖添加量为每100mL发酵液中蔗糖添加量为1.5g。
2.1.3 培养时间对黑曲霉产木聚糖酶的影响 在基础固态发酵培养基中接入黑曲霉孢子悬液,分别培养至24、36、48、60、72、84、96h后测定发酵物中木聚糖酶的酶活,实验结果见图4。
微生物积累产物的过程是一个动态的过程,一般产物都是随着培养时间的增加而增加,但是到了培养后期,随着菌体进入衰亡期及营养物质的消耗,产物的积累速度也慢慢减少。由图4可见,木聚糖酶的产量先是随着培养时间的增加而逐渐增加,当培养时间达到72h时,产酶达到最大值,即135.6U/g,之后木聚糖酶产量反而随着培养时间的增加而逐渐下降。故黑曲霉固态发酵稻谷壳产木聚糖酶的最佳培养时间为72h。

图4 培养时间对产木聚糖酶的影响Fig.4 Effect of culture time on xylanase production
2.1.4 水的添加量对黑曲霉产木聚糖酶量的影响 对于固体发酵来说,最主要的影响因素就是发酵培养基的水的添加量,多数固态发酵的水的添加量是控制在30%~85%,太高或太低水的添加量都不利于菌体的生长和产物的积累,因此选择适宜的水的添加量对黑曲霉产木聚糖酶是一个非常重要的因素之一。

图5 不同水的添加量对产木聚糖酶的影响Fig.5 Effect of water content on xylanase production
由图5可见,黑曲霉木聚糖酶的产量随着水的添加量的增加而增加,当水的添加量为55%时,木聚糖酶的酶活达到最高,即146.8U/g,之后,黑曲霉的产酶量反而随着水的添加量的增加而递减。培养基质不同,所需的水的添加量也有很大的差异,本实验所采用的培养基质是稻谷壳,稻谷壳具有较高的通气性,而且比较粗糙,不易吸水,固体培养时需要有一定的湿度,才有利于酶的产生,培养基水的添加量太高或太低都不利于木聚糖酶的产生,因此,黑曲霉固态发酵稻谷壳产木聚糖酶的最佳水的添加量为55%。
2.2 响应面分析法优化发酵工艺
2.2.1 二次回归拟合 根据单因素实验结果,选择蔗糖添加量(X1)、培养时间(X2)、水的添加量(X3)3个因素为变量,木聚糖酶酶活力为响应值Y,设计3因素3水平的响应面分析实验,实验方案及结果见表3。

表3 Box-Benhnken实验设计与结果Table 3 Design and results of Box-Benhnken experimental
利用软件对表3数据进行二次多项回归拟合,获得二次多项回归方程:
Y=216.89-8.32X1+1.33X2+11.57X3-19.09X1X2+ 9.41X1X3+11.88X2X3-18.01X12-12.45X22-21.51X32
2.2.2 回归模型的方差分析 对上述回归模型进行方差分析,结果见表4。

表4 回归模型的方差分析Table 4 Analysis of variance for the regression model
由表4回归模型的方差分析可知,回归模型的p= 0.0087,失拟p=0.4801,回归显著,失拟不显著,说明所创建的模式合适。该模型的校正系数Adj R2=0.7731,说明该方程与实际情况拟合较好,预测值和实际值的相关性较高,可用该模型对黑曲霉产木聚糖酶的最优发酵条件进行理论预测。
由回归方程各项方差分析表明,X3、X1X2、X12对黑曲霉产酶量影响显著,X32酶活力影响极显著,其余因子的影响均不显著。由软件分析得出模型的极值点,当蔗糖添加量1.28g,培养时间为78.46h,水的添加量为56.62%时,黑曲霉产木聚糖酶理论预测最大值为220.92U/g。
2.2.3 回归模型的响应面图 利用软件Design Expert 8.05绘制出响应面分析图。结果见图6~图8。

图6 培养时间和蔗糖的添加量对木聚糖酶产量影响的响应面图Fig.6 Pesponse surface for the effect of cross-interaction between fermentation time and sucrose content on xylanase production

图7 水和蔗糖的添加量对木聚糖酶产量影响的响应面图Fig.7 Pesponse surface for the effect of cross-interaction between water and sucrose content on xylanase production

图8 水的添加量和培养时间对木聚糖酶产量影响的响应面图Fig.8 Pesponse surface for the effect of cross-interaction between water content and fermentation time on xylanase production
由图6可见,当X1较小时,酶活随X2的增加而增加;当X1较大时,酶活随X2的增加而短暂增加后降低;X1的变化趋势X2完全一致。当蔗糖添加量为1.5g、培养时间为72h时,木聚糖酶活力达到最高221.32U/g。蔗糖添加量与培养时间的等高线呈椭圆形,表明二者交互作用显著。图7显示木聚糖酶产量随X1、X3的增大呈先增后减的趋势,当蔗糖添加量为1.5g、水的添加量为55%时,木聚糖酶活力达到最高221.32U/g。蔗糖添加量与水的添加量的等高线呈圆形,但二者交互作用不显著。由图8可见,木聚糖酶随X2、X3的增大呈先增后减的趋势,当培养时间为72h、水的添加量为55%时,木聚糖酶活力达到最高221.32U/g。
2.3 回归模型的验证实验
为实际操作的可行性,将以上理论组合校正为:蔗糖添加量1.3g,培养时间为78h,水的添加量为57%,此时木聚糖酶活力可达到221.5U/g,产酶量比优化前(125.59U/g)提高了1.76倍,与理论预测值(220.92U/g)较为接近,表明预测值与实际值有较好的拟合性,可见该模型可用于预测黑曲霉产木聚糖酶的实际发酵情况。
3 结论
在单因素基础上,采用响应面法对黑曲霉产木聚糖酶的发酵条件进行优化,并建立了产酶量与蔗糖添加量、培养时间及水的添加量之间的二次多项回归模型,得出最优发酵条件为蔗糖添加量1.3g,培养时间为78h,水的添加量为57%,在此条件下,木聚糖酶的产量达到221.5U/g,比优化前提高了1.76倍。
[1]叶波,周娅琴.木聚糖酶综述[J].轻工科技,2012(7):14-16.
[2]付冠华,李端,周晨妍,等.木聚糖酶的研究进展及其应用[J].安徽农业科学,2011,39(35):21566-21568.
[3]高艳秀,陈复生,丁长河.微生物木聚糖酶及其应用[J].中国酿造,2012,31(3):10-12.
[4]慕娟,问清江,党永,等.酶的开发与应用[J].陕西农业科学,2012(1):111-115.
[5]王雅珍,李秀婷,孙宝国,等.微生物酸性木聚糖酶及其应用的研究进展[J].食品与发酵工业,2012,38(8):107-113.
[6]王贝,王俊丽,闫潇,等.3种菌株产木聚糖酶同工酶及其酶解产物的比较[J].西北农业学报,2012,21(4):159-163.
[7]李敏康,张帆,宋宏新.木霉固态发酵麦麸制备低聚木糖的初步研究[J].中国酿造,2012,31(12):60-63.
[8]马晓建,杨君芳,常春.响应面法优化黑曲霉产木聚糖酶发酵条件的研究[J].郑州大学学报,2011,32(5):30-33.
[9]宋红霞,李秀婷,孙宝国,等.微生物利用木质纤维原料产木聚糖酶研究现状[J].北京工商大学学报:自然科学版,2011,29(2):63-69.
[10]胡玉琪,丁长河.固态发酵生产木聚糖酶的研究进展[J].中国酿造,2012,31(9):10-12.
[11]周晨妍,张金华,马雪婷,等.黑曲霉产木聚糖酶的固态发酵条件优化[J].安徽农业科学,2010,38:11052-11054.
[12]李爱军,蒋文明,欧仕益,等.黑曲霉ATCC16404固体发酵豆皮产生木聚糖酶的研究[J].食品工业科技,2011,32(12):261-265.
[13]王俊丽,聂国兴,曹香林,等.不同DNS试剂测定木糖含量的研究[J].食品研究与开发,2010,31(7):1-4.
[14]李家群.木聚糖酶产生菌的筛选、发酵条件和酶纯化的研究[D].广西:广西大学,2009:13-23.
[15]王晓丹,郭丽琼,赵力超,等.木聚糖酶酶活性测定方法及酶活性单位定义[J].食品与发酵工业,2009,35(9):128-131.
[16]张辉,张文会,孙中强.响应面优化黑曲霉HQ-1产β-葡萄糖苷酶的固体发酵条件[J].食品研究与开发,2012,33(11):188-192.
[17]刘国荣,张群莹,王成涛,等.响应面优化双歧杆菌B04代谢产细菌素的发酵条件[J].食品科学,2013,34(3):147-152.
[18]陈杰,魏鸿刚,罗远婵,等.海洋芽孢杆菌B-9987产新型抗菌环脂肽Marinhysin A的培养基优化[J].中国生物工程杂志,2013,33(1):84-89.
Study on optimization of the rice crust solid-state fermentation for xylanase from Aspergillus niger by response surface method
ZHENG Hong
(Biology and Chemistry Engineering Department,Fuqing Branch of Fujian Normal University,Fuqing 350300,China)
In this study,the fermentation technology of xylanase produced by Aspergillus niger in solid-state fermentation using rice crust as a sole substrate was investigated.On the basis of single factor experiment,the best carbon source,fermentation time and content of water for xylanase production by Aspergillus niger were optimized by Box-Benhnken design,and a quadratic regression equation for the change of enzymic activity with soluble starch,fermentation time,the content of water was established.The results showed that the optimal conditions were fermentation time for 78h,the content of water 57%,soluble starch 1.3g.Under optimization conditions,xylanase activity reached 221.5U/g,increased 1.76 times than before optimization.The prediction model indicated high reliability,which could be applied to optimization of xylanase fermentation conditions.
Aspergillus niger;xylanase;solid-state;Box-Benhnken experiment design
TS201.3
A
1002-0306(2014)08-0210-05
10.13386/j.issn1002-0306.2014.08.039
2013-07-31
郑虹(1981-),女,硕士研究生,实验师,研究方向:微生物。
福建师范大学福清分校校级重点学科建设基金项目(20110346);省教育厅A类项目(JA12358)。

