挤压膨化对玉米醇溶蛋白结构特性的影响*
郑喜群 马艳秋 刘晓兰 杨双 李凯园
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔161006; 2.齐齐哈尔大学黑龙江省普通高校农产品加工重点实验室,黑龙江齐齐哈尔161006)
2012年中国玉米产量为2.01亿吨,首次超过稻谷,成为第一大粮食作物.以玉米为原料湿法生产淀粉时,可分离出相对玉米(干基)6%左右的副产物玉米蛋白粉(CGM),CGM的主要成分是玉米蛋白(55%~65%),其中玉米醇溶蛋白占总蛋白的65%~68%.
与其他谷物蛋白相比,玉米醇溶蛋白含有高比例的亮氨酸、苯丙氨酸、异亮氨酸等疏水性脂肪族氨基酸,具有独特的抗氧化[1]、抗高血压[2]和促酒精代谢[3]功能序列,是一种潜在的功能性蛋白原料.但玉米醇溶蛋白是高度紧密及疏水的“醇溶蛋白体”,蛋白结构比较稳定[4],功能性难以释放,可采用必要的加工方法及技术手段,改变天然玉米醇溶蛋白的结构,改善其功能特性.
挤压膨化技术具有效率高、用时短、操作简单且经济环保的特点,广泛应用于工业生产中[5].蛋白质的挤压膨化是指在高温、高压、高剪切力及高能量水分子的协同作用下,其高级结构的去折叠、线性化和再交联的过程[6].研究发现适度挤压膨化可以改善玉米蛋白的吸水性、乳化性等物理性质[7];同时,挤压膨化也可以改变蛋白质的空间构象,增加其对蛋白酶的敏感性[8].
文中采用扫描电子显微镜、差示量热扫描法及傅里叶红外光谱等技术手段对挤压膨化前后玉米醇溶蛋白结构特性进行研究,并分析其物性的变化情况.以期为玉米醇溶蛋白的开发利用提供更多的理论依据.
1 材料与方法
1.1 材料和仪器
玉米蛋白粉(蛋白含量为57.07%)由黑龙江龙凤玉米开发有限公司提供,8-苯胺-1-萘磺酸(ANS,色谱纯)和5,5-二硫代-2-硝基苯甲酸(Ellman's试剂,色谱纯)购于Sigma公司,大豆油为市售,其他试剂均为分析纯试剂.
DS32-Ⅱ型双螺杆挤压膨化机,上海跃进医疗器械厂生产;Spectrum One傅里叶变换红外光谱仪(FT-IR),PE公司生产;Q-20型差示量热扫描仪,TA仪器公司生产;Nano-ZS90激光散射仪,Malvern仪器有限公司生产.
1.2 实验方法
1.2.1 CGM的挤压膨化及醇溶蛋白的提取
将CGM含水量调节至16%,放置过夜.膨化机工作参数为160~180℃、1.0~1.5 MPa.膨化的CGM在室温下干燥,用粉碎机粉碎、筛分,收集粒径小于280μm的膨化CGM作为原料备用.
将收集的CGM加入到70%乙醇水溶液(质量/体积比为1∶10,g/mL)中,置于水浴磁力搅拌器中,60℃萃取2h,4500 r/min离心10 min,收集上清液,将沉淀按上述方法再次提取.将两步提取的上清液混合,旋转蒸发浓缩到原体积的1/3,析出沉淀即为玉米醇溶蛋白,冷冻干燥.
1.2.2 玉米醇溶蛋白表观结构的观察
应用扫描电子显微镜(SEM)考察玉米醇溶蛋白表观结构.将少量蛋白样品固定到样品台上,喷金镀膜处理,用电子显微镜观察.电镜工作参数为:离子溅射仪工作距离为50mm,真空度为0.05mbar,电流控制为30 mA,溅射时间为40~60 s,喷金厚度大于5nm.
1.2.3 玉米醇溶蛋白红外光谱的测定
将蛋白样品进行KBr压片制样,用傅里叶红外光谱仪测定波数为4000~400 cm-1的蛋白红外光谱,分辨率为4cm-1,波数精度为0.01cm-1,扫描次数为32次,环境温度为25℃.利用Omnic V 8.0软件对谱图进行二阶导数、去卷帙及曲线拟合处理.
1.2.4 玉米醇溶蛋白变性温度的测定
利用Q-20型差示扫描量热仪测定.实验前,调整蛋白水分含量为6%,称取约2.0 mg玉米醇溶蛋白放入铝盒中,密封,置于DSC仪器的样品支持器上,以密封空铝盒作为对照.氮气压力为0.05 MPa,升温速率为10℃/min,温度范围20~180℃.每个样品重复测定3次.
1.2.5 玉米醇溶蛋白表面疏水性的测定
取约0.1g玉米醇溶蛋白,溶于5mL 0.01mol/L pH=7.0的磷酸-磷酸盐缓冲液中,4000 r/min离心10min,收集上清液.测定上清液可溶性蛋白含量,稀释蛋白使其含量为0.008~0.500 mg/mL.取4mL样液加入20 μL 8 mmol/L ANS荧光探针试剂,在室温条件下避光反应15min.在激发波长390nm、发射波长470nm以及狭缝5nm的条件下,测定ANS结合物的相对荧光强度,最后以相对荧光强度为纵坐标,蛋白浓度作为横坐标作图,以其斜率表示样品的表面疏水性.
1.2.6 玉米醇溶蛋白游离巯基含量的测定
参照Ellman’s分光光度法,有改动.精确称取0.05g蛋白样品,加入到8 mL含有8 mol/L尿素的pH值为8.0的Tris-Gly缓冲液(0.086 mol/L Tris、0.09mol/L glycine、0.004 mol/L EDTA)中,搅拌溶解1h,10000r/min离心10min,收集上清液.取2mL上清液加入2mL缓冲液和40μL Ellman’s试剂,立即混匀,1h后测定412 nm吸光值,以不加样品、只加Ellman’s试剂为空白.基于Ellman’s试剂-SH的摩尔吸光系数1.36×104,计算玉米醇溶蛋白的游离巯基含量Y(μmol/g),公式如下:
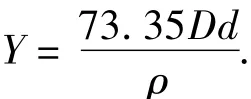
式中:D为412 nm吸光值;ρ为样品蛋白质质量浓度,mg/mL;d为稀释倍数.
1.2.7 玉米醇溶蛋白持水力和吸油性的测定
将0.5g玉米醇溶蛋白和5mL蒸馏水或精制大豆油放入10mL的离心管中,搅拌均匀,静置30min,在3000r/min离心10min,弃去上清液,然后测量离心管和残留物的质量.持水力或吸油性F按下式计算:

式中,m0为干燥样品的质量,m1为干燥样品和离心管的总质量,m2为离心后残留物和离心管的总质量.
1.2.8 玉米醇溶蛋白溶解性的测定
参考Surowka的质量差法,有改动.将烘干后的10mL离心管标记、称重,然后称取玉米醇溶蛋白0.5g,放入离心管中.再向离心管中加入5 mL蒸馏水,漩涡振荡10 min后,10000 r/min离心10 min,弃去离心上清液,将沉淀物放入真空干燥箱中(80℃)干燥至衡重.将带有沉淀物的离心管称重,按下式计算溶解性R:

式中,m为玉米醇溶蛋白干物质质量,m'1为空离心管的质量,m'2为离心管和沉淀物的质量.
1.2.9 玉米醇溶蛋白黏度的测定
用70%乙醇水溶液配置1%的玉米醇溶蛋白溶液.采用DV-C黏度计测定黏度,转子选择S96,转速设定为100r/min,记录扭矩在20%~80%之间的黏度值稳定时的数据.
1.3 数据处理
实验中数据都是3次测定的平均值,采用IBM SPSS Statistics软件进行数据的统计分析,实验中数据用平均值±标准差表示,应用origin 8.6统计学软件绘图.
2 结果与讨论
2.1 玉米醇溶蛋白的表观结构
实验获得了纯度较高的玉米醇溶蛋白,蛋白纯度分别为(94.26±0.43)%和(95.92±0.37)%.扫描电子显微镜利用入射电子和试样表面物质相互作用所产生的二次电子与被散射电子成像,获得试样表面微观组织结构和形貌信息.玉米醇溶蛋白的扫描电镜图像见图1

图1 未处理及挤压膨化的玉米醇溶蛋白SEM图片Fig.1 SEM photos of zein without and with extrusion
由图1可见,未处理的玉米醇溶蛋白聚集体直径较小(0.1~3.0μm),蛋白质聚集体呈现球状,球的大小不等,表面十分光滑,分布均匀,蛋白质聚集体之间有明显的界限.Yamada等[9]用扫描电镜观察玉米醇溶蛋白时也发现,在乙醇溶液中蛋白聚集形成小球状,小球直径为 150~550 nm,高度为50~150nm.玉米醇溶蛋白经挤压膨化处理后,除了球状聚集体之外,多数聚集体之间的界限变得不明显,部分呈现棒状结构;球状与球状聚集体、球状与棒状聚集体、棒状与棒状聚集体融合在一起,形成较大的聚集体.这种聚集体可能是蛋白间形成二硫键导致的.
2.2 玉米醇溶蛋白红外光谱
Omnic V 8.0软件处理后的玉米醇溶蛋白的红外光谱见图2,谱图中的吸收峰与分子中各基团的振动形式相对应,3000~3 600 cm-1处出现一吸收峰,这主要是蛋白质的O—H和N—H的伸展摆动,是酰胺A和酰胺B带的N—H的伸缩振动;在3000~2800cm-1处也有吸收峰,主要是C—H键的伸展摇摆.
蛋白质的FT-IR光谱图谱有几组特征吸收谱带,1600cm-1附近出现酰胺I吸收带,即C==O的伸缩振动;1530cm-1附近是酰胺Ⅱ吸收带,即C—N伸缩振动或N—H的弯曲振动;1450 cm-1主要来源于甲基的不对称和对称变角振动吸收;1230cm-1附近为酰胺Ⅲ吸收带,主要是C—N的伸缩振动和N—H的弯曲振动.
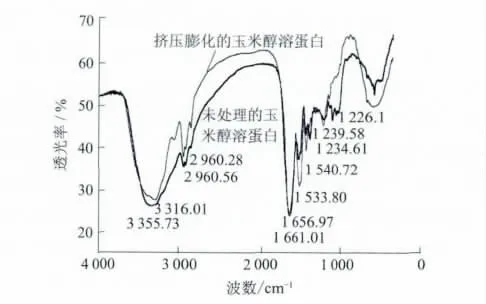
图2 未处理及挤压膨化的玉米醇溶蛋白FT-IR谱图Fig.2 FT-IR spectra of zein without and with extrusion
由图2可知,与未处理的玉米醇溶蛋白相比,挤压膨化的玉米醇溶蛋白的酰胺带出峰位置与强度均发生了改变,其中酰胺Ⅰ带与酰胺Ⅱ带吸收峰位置向低波数方向发生移动,酰胺Ⅲ带则向相反方向移动.同时挤压膨化处理的玉米醇溶蛋白在1632cm-1与1243cm-1处峰强度有明显的增加,其均为β折叠的出峰位置,表明β折叠含量有所增加,与酰胺Ⅰ带拟合结果相符.
CGM除了含有55%~65%的蛋白质之外,还含有21%~26%的碳水化合物,其中淀粉占12%~15%.这些淀粉与蛋白质结合紧密.未处理的醇溶蛋白在1150~1020cm-1处出现多糖的吸收峰,表明醇溶蛋白含有一定量的多糖,Tatiana等[10]报道的γ-玉米醇溶蛋白的红外光谱中也出现了这一吸收峰;而挤压膨化的玉米醇溶蛋白在1150~1020 cm-1处出现多糖的吸收峰,表明挤压膨化过程减弱了蛋白与多糖之间的连接力,使提取的醇溶蛋白含多糖量显著减少.
红外光谱可用于研究蛋白二级结构,1 600~1700cm-1为蛋白质酰胺Ⅰ带,是蛋白质二级结构吸收峰的叠加,因此基于红外光谱的酰胺Ⅰ带曲线拟合技术广泛应用于蛋白质的二级结构分析.对玉米醇溶蛋白光谱中1600~1700 cm-1吸收带进行二阶导数及去卷帙处理,经过处理后叠加峰得到了分离,根据分辨出来的子峰,对原始吸收峰进行高斯曲线拟合,拟合图谱见图3.
由图3可知,玉米醇溶蛋白在1600~1700cm-1范围内出现了多个子峰,定义子峰面积百分比为它的面积除以各个子峰面积的总和,根据朗伯比耳定理,这个子峰的面积百分比就可看做是这个子峰所代表的蛋白质二级结构在蛋白质中的相对含量.根据Byler、Smeller等[11-12]对多种蛋白红外光谱的研究结论,确定玉米醇溶蛋白中各个子峰位置与二级结构成分的对应关系,得到各个子峰的吸收频率位置、子峰相对面积及二级结构见表1.
由表1可知,本实验工作参数下,挤压膨化的玉米醇溶蛋白二级结构发生了变化,未处理玉米醇溶蛋白二级结构中α螺旋、β折叠、β转角、无规则卷曲的含量分别为23.68%、13.10%、47.59%及15.63%,挤压膨化的玉米醇溶蛋白二级结构中α螺旋、β折叠、β转角、无规则卷曲的含量分别为19.60%、22.56%、 36.27%和21.58%.挤压膨化使玉米醇溶蛋白二级结构中α螺旋与β转角含量减少,β折叠和无规则卷曲含量增加.挤压膨化使玉米醇溶蛋白分子结构呈现了由螺旋向折叠转化的趋势,同时伴随着无卷曲结构含量增加,表明玉米醇溶蛋白整个分子构象从有序向无序转化.由于二级结构的变化,天然玉米醇溶蛋白高级结构的稳定性降低,对蛋白改性的敏感性增加.
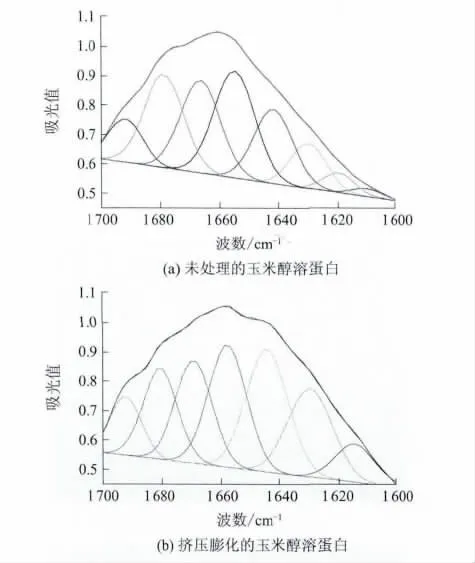
图3 未处理及挤压膨化的玉米醇溶蛋白 FT-IR酰胺Ⅰ带分解和曲线拟合Fig.3 Decomposition and curve fitting for FT-IR of zein without and with extrusion in amide I region
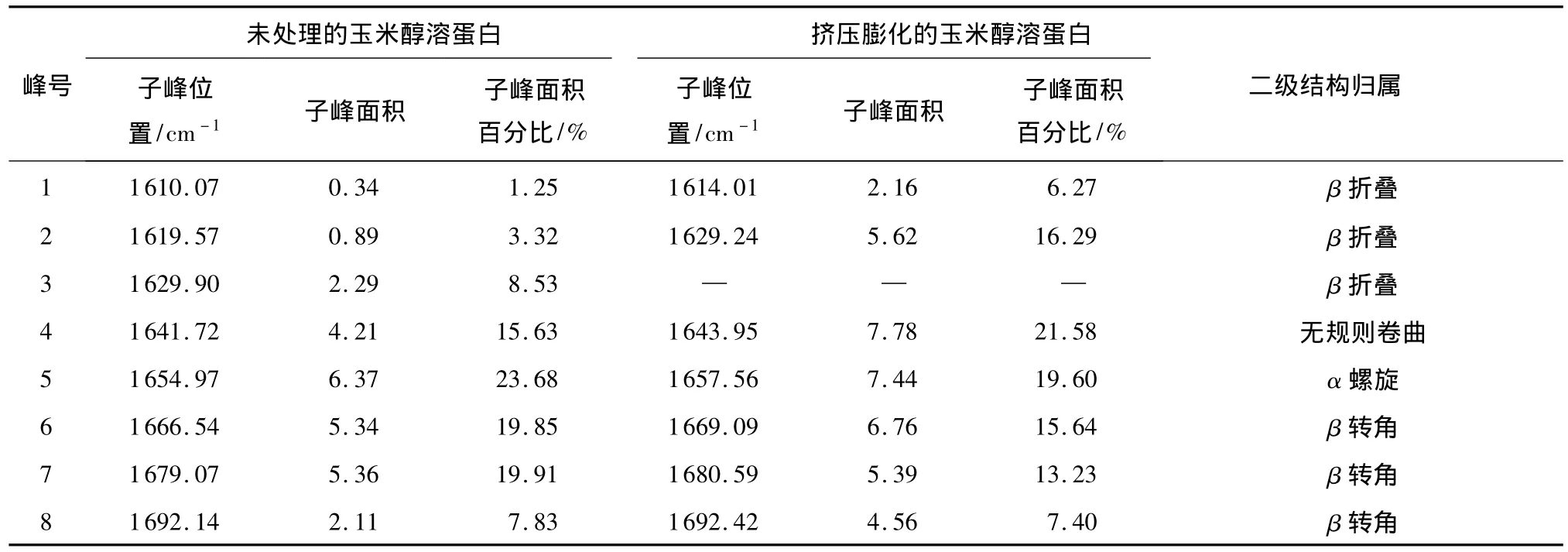
表1 未处理及挤压膨化的玉米醇溶蛋白在酰胺Ⅰ带的子峰位置、相对面积及其二级结构含量1)Table 1 The peak position,relative area and their secondary structure assignments of Amide I for zein without and with extrusion
2.3 玉米醇溶蛋白的变性温度
挤压膨化玉米醇溶蛋白的DSC曲线见图4.
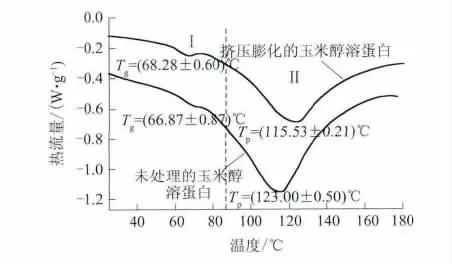
图4 未处理及挤压膨化的玉米醇溶蛋白DSC曲线Fig.4 DSC curves of zein without and with extrusion
由图4可知,玉米醇溶蛋白的吸热曲线均出现两个吸热峰,吸热峰Ⅰ与吸热峰Ⅱ峰值点温度分别为蛋白玻璃化温度(Tg)及变性温度(Tp).比较可知,挤压膨化使玉米醇溶蛋白玻璃化温度升高,变性温度减小.可能原因是,挤压膨化使得玉米醇溶蛋白高级结构遭到破坏,空间结构变得松散,热稳定性降低,蛋白变性温度减小.但该数值比Pablo等[13]通过DSC方法对大豆蛋白热变性分析的数值(Tp=98.9℃)高,表明与大豆蛋白相比,挤压膨化后的玉米醇溶蛋白具有更高的热稳定性.
2.4 玉米醇溶蛋白表面疏水性和游离巯基含量的变化
研究表明[14-15],蛋白的挤压膨化过程一般不会涉及肽键等主要化学键的断裂或改变,但会在一定程度上改变维系蛋白质高级结构的次级健.文中主要研究了挤压膨化对玉米醇溶蛋白表面疏水性及游离巯基含量的影响.
实验结果显示,未处理的玉米醇溶蛋白表面疏水性为(638.62±100.21),挤压膨化后该数值上升为(1191.48±111.24).可能原因是,挤压膨化过程中,在高温、高压及高剪切力的作用下,玉米醇溶蛋白内部部分疏水性氨基酸暴露,导致蛋白表面疏水性增加.Park等[14]采用单螺杆挤压膨化脱脂大豆粉时也观察到了类似的现象.同时,挤压膨化使得玉米醇溶蛋白的游离巯基含量由(5.37±0.53)μmol/L减小为(3.49±0.20)μmol/L.可能原因是半胱氨酸在高温、高压及高剪切力下形成了二硫键.Camire[15]通过研究挤压蒸煮过程中食品的化学变化,也报道了相似的结论.
2.5 玉米醇溶蛋白的物性
挤压膨化玉米醇溶蛋白的部分物性见表2.

表2 未处理及挤压膨化的玉米醇溶蛋白的物理性质Table 2 Physical properties of zein without and with extrusion
由表2可知,挤压膨化的玉米醇溶蛋白的物理性质发生了变化,持水力、吸油性与黏度均有所升高,但在水相中的溶解性有较显著的下降.可能的原因为:挤压膨化可使蛋白紧密的空间结构变疏松,加强了水与蛋白的结合作用,持水力增加;也可使蛋白分子内部疏水性基团暴露,表面疏水性变大,加强了油脂与蛋白的结合作用,吸油性增加;同时,溶解性下降显著的原因可能是,挤压膨化使得蛋白发生受热变性和交联反应,导致溶解性减小.
3 结论
本实验工作参数下,挤压膨化使玉米醇溶蛋白部分聚集体发生融合,球状聚集体直径变大;二级结构中的α螺旋与β转角转化为β折叠和无规则卷曲;蛋白变性温度、游离巯基含量均变小,表面疏水性增加.蛋白的持水力、吸油性和黏度均有不同程度的增加.挤压膨化处理使玉米醇溶蛋白的稳定性降低,当将挤压膨化作为玉米醇溶蛋白及CGM的改性处理的预处理步骤时,会使蛋白的改性效果更好.
[1] Zheng X Q,Li L L,Liu X L,et al.Production of hydrolysate with antioxidative activity by enzymatic hydrolysis of extruded corn gluten[J].Applied Microbiology and Biotechnology,2006,73(4):763-770.
[2] Suh H J,Wang J H,Kmi Y S,et al.Preparation of angiotensin I converting enzyme inhibitor from corn gluten[J].Process Biochemistry,2003,38(8):1239-1244.
[3] Ma Z L,Zhang W J,Yu G C,et al.The primary structure identification of a corn peptide facilitating alcohol metabolism by HPLC-MS/MS[J].Peptides,2012,37(1):138-143.
[4] Patrick Argos,Karl Pedersen M,David Marks,et al.A structural model for maize zein proteins[J].The Journal of Biological Chemistry,1982,257(17):9984-9990.
[5] Selling Gordon W.The effect of extrusion processing on zein[J].Polymer Degradation and Stability,2010,95 (12):2241-2249.
[6] Ledward D A,Texter R F.Molecular transformations of proteinaceous foods during extrusion processing[J].Trends in Food Science&Technology,1994,5(4):117-120.
[7] 张艳荣,周清涛,张传智,等.响应面法优化玉米蛋白挤出工艺[J].食品科学,2011,32(14):72-78. Zhang Yan-rong,Zhou Qing-tao,Zhang Chuan-zhi,et al. Optimization of twin-screw extrusion technology of defatted corn gluten meal by response surface methodology[J]. Journal of Food Science,2011,32(14):72-78.
[8] 郑喜群,刘晓兰,王晓杰,等.挤压膨化玉米黄粉酶解制备生物活性肽[J].食品与发酵工业,2005,31(8):1-3. Zheng Xi-qun,Liu Xiao-lan,Wang Xiao-jie,et al.Extrusion maize yellow powder,enzymatic hydrolysis of bioactive peptides[J].Journal of Food and Fermentation Industry,2005,31(8):1-3.
[9] Yamada K,Takahashi H,Noguchi A.Improved water resistance in edible zein films and composites for biodegradable food packaging[J].Food Science and Technology Research,1995,30(5):599-608.
[10] Tatiana C,Bicudo L A,Forato L A R,et al.Study of the conformation of γ-zeins in purified maize protein bodies by FTIR and NMR spectroscopy[J].Analytical and Bioanalytical Chemistry,2005,383(2):291-296.
[11] Byler D M,Susi H.Examination of the secondary structure of proteins by deconvolved FTIR spectra[J].Biopolymers,1986,25(3):469-487.
[12] Smeller L,Goossens K,Heremans K.Determination of the secondary structure of proteins at high pressure[J]. Vibrational Spectroscopy,1995,8(2):199-203.
[13] Pablo A.S,Gonzalo G P,Jorge R W.Thermal behavior of soy protein fractions depending on their preparation methods,individual interactions,and storage conditions[J].Journal of Agricultural and Food Chemistry,2010,58(18):10092-10100.
[14] Park J,Rhee K S,Kim B K,et al.Single-screw extrusion of defatted soy flour,corn starch and raw beef blends[J].Journal of Food Science,1993,58(1):9-20.
[15] Camire M E.Chemical changes during extrusion cooking.recent advances[J].Process-Induced Chemical Changes in Food Advances in Experimental Medicine and Biology,1998,434:109-121.

