绿原酸对深静脉血栓形成大鼠T细胞亚群失衡的影响
刘礼青,王德华,王 彬,李 霞,田楠楠
实验研究
绿原酸对深静脉血栓形成大鼠T细胞亚群失衡的影响
刘礼青1,2,王德华3,王 彬4,李 霞1,田楠楠5
目的:探讨Th1/Th2亚群失衡在大鼠深静脉血栓形成(DVT)中的作用及绿原酸的作用机制。方法:40只DVT大鼠随机分为DVT模型组、绿原酸小剂量组、绿原酸中剂量组、绿原酸大剂量组,每组各10只,分离大鼠脾脏单核细胞,流式细胞术检测各组大鼠Th1亚群(CD4+TNF-α+)、Th2亚群(CD4+IL-4+)比例,ELISA法检测大鼠外周血IL-2、TNF-α、IL-4、IL-10水平,并分析Th1/Th2比例与血清炎症标记物相关性。结果:与正常组及假手术组比较,DVT模型组大鼠脾脏Th1亚群比例升高(22.71±0.87,%),Th2亚群比例降低(3.06±0.15,%),Th1/Th2升高(7.20±0.45),IL-2、TNF-α表达升高(72.10±7.48,173.50±17.02, pg/mL),IL-4、IL-10表达降低(347.46±11.24、28.55±1.78,pg/mL);与模型组比较,绿原酸大剂量组大鼠Th1亚群比例降低(14.38±0.41,%),Th2亚群比例升高(4.91±0.14,%),Th1/Th2降低(3.02±0.26),IL-2、TNF-α表达降低(50.22±4.06、110.22±10.32, pg/mL),IL-4、IL-10表达升高(418.72±15.32、9.32±2.83,pg/mL),绿原酸大剂量组疗效优于中、小剂量组(P<0.05);Th1/Th2比例与IL-2、TNF-α呈正相关,与IL-4、IL-10呈负相关。结论:大鼠DVT发病过程中存在Th1/Th2亚群失衡,绿原酸诱导T细胞向Th2亚群偏移,逆转Th1/Th2亚群失衡状态,进而减轻炎症反应,抑制血栓形成。
绿原酸;Th1/Th2亚群;深静脉血栓形成;细胞因子
机体免疫机制紊乱在深静脉血栓形成(deep venous thrombosis,DVT)发病中的作用日益受到关注。T细胞是机体免疫调节的主导,不同T细胞亚群产生不同细胞因子,形成复杂的细胞因子谱系,发挥核心的免疫调节作用[1]。Th1/Th2亚群是经典的T细胞亚群,在抵抗病原体感染及维持机体内环境稳定中发挥着重要作用,参与了多种疾病的发生与发展[2-3]。我们在前期研究中发现,DVT大鼠及患者存在Th1型细胞因子表达升高,Th1/Th2失衡参与了DVT的发生与发展[4]。绿原酸是中药茵陈的主要有效成分,具有抗氧化作用及免疫调节等作用[5-6]。本实验通过建立大鼠DVT模型,观察模型大鼠Th1/Th2亚群变化,阐释其在DVT发病中的作用,并观察绿原酸干预后DVT大鼠Th1/Th2亚群分化状态及其特征性细胞因子的表达,阐释绿原酸逆转Th1/Th2失衡治疗DVT的作用与关键机制。
1 材料与方法
1.1 主要材料 Wistar大鼠60只,12周龄,体质量200~250 g,雄性,SPF级,购自山东大学实验动物中心(许可证号SCXK鲁20090001)。自由饮水和摄食,室温25~26℃,相对湿度45%左右。定期紫外线室内消毒,适应性饲养7 d。绿原酸原料药(南京海陵中药制药工艺技术国家工程研究中心,纯度95.0%;批号060801)。生理盐水由山东华鲁制药有限公司生产,批准文号国药准字H37022750。大鼠抗小鼠荧光抗体FITC-CD4、PE-TNF-α、PE-IL-4购自美国BD Pharmigen公司,IL-2、TNF-α、IL-4、IL-10ELISA试剂盒购自美国BD R&D公司。
1.2 DVT大鼠模型建立 根据Reyers法建立大鼠DVT模型40只,随机数字表法分为绿原酸大中小剂量[(40、20、10)mg·kg-1]组与模型组,各10只。造模术后动物自饮水摄食,绿原酸生理盐水溶液连续灌胃7 d。模型组灌胃等量生理盐水,连续处理7 d。假手术组大鼠麻醉后分离下腔静脉但不予结扎,直接缝合腹膜、皮肤,术后给予生理盐水连续灌胃7 d。正常大鼠作为正常对照组,给予生理盐水连续灌胃7 d。
1.3 标本收集与Th1、Th2亚群检测 末次药物处理后次日,大鼠心脏取血,分离血清,无菌分离大鼠脾脏,针栓研磨制成单细胞悬液,200目铜网过滤,调整细胞浓度为1×106个/mL,加入佛波酯(PMA)30 μg/L、离子霉素(Ionomycin)1 mg/L、莫能霉素(Monensin)1.7 μg/L,37℃,5%CO2孵育4 h。收集细胞,1×PBS洗2遍,去上清,加入小鼠血清,室温避光孵育30 min。将外标抗体FITC-CD4按说明书加入到细胞悬液中,4℃避光孵育30 min。1×PBS洗2遍,去上清。BD固定穿膜试剂盒固定穿膜(按说明书操作),加入内标抗体(PE-TNF-α、PE-IL-4),4℃避光孵育30 min;穿膜缓冲液洗2次,去上清,PBS重悬细胞,转管,上机检测。Winmidin 2.9分析Th1(CD4+TNF-α+)及Th2(CD4+IL-4+)亚群比例。
1.4 Th1/Th2亚群特征性细胞因子检测 采用ELISA法检测血清Th1型细胞因子IL-2、TNF-α及Th2型细胞因子IL-4、IL-10蛋白表达,按照试剂盒说明操作,每个标本设3个复孔。
1.5 统计学分析 应用SPSS11.5软件,计量资料以均值±标准差±s)表示。采用One Way-ANOVA方差分析,2组间比较采用Turkey法检验,P<0.05为差异有统计学意义。数据间相关性用Pearson相关性分析,相关系数(r值)为正,表示正相关,r值为负,表示负相关。P<0.05为差异有统计学意义。
2 结果
2.1 Th1/Th2亚群比例及比值 造模后第7 d,模型组Th1亚群比例、Th1/Th2比值显著高于正常组(P<0.05),Th2亚群比例显著低于正常组(P<0.05)。与正常组大鼠比较,单体中、小剂量组及模型组Th1亚群比例、Th1/Th2比值显著升高(P<0.05),Th2亚群比例显著降低(P<0.05)。单体大剂量组Th1亚群比例、Th2亚群比例以及Th1/Th2比值,与假手术组与正常组比较,无显著性差异(P>0.05)。与绿原酸中、小剂量组比较,绿原酸大剂量组Th1亚群比例显著降低,Th2亚群比例显著升高,Th1/Th2比值明显降低(P<0.05)。提示Th1/Th2亚群偏移参与了大鼠DVT形成,绿原酸对DVT大鼠Th1/Th2亚群分化状态具有调节作用,能优势诱导Th2亚群偏移,逆转DVT大鼠Th1/Th2亚群失衡状态,其作用呈剂量依赖性。详见表1。
表1 各组大鼠Th1/Th2亚群比例及比值(%,±s)

表1 各组大鼠Th1/Th2亚群比例及比值(%,±s)
注:与正常组比较,aP<0.05;与假手术组比较,bP<0.05,与模型组比较,cP<0.05,与单体小剂量组比较,dP<0.05,与单体中剂量组比较,eP<0.05
组别n单体大剂量组单体中剂量组单体小剂量组模型组假手术组正常组10 10 10 10 10 10 Th1亚群(CD+TNF-α+) 14.38±0.41c、d、e 17.84±0.78a、b、c、d 20.36±0.73a、b、c、e 22.71±0.87a、b、d、e 14.37±0.53c、d、e 14.21±0.61c、d、e Th2亚群(CD+IL-4+) 4.91±0.14c、d、e 3.65±0.16a、b、c、d 3.24±0.14a、b、c、e 3.06±0.15a、b、d、e 4.88±0.30c、d、e 5.00±0.22c、d、e Th1/Th2 3.02±0.26c、d、e 4.85±0.32a、b、c、d 6.54±0.40a、b、c、e 7.20±0.45a、b、d、e 3.06±0.22c、d、e 2.92±0.15c、d、e
2.2 血清IL-2、TNF-α、IL-4、IL-10水平 造模后第7 d,模型组大鼠IL-2、TNF-α水平显著高于正常组(P<0.05),IL-4、IL-10水平显著低于正常组(P< 0.05)。与正常组大鼠比较,单体中、小剂量组及模型组大鼠IL-2、TNF-α水平显著升高(P<0.05),IL-4、IL-10水平显著降低(P<0.05)。单体大剂量组IL-2、TN-α水平与与假手术组与正常组大鼠比较,无显著性差异(P>0.05),IL-4、IL-10水平与假手术组与正常组大鼠比较,无显著性差异(P>0.05)。单体大剂量组IL-2、TNF-α水平显著低于中、小剂量组(P<0.05),IL-4、IL-10水平显著高于中、小剂量组(P<0.05)。提示Th1型细胞因子IL-2、TNF-α蛋白表达升高及Th2型细胞因子IL-4、IL-10蛋白表达降低参与了DVT的形成过程,绿原酸通过调节Th1/Th2亚群比例,降低Th1型细胞因子表达,增加Th2型细胞因子表达,对其特征性细胞因子的调节作用呈明显剂量依赖性,证实其通过对Th1/Th2亚群分化调节作用进而减轻炎性细胞因子介导的炎症反应,保护血管内皮,治疗DVT。详见表2。
表2 各组大鼠血清IL-2、TNF-α、IL-4、IL-10水平(±s,pg/mL)

表2 各组大鼠血清IL-2、TNF-α、IL-4、IL-10水平(±s,pg/mL)
注:与正常组比较,aP<0.05;与假手术组比较,bP<0.05;与模型组比较,cP<0.05;与单体小剂量组比较,dP<0.05;与单体中剂量组比较,eP<0.05;与单体大剂量组比较,fP<0.05
组别单体大剂量组单体中剂量组单体小剂量组模型组假手术组正常组n 10 10 10 10 10 10 IL-2 50.22±4.06c、d、e57.70±3.53a、c、d、f 65.45±6.28a、b、e、f 72.10±7.48a、b、e、f 51.42±4.50c、d50.65±3.40c、d、e TNF-α 110.22±10.32c、d、e128.52±13.17a、b、c、d、f 156.45±13.00a、b、c、e、f 173.50±17.02a、b、d、e、f 110.70±9.43c、d、e 109.33±9.29c、d、e IL-4 418.72±15.32c、d、e398.24±16.82a、b、c、d、f 375.40±11.24a、b、c、e、f 347.46±11.24a、b、d、e、f 418.55±13.78c、d、e 427.32±12.10c、d、e IL-10 39.32±2.83c、d、e35.86±2.74a、b、c、d、f 32.30±2.41a、b、c、e、f 28.55±1.78a、b、d、e、f 38.21±3.08c、d、e 38.74±2.54c、d、e
2.3 Th1/Th2比例与血清炎症标记物相关性分析经过相关性分析,Th1/Th2比例与IL-2、TNF-α呈正相关(P<0.05),与IL-4、IL-10呈负相关(P<0.05)。详见表3。
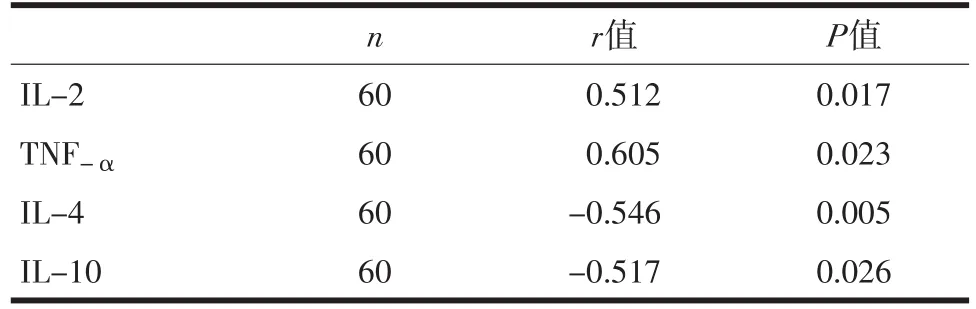
表3 大鼠Th1/Th2亚群比例与血清炎症标记物相关性分析
3 讨论
DVT是临床常见的周围血管疾病,早期易并发致命性肺栓塞,后期因静脉瓣膜破坏,患肢出现肿胀、色素沉着、湿疹样皮炎、慢性溃疡等DVT后综合症,严重影响患者的生活质量。T细胞是机体免疫调节的主体细胞,在抵御外界病原体感染及维持机体内环境稳定中发挥着重要作用。初始T细胞受抗原刺激后,在分化诱导因子及特异性核转录因子作用下分化为不同的亚群,产生特异性细胞因子,主导不同的免疫反应。CD4+T细胞经IFN-γ和IL-12诱导分化为Th1亚群,分泌IL-2、TNF-α等细胞因子,介导细胞免疫。初始T细胞经IL-4诱导分化成Th2亚群,分泌IL-4、IL-10等细胞因子,激活B细胞,介导体液免疫,能拮抗性抑制Th1型细胞因子介导的炎症反应,使机体的免疫应答限制在适度范围,避免过强的炎症反应导致的组织损伤。Th1/Th2亚群相互调节,处于动态平衡之中,维持机体正常免疫功能及自稳状态[7-8]。
IL-2通过诱导T-bet的表达和上调IL-12Rβ2亚基促进Th1细胞分化,同时它还刺激NK细胞、巨噬细胞的活化生长和增强它们的杀伤能力[9-10]。IL-4是通过激活STAT6途径,依靠转录因子GATA-3等因素确保CD4+T细胞向Th2细胞分化[11]。IL-4可抑制单核巨噬细胞产生IL-1β和TNF-α,下调活化的单核巨噬细胞分泌氧自由基,还能抑制前列腺素E2和IL-8产生,诱导IL-1RA产生,提高IL-1RA及IL-1β比例从而起到一定的抑炎作用。IL-10是Th1细胞分化的下调者,由Th2细胞分泌,主要抑制激活的单核细胞、巨噬细胞、粒细胞和T细胞,还能有效地在mRNA水平抑制单核细胞产生IL-1β,TNF-α,IL-6和IL-8等促炎症因子和趋化因子[12-13]。
在类风湿性关节炎(rheumatoid arthritis,RA)关节滑液中,Th1亚群占绝对优势,Th1/Th2明显失衡,Th1、Th2细胞及其分泌的细胞因子平衡状态的紊乱是造成RA的主要原因[14-15]。在对桥本甲状腺炎(hashimoto thyroiditis,HT)患者的研究中发现,其甲状腺组织内浸润的辅助性T细胞主要为Th1细胞,表现为Th1细胞因子亢进占优势[16]。在犬自身免疫性甲状腺炎模型血清中,Th1型细胞因子被检测到高表达,而Th2型细胞因子IL-4的表达则降低[17]。有学者在感染后肠易激综合征(postinfectious irritable boewlsyndrome,PI-IBS)研究中发现,不同中医证型其Th1/Th2漂移程度不同,Th1亚群(INF-γ、IL-2)指标,肝气郁滞证组>肝郁脾虚证组>脾胃虚弱证组;Th2(IL-4、IL-5)指标,脾胃虚弱证组>肝郁脾虚证组>肝气郁滞证组。并认为,PI-IBS实证患者细胞免疫较强,Th1/Th2左偏;而虚证患者则偏向于体液免疫,Th1/Th2右偏[18]。
绿原酸是中药茵陈的主要有效单体成分,大量的实验证明绿原酸是一种自由基清除剂及抗氧化剂,它通过清除氧自由基及抗脂质过氧化,可保护血管内皮细胞,进而对心血管系统产生有效的保护作用[19-20]。药理研究证实,绿原酸对免疫功能具有调节作用,可以通过抑制炎症反应,改善静脉内皮功能。本研究发现,在DVT模型大鼠Th1亚群比例明显升高,Th2亚群比例明显降低,Th1型细胞因子占主导地位,提示Th1/Th2亚群失衡参与了DVT形成过程。绿原酸治疗后,DVT大鼠Th1亚群比例及炎性因子表达显著降低,Th2亚群比例及抑炎因子表达显著升高,证实绿原酸通过优势诱导Th2亚群分化,逆转Th1/Th2亚群失衡,减少Th1型炎性细胞因子分泌,进而减轻炎症反应对血管内皮的损伤,治疗DVT,绿原酸大剂量组疗效优于中、小剂量组。经过相关性分析,我们观察到Th1/Th2比例与IL-2、TNF-α呈正相关,与IL-4、IL-10呈负相关。通过本研究,未发现绿原酸有明显毒副作用。
本研究证实,Th1/Th2亚群失衡参与了DVT形成过程,绿原酸通过逆转Th1/Th2亚群失衡,减轻炎症反应,进而保护血管内皮细胞,发挥治疗DVT的作用。但DVT中Th1/Th2亚群失衡的根源及绿原酸调节Th1/Th2亚群偏移的分子机制尚需进一步深入探讨。
[1]Dong Z,Du L,Xu X,et al.Aberrant expression of circulating Th17,Th1 and Tc1 cells in patients with active and inactive ulcerative colitis[J].Int J Mol Med,2013,31(4):989-997.
[2]彭小青,李夏雨,王玮,等.Th1/Th2细胞炎性因子在大鼠溃疡性结肠炎治疗模型中的表达 [J].中南大学学报,2013,38(10):1020-1027.
[3]Li X,Wang B,Li Y,et al.The Th1/Th2/Th17/Treg paradigm induced by stachydrine hydrochloride reduces uterine bleeding in RU486-induced abortion mice[J].J Ethnopharmacol,2013,145(1):241-253.
[4]王彬,刘明,郝清智,等.中药调节Th1/Th2免疫平衡在下肢深静脉血栓形成治疗中的作用[J].中国中西医结合外科杂志,2013, 19(4):355-358.
[5]Iwasaki Y,Nomoto M,Oda M,et al.Characterization of nitrated phenolic compounds for their anti-oxidant,pro-oxidant,and nitrationactivities[J].Arch Biochem Biophys,2011,513(1):10-18.
[6]Hebeda CB,Bolonheis SM,Naksato A,et al.Effects of chlorogenic acid on neutrophil locomotion function in response to inflammatory stimulus[J].J Ethnopharmacol,2011,135(2):261-269.
[7]Guo M,Mao X,Ji Q,et al.Inhibition of IFN regulatory factor-1 down-regulate Th1cell function in patients with acute coronary syndrome[J].J Clin Immunol,2010,30(2):241-252.
[8]Veldhoen M,Hirota K,Christensen J,et al.Natural agonists for aryl hydrocarbon receptor in culture medium are essential for optimal differentiation of Th17 T cells[J].J Exp Med,2009,206(1):43-49.
[9]Boyman O,Sprent J. The role of interleukin-2 during homeostasis and activation of the immune system[J].Nat Rev Immunol, 2012,12(3):180-190.
[10]Chavez AR,Buchser W,Basse PH,et al.Pharmacologic administration of interleukin-2[J].Ann N Y Acad Sci,2009,1182:14-27.
[11]Roberts-Thomson IC,Fon J,Uylaki W,et al.Cells,cytokines and inflammatory bowel disease:a clinical perspective[J].Expert Rev Gastroenterol Hepatol,2011,5(6):703-716.
[12]Dong Z,Du L,Xu X,et al.Aberrant expression of circulating Th17,Th1and Tc1 cells in patients with active and inactive ulcerative colitis[J].Int J Mol Med,2013,31(4):989-997.
[13]Christian A,Gleissner,Arne Zastrow,et al.IL-10inhibits endothelium-dependent T cell costimulation by up-Regulation of ILT3/4 in human Vascular endothelial cells[J].Eur J Immunol,2007,37(1):177-192.
[14]Boissier MC.Cell and cytokine imbalances in rheumatoid synovitis [J].Joint Bone Spine,2011,78(3):230-234.
[15]Ursaciuc C,Surcel M,Ciotaru D,et al.Regulatory T cells and TH1/ TH2 cytokines as immunodiagnosis keys in systemic autoimmune diseases[J].Roum Arch Microbiol Immunol,2010,69(2):79-84.
[16]沈浩,胡玲.Th1/Th2细胞平衡偏移与自身免疫性甲状腺疾病的相关性研究[J].中国实用内科杂志,2009,29(3):252-253.
[17]Choi EW,Shin IS,Bhang DH,et al.Hormonal change and cytokine mRNA expression in peripheral blood mononuclear cells during the development of canine autoimmune thyroiditis[J].Clin Exp lmmunol,2006,146(1):101-108.
[18]马俊杰,张以来.感染后肠易激综合征中医证型与Th1/Th2漂移相关性研究[J].中华中医药杂志,2014,29(2):592-594.
[19]王丽萍,郭栋,王果,等.中药绿原酸的研究进展[J].时珍国医国药,2011,22(4):961-963.
[20]Rodriguez de Sotillo DV,Hadley M.Chlorogenic acid modifies plasma and liver concentrations of:cholesterol,triacylglycerol,and minerals in(fa/fa)Zucker rats[J].J Nutr Biochem,2002,13(12):717-726.
(收稿:2014-02-10 修回:2014-10-12)
(责任编辑 王 丰)
Regulating Effect of Chlorogenic Acid on T cell Subsets Imbalance in Deep Venous Thrombosis of Rats
LIU Li-qing,WANG De-hua,WANG Bin,et al.
College of Life Science of Jinan University,Jinan Shandong (250014),China
Objective To evaluate the role of Th1/Th2 shift in deep venous thrombosis(DVT)and elucidate the mechanism of chlorogenic acid in treating DVT in rat models.MethodForty DVT rats were divided randomly into DVT group and chlorogenic acid high dose,middle dose and low dose groups.Additionally,10 rats with sham operation were taken as sham operation group and 10 normal rats were taken as normal group respectively.Rats of chlorogenic acid group were treated with chlorogenic acid for 7 days,while rats of other groups were treated with physiological saline for the same duration.Then,the proportions of Th1(CD4+TNF-α+) subset and Th2(CD4+IL-4+)subset were detected by flowcytometry.Moreover,the protein expressions of IL-2, TNF-α,IL-4 and IL-10 in rat serum were analyzed by ELISA assay,and the proportion of Th1/Th2 correlated with serum levels of inflammatory markers was analyzed.ResultsCompared with normal and sham operation groups,the proportion of Th1 subset was increased while that of Th2 subset was decreased significantly in DVT group(22.71±0.87%,3.06±0.15%).In addition,protein expression of IL-2 and TNF-αwas enhanced(72.10±7.48 173.50±17.02,pg/mL)while that of IL-4 and IL-10 was inhibited markedly in DVT rats(347.46±11.24 28.55±1.78,pg/mL).After chlorogenic acid administration,the proportion of Th1 subset was down-regulated while that of Th2 subset was up-regulated significantly in DVT rats(14.38±0.4 14.91±0.14,%).Moreover,the protein expression ofIL-2 and TNF-αdecreased while that of IL-4 and IL-10 increased obviously after chlorogenic acid administration,Th1/Th2 proportional positively correlated with IL-2 and TNF-α,and negatively correlated with IL-4, IL-10(50.22±4.06 110.22±10.32,418.72±15.32 9.32±2.83,pg/mL).ConclusionTh1/Th2 shift is involved in DVT.Chlorogenic acid can down-regulate the Th1 subsets and up-regulate the Th2 subsets and exert the curative effect on DVT mice.
Chlorogenic acid;Th1/Th2 subsets;deep vein thrombosis;cytokines
Q95-33;R654.4
A
1007-6948(2014)06-0607-05
10.3969/j.issn.1007-6948.2014.06.011
国家自然科学基金资助项目(81102600,81373670);山东省优秀青年科学家奖励基金(BS2010-YY069);山东省中医药发展计划(2012GSF11840);济南市科技明星计划项目(济科合字2012)
1.山东省医学科学院基础医学研究所(济南 250062)
2.济南大学医学与生命科学院(济南 250062)
3.山东省立医院手足外科(济南 250011)
4.山东中医药大学附属医院周围血管病科(济南 250014)
5.济南军区总医院放疗科(济南 250031)
田楠楠,E-mail:13589040205@139.com

