胸水microRNA检测及与生化指标、肿瘤标志物的相关性
张斌杰,张永奎,乐涵波,竺王玉
胸水microRNA检测及与生化指标、肿瘤标志物的相关性
张斌杰,张永奎,乐涵波,竺王玉
目的:分析良恶性胸水中与肿瘤密切相关的5种micro RNA的表达,探讨其与胸水中生化指标和肿瘤标志物的相关性。方法:应用逆转录荧光定量PCR法对12例肺癌性和9例良性患者的胸水中has-let-7b、has-miR-24、has-miR-27b、has-miR-30d和has-miR-128a的表达量进行检测,并分析其与胸水中腺苷脱氨酶(ADA)、乳酸脱氢酶(LDH)、总蛋白(TP)、葡萄糖(GLU)、癌胚抗原(CEA)、糖类抗原199(CA199)、甲胎蛋白(AFP)的含量之间的关系。结果:5种micro RNA中只有has-miR-24在恶性胸水中表达要明显低于良性胸水(P<0.05),与ADA和LDH的相关性分别是0.5707和0.5144;ADA与LDH的含量也是恶性胸水明显低于良性胸水(P<0.05),ADA与LDH在恶性胸水中的含量的相关性达到0.7754。结论:恶性胸水中has-miR-24的表达与ADA和LDH的含量存在明显的相关性,为进一步探究microRNA在恶性胸水形成中所起作用提供依据。
胸腔积液;microRNA;肿瘤标记物
MicroRNA(miRNA)是一类长度约为17~24 nt并且高度保守的非编码单链RNA,其主要功能是在转录后水平负性调节目的基因的表达,通过碱基互补配对原理结合到靶基因mRNA的3端非编码(3"UTR)[1]。广泛参与了细胞的分化、发育、增殖、死亡等生命活动中的一系列重要进程[2-3],与多种肿瘤密切相关的microRNA就有has-let-7b[4]、has-miR-24[5]、has-miR-27b[6]、has-miR-30d[7]和 has-miR-128a[8]等。本文通过收集炎症与肺癌病人的胸水,检测与肿瘤密切相关的五种microRNA(has-let-7b、has-miR-24、has-miR-27b、has-miR-30d和has-miR -128a)的表达,分析其与胸水生化指标腺苷脱氨酶(adenosine deaminase,ADA)、乳酸脱氢酶(lactate dehydrogenase,LDH)、总蛋白(total protein,TP)、葡萄糖(glucose,GLU)和肿瘤标志物(CEA、CA199、AFP)含量的相关性。
1 材料与方法
1.1 研究对象 住院患者21例,男9例,女12例;恶性组胸水患者12例,均为肺癌。良性组9例,均是炎症者。经病理学诊断确诊。
1.2 标本采集和保存 收集良、恶性胸腔积液患者的外周静脉血,常规离心分离血清,保存-20℃。新鲜胸腔积液标本,离心后取上清液保存-20℃。取胸腔积液,提RNA保存-80℃。
1.3 检测方法 所有生化指标及肿瘤标志物采用电化学发光免疫分析仪,试剂为公司配套试剂。microRNA的表达检测采用ABI公司的TaqMan探针,利用荧光定量PCR仪进行检测并分析。
1.4 统计学处理 应用SPSS 13.0统计学软件包,计量资料比较应用t检验,microRNA定量结果与4种生化指标及3种肿瘤标志物间关系分析采用Pearson相关性分析,方程式,以P< 0.05有统计学意义。
2 结果
2.1 microRNA表达 与肿瘤密切相关的5种microRNA采用Taqman探针的方法检测其在良恶性胸水中表达含量,结果如表1。只有has-miR-24的表达有显著差异(P=0.032),其在恶性胸水中表达比良性胸水低。

表1 microRNA在良恶性胸水中的表达分析(mean±sem)
2.2 has-mir-24与胸水生化指标的相关性 恶性胸腔积液中ADA与LDH的含量都明显低于良性患者(P<0.05),TP与GLU的含量则无差异。见表2。在良性患者中,LDH与GLU有明显的相关性(R2= 0.6106)。在恶性患者中没有此联系。见表3、图1。ADA与LDH在恶性患者中的相关性达到了0.7754,明显高于良性患者的0.0074。在恶性胸水中has-mir-24的含量与ADA和LDH存在明显的相关性,R2分别达到0.5707和0.5144。见表4。
2.3 has-mir-24与胸水中肿瘤标志物的相关性分析 CEA与CA199在恶性胸水中的含量要明显高于良性(P<0.05),见表5。在良恶性胸水中,hasmir-24与CEA和CA199的都无明显相关性。见表6。
3 讨论
胸水的形成有多种原因,其中胸膜炎与恶性肿瘤最为常见。在良、恶性胸水的鉴别中,检查胸水脱落细胞学方法最为准确。临床上,胸腔积液中细胞数少、含红细胞多、送检不及时等多种原因,导致恶性细胞阳性检出率较低。由于肿瘤标志物在癌症的早期诊断、个体化治疗多方面都起到重要的作用,近年的研究主要集中在肿瘤标志物和一些生化指标,以此来找出恶性胸水形成的原因。

表2 4种生化指标在良恶性胸腔积液患者胸水中的检测结果(mean±sem)

表3 4种生化指标之间的相关性分析
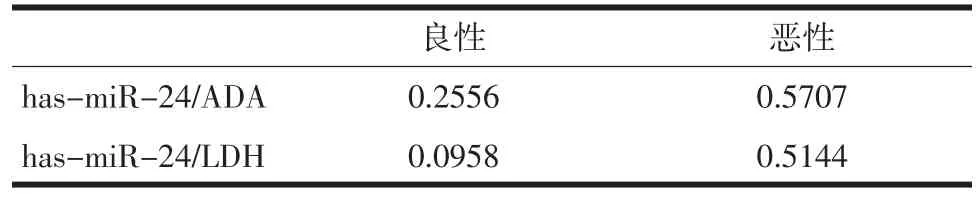
表4 hsa-mir-24与胸水生化指标的相关性分析

表5 3种肿瘤标志物在良恶性胸腔积液患者中胸水中的检测结果(mean±sem)
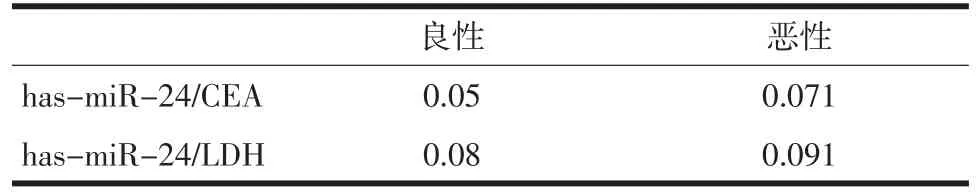
表6 has-mir-24与胸水中肿瘤标志物的相关性分析

图1 ADA与LDH的相关性分析图
microRNA是一类能够调控靶基因表达的非编码小RNA,组织或血清中microRNA的异常表达在恶性肿瘤的发生和进展中起了重要作用[9-10]。由于microRNA的异常表达与恶性肿瘤的发生、发展有着密切联系,也被很多文献报道,microRNA表达谱与人类恶性肿瘤的诊断、临床分期、治疗以及预后密切相关[11-13]。还有研究表明,经microRNA谱分析的癌肿与正常组织相比,具有不同的microRNA表达[11],且认为microRNA可作为肺癌预后判断指标。Yu等[14]对112例NSCLC患者进行检测,通过Cox模型和风险评分发现了5个预测NSCLC治疗效果的microRNA信号。microRNA在肿瘤中表达的这些特点为肺癌的诊断开辟了一条崭新途径,并且已经在包括肺癌在内的多种恶性肿瘤中得到证实。microRNA既可作为抑癌基因下调原癌基因的活性;也可作为癌基因下调抑癌基因的活性。如已经研究比较明确的肿瘤抑制因子let-7家族[15-17],它不但能负性调控多种癌基因(如Ras、HMGA2、cMyc),还能控制细胞周期调节因子(如CDC25A、CDK6、Cyclin D2等)的表达,刺激细胞增生,与癌细胞的生长有紧密的联系。还有报道mir-27b能够作为乳腺癌的标志,调节ST14的表达。Mir-128能够显著降低胶质瘤细胞的增殖[6]。mir-24能够抑制细胞的增殖,通过调节多个与细胞周期相关的靶基因(E2F2、cMyc等)的表达[5]。本文通过检测与肿瘤密切相关的5种microRNA(has-let-7b、has-miR-24、has-miR-27b、hasmiR-30d和has-miR-128a)在良恶性胸水中的表达,来探讨microRNA在恶性胸水形成所扮演的作用。结果显示,只有mir-24在恶性胸水的表达要明显低于良性,其余4种并无明显差异。mir-24在恶性胸水中的低表达,正好与前期国外所报道的一致,可能在恶性胸水形成时,调控了癌细胞的过度增殖和生长周期。
过去大量研究报道,胸水中含有ADA、LDH、TP、GLU等物质,其含量与引起恶性胸腔积液的原因有着密切的关系,因此生化指标常常作为诊断工具[18]。ADA能够催化腺苷水解生成NH和次黄嘌呤核苷,是一种重要的核苷氨基的水解酶,其中淋巴细胞表达很高,在淋巴细胞引起的免疫反应中,ADA的表达会增强。炎症细胞能够引起免疫反应,导致胸水中淋巴细胞明显增多的缘故,可作为对炎症性胸水诊断指标之一。LDH是组织中含量高的氢离子传递酶,广泛存在于人体各种组织中,任何组织的损伤都可能导致体液中LDH含量增高。本文通过检测这4种常见生化指标在良恶性胸水中的表达,显示只有ADA与LDH在恶性胸水的表达要低于良性,这与国内外的很多研究报道一致。且我们还发现,ADA与LDH在恶性胸水中有很明显的相关性,说明存在共同因素来调节他们的表达。他们与mir-24是否有特殊的关系呢?我们分析了mir-24与ADA和LDH的相关性,结果显示,mir-24与ADA和LDH的相关性分别达到了0.5707和0.5144。说明在恶性胸水形成时,mir-24可能参与了ADA与LDH的表达调控。
肿瘤标志物作为常见的诊断指标,与恶性胸水的发生有紧密的联系[9]。CEA主要分布于癌细胞的表面,易脱落至血液或其他体液中。曾有报道指出,CEA对肺癌特异性较高,阳性率为76.1%。近期还发现,CA199除在胰腺癌、卵巢癌患者表达高之外,在肺癌等患者的血清中表达也很高。我们检测了CEA与CA199以及与肝癌密切相关的AFP在良恶性胸水中的表达,发现与报道一致,恶性胸水中CEA和CA199都显著高于良性,而在肺癌引起的恶性胸水中AFP的表达与良性并无差异。这两种肿瘤标志物是否与生化指标ADA和LDH一样与miR-24有关呢?因此,我们采用同样的方法分析了他们之间的相关性,结果显示并无明显相关性。说明低表达的mir-24与在恶性胸水中高表达的CEA和CA199的调节并无直接联系。
[1]Selbach M,Schwanhausser B,Thierfelder N,et al.Widespread changes in protein synthesis induced by microRNAs[J].Nature,2008,455(7209):58-63.
[2]Lewis BP,Burge CB,Bartel DP Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[3]Peltier HJ,Latham GJ.Normalization of microRAN expressi0n 1evels in quantitative RT-PCR assays:identification of suitable reference RAN targets in normal and cancerous human solid tissues [J].RAN,2008,14(5):844-852.
[4]Chin LJ,Ratner E,Leng S,et a1.A SNP in a let-7 microRNA complementary site in the K-ras 3 untranslated region increases non-small cell lung cancer risk[J].Cancer Res,2008,68(20):8535-8540.
[5]Lal A,Navarro F,Maher CA,et al.miR-24 Inhibits cell proliferation by targeting E2F2,MYC,and other cell-cycle genes via binding to"seedless"39UTR microRNA recognition elements[J].Mol Cell,2009,35(5):610-625.
[6]Wang YF,Rajamani R,Amelia W,et al.ST14(Suppression of Tumorigenicity 14)Gene Is a Target for miR-27b,and the Inhibitory Effect of ST14 on Cell Growth Is Independent of miR-27b Regulation[J].J Biol chem,2009,284(34):23094-23106.
[7]Lu Y,Ryan SL,Elliott DJ,et al.(2009)Amplification and Overexpression of Hsa-miR-30b,Hsa-miR-30dandKHDRBS3at 8q24.22-q24.23 in Medulloblastoma[J].PLoS one 4(7):e6159.doi:10.1371/journal.pone.0006159.
[8]Godlewski J,Nowicki MO,Bronisz A,et al.Targeting of the Bmi-1 Oncogene/Stem Cell Renewal Factor by MicroRNA-128 Inhibits Glioma Proliferation and Self-Renewal[J].Cancer Res,2008, 68(22):9125-9130.
[9]Alataş F,Alataş Ö,Metintaş M,et al.Diagnostic value of CEA, CA 15-3,CA 19-9,CYFRA 21-1,NSE and TSA assay in pleural effusions[J].Lung Cancer,2001,31(1):9-16.
[10]Lu Y,Okubo T,Rawlins E,et a1.Epithelial progenitor cells of the embryonic lung and the role of microRNAs in their proliferation[J].Proc Am Thorac Soc,2008,5(3):300-304.
[11]Calin GA,Croce CM.MicroRNA signatures in human cancers[J]. Nat Rev Cancer,2006,6(11):857-866.
[12]Yanaihara N,Caplen N,Bowman E.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
[13]Calin GA,Ferraein M,Cimmino A,et a1.A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia[J].N Engl J Med,2005,353(17):1793-1801.
[14]Yu SL,Chen HY,Chang GC,et a1.MicroRNA signature predicts survival and relapse in lung cancer[J].Cancer Cell,2008,13(1):48-57.
[15]Roush S,Slack F J.The let-7 family of microRNAs[J].Trends Cell Biol,2008,18(10):505-516.
[16]Kumar MS,Erkeland SI,Pester RE,et a1. Suppression of non-small cell lung tumor development by the let-7 microRANS family[J].Proc Natl Acad Sci USA,2008,105(10):3903-3908.
[17]Wang X,Cao L,Wang Y,et a1.Regulation of let-7 and its target oneogcnes(Review)[J].Oncol Lett,2012,3:955-960.
[18]Cok G,Parildar Z,Basol G,et al.Pleural fluid neopterin levels in tuberculous pleurisy[J].Clin Biochem,2007,40(12):876-880.
(收稿:2014-08-20 修回:2014-10-16)
(责任编辑 李志刚)
Detection of MicroRNAs in Pleural Effusion and its Correlation with the Biochemical Indicators and Tu-mor Biomarkers
ZHANG Bin-jie,ZHANG Yong-kui,LE Han-bo,et al.
Zhoushan Hospital of Zhejiang Province,zhoushan(316000),China
Objective To investigate the expression of five microRNAs closely related to the tumor in benign and malignant pleural effusion,and relationship with the biochemical indicators and tumor biomarkers.MethodsqRT-PCR was employed to detect the expression of has-let-7b,has-miR-24,has-miR-27b, has-miR-30d and has-miR-128a in 12 malignant patients and 9 benign patients.Meanwhile,the relationship of the expression of miRNAs with the levels of adenosine deaminase(ADA),lactate dehydrogenase(LDH),total protein (TP),glucose(GLU),carcino embryonic antigen(CEA), carbohydrate antigen 199(CA199),and alpha-fetopro-tein(AFP)was analyzed.ResultsThe expressionlevel of has-miR-24 in five microRNA was detected markedly lower in malignant pleural effusion than those in benign ones.(P<0.05),which was significantly correlated with the levels of ADA and LDH(r=0.5707,0.5144, respectively).The levels of ADA and LDH were also lower in malignant pleural effusion than those in benign ones.The level of ADA was significantly correlated with LDH in malignant pleural effusion(r=0.7754).ConclusionThe expression level of has-miR-24 was obviously related with the content of ADA and LDH, which might provide important clinical research value for investigating the role of microRNA in the production of malignant pleural effusion.
Pleural effusion;microRNA;tumor biomarkers
R730.4
A
1007-6948(2014)06-0586-04
10.3969/j.issn.1007-6948.2014.06.004
浙江省卫生厅基金资助项目(2011KYB165)
浙江省舟山医院胸心外科(舟山 316000)
张永奎,E-mail:zyk801801@163.com

