γ-氧化铝表面性质与晶面特性关系研究
季洪海,苗 升,马 波,沈智奇,凌凤香,王少军,肖锦春,,符 荣,
(1.中国石油化工股份有限公司抚顺石油化工研究院,辽宁 抚顺 113001;2. 胜利油田胜利石油化工建设有限责任公司,山东 东营 257064;3.辽宁石油化工大学,辽宁 抚顺 113001)
活性氧化铝具有比表面积大、孔结构和孔分布可调、表面同时存在不同性质的酸性中心、较好的机械强度和热稳定性、价格低廉等特点,因而被广泛用作催化剂载体[1]。炼油工业中所用的加氢处理催化剂(除加氢裂化催化剂外)几乎都采用氧化铝为载体的主要成分[2]。然而氧化铝载体的物化性质,尤其是载体的表面性质对负载型催化剂性能影响很大[3-9]。Sakashita等[7,9]以不同晶面取向的MgAl2O4为基底,采用电子束蒸发法制备不同晶面取向的氧化铝薄膜,并以该氧化铝薄膜为载体制备加氢催化剂,研究了氧化铝晶面取向对硫化态Mo/Al2O3催化剂微观结构的影响。Sakashita等[8]以{110}晶面族为主要晶面取向(片状)及{111}和{100}晶面族为主要取向(球状)的两种不同晶面取向的氧化铝为载体制备了加氢催化剂,研究了晶面取向与催化剂活性之间的关系。齐和日玛等[10]以两种商品氧化铝为载体,制备了Co-Mo/Al2O3汽油选择性加氢脱硫催化剂,研究了氧化铝表面羟基数量和结晶度对载体与活性金属间相互作用的影响。同时前人应用红外光谱[11-16]、固体核磁共振[17-18]和理论计算[19]等对γ-Al2O3的表面性质与结构进行了研究,但影响氧化铝载体表面性质的本质尚不明确。γ-Al2O3结构与MgAl2O4尖晶石结构类似,氧阴离子以立方密堆积方式构成晶体骨架,而Al3+以四面体和八面体配位的形式分布其中。氧化铝表面Al3+、O2-两种离子的配位数都低于其在体相中的配位数,因而在表面存在空位,在室温下被水解离吸附生成的OH基或被配位水分子占据。 因此, 真正影响氧化铝表面性质的是氧化铝表面Al3+、O2-的类型和数量,而氧化铝表面Al3+、O2-的性质又是由氧化铝表面的晶面特性决定的,所以氧化铝的表面性质与其表面晶面特性直接相关。笔者采用水热法合成了两种不同晶面取向的氧化铝,研究了氧化铝表面性质与晶面特性之间的关系。
1 实验部分
1.1 氧化铝的制备
分别配制浓度为2 mol/L的AlCl3·6H2O和NaOH溶液。量取30 mL AlCl3·6H2O溶液于烧杯中,磁力搅拌下逐滴加入NaOH溶液调节n(OH-)∶n(Al3+)值分别为2.3和3.0,搅拌15 min,制得氢氧化铝沉淀。将氢氧化铝沉淀转入高压釜中于200 ℃水热处理24 h,沉淀经过滤、洗涤、120 ℃干燥6 h,550 ℃焙烧4 h,分别制得棒状和片状氧化铝,记作Al2O3-B、Al2O3-P。
1.2 氧化铝的表征
XRD表征:采用日本理学D/max2500型X射线衍射仪,测定样品物相结构及晶粒大小。实验条件:Cu靶,Kα辐射源,石墨单色器,管电压40 kV,管电流80 mA,扫描范围5°~40°,步长0.01°或0.1°,扫描速率1 (°)/min。
FT-IR表征:采用美国热电公司Nicolet-6700 傅里叶红外光谱仪(配MCT/A 检测器)。实验条件:将所测氧化铝样品压制成直径为13 mm的自支撑片,装入以CaF2为窗口材料的原位红外池中,然后将Al2O3样品在300 ℃真空脱水,再降至室温采谱,测定表面羟基结构。
酸性质表征:采用自制抽真空系统及测高仪测定Al2O3样品在特定温度下酸性质。实验条件:样品在反应管中于500 ℃、60 mPa净化4 h,降至室温,抽真空到0.1 mPa吸附吡啶,测定Al2O3表面酸性质。
TEM表征:采用日本JEOL公司生产的JEM-2100(HR)型透射电子显微镜,测定样品的微观结构。实验条件:加速电压200 kV。
2 结果与讨论
2.1 TEM表征
图1是两种氧化铝的低倍形貌像。
从图1可以看出:Al2O3-B为平均长度100 nm左右,平均直径为10 nm的均匀棒状结构,边缘光滑;Al2O3-P为边长约50 nm,厚度10 nm左右的片状结构,图中的条状结构并不是纳米棒,而是侧立的纳米片的投影,其宽度恰是纳米片的厚度。


图1 氧化铝的TEM低倍形貌(a)Al2O3-B;(b)Al2O3-P
图2为Al2O3-B不同取向的高分辨电镜照片。选区电子衍射图(SAED)显示样品为单晶。图2(a)为[0,1,-1]取向,(a)图高分辨放大图中,晶格间距0.2 nm,平行于纳米棒轴向,与γ-Al2O3的(400)晶面一致,所以纳米棒侧面为{100}晶面族。图2(b)为[1,-1,1]取向,(b)图高分辨放大图中,晶格间距0.28 nm,垂直于纳米棒的轴向,与γ-Al2O3的(220)晶面间距一致,所以纳米棒的端面为{110}晶面族。氧化铝纳米棒的模型图如图3(a)所示。通过研究发现氧化铝纳米棒主要暴露{100}晶面族和{110}晶面族,经计算得到{100}晶面族面占95.2%,{110}晶面族面占4.8%。
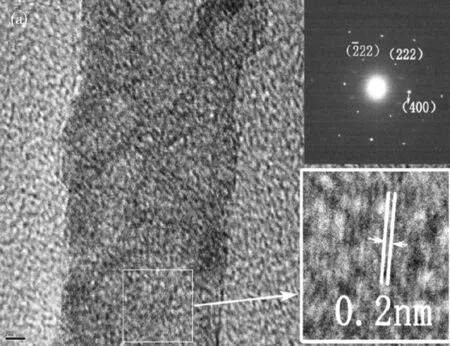

图2 Al2O3-B的高分辨及选区电子衍射
图4为样品Al2O3-P的高分辨电镜图以及对应的选区电子衍射图(SAED)。图4(a)纳米片平放时的正面高分辨,取向为[0,1,-1]。高分辨图像中,两个方向的晶格间距都为0.45 nm,分别平行于相邻的两个侧面。经测量,其夹角为71°,而实际(111)面夹角为70°32′。纳米片两个表面为对称的平行四边形,所以得出:侧面为{111}晶面族。
图4(b)为纳米片侧面高分辨图片以及对应的选区电子衍射图(SAED)。取向为[1,-1,1]。推测纳米片的上下表面为{110}晶面族。氧化铝纳米片的模型图如图3(b)所示。通过研究发现氧化铝纳米片主要暴露{110}晶面族和{111}晶面族,经计算得到{110}晶面族面占70.4%,{111}晶面族面占29.6%。
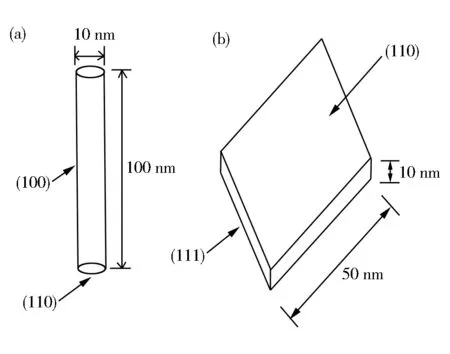
图3 氧化铝的形貌模拟(a)Al2O3-B;(b)Al2O3-P


图4 Al2O3-P的高分辨及选区电子衍射
2.2 XRD表征
图5为Al2O3-B和Al2O3-P的XRD谱。其衍射峰都在31.94°,37.60°,45.86°,60.90°,67.03°附近,与标准谱图(JCPDS PDF No.10-0425)对比,确定为立方相的γ-Al2O3,晶胞参数a=b=c=7.900 0×10-10,空间群为Fd-3m。没有杂峰出现,说明样品纯净,为γ-Al2O3。样品的衍射峰窄而尖锐,说明样品的结晶度很好,晶粒尺寸大。
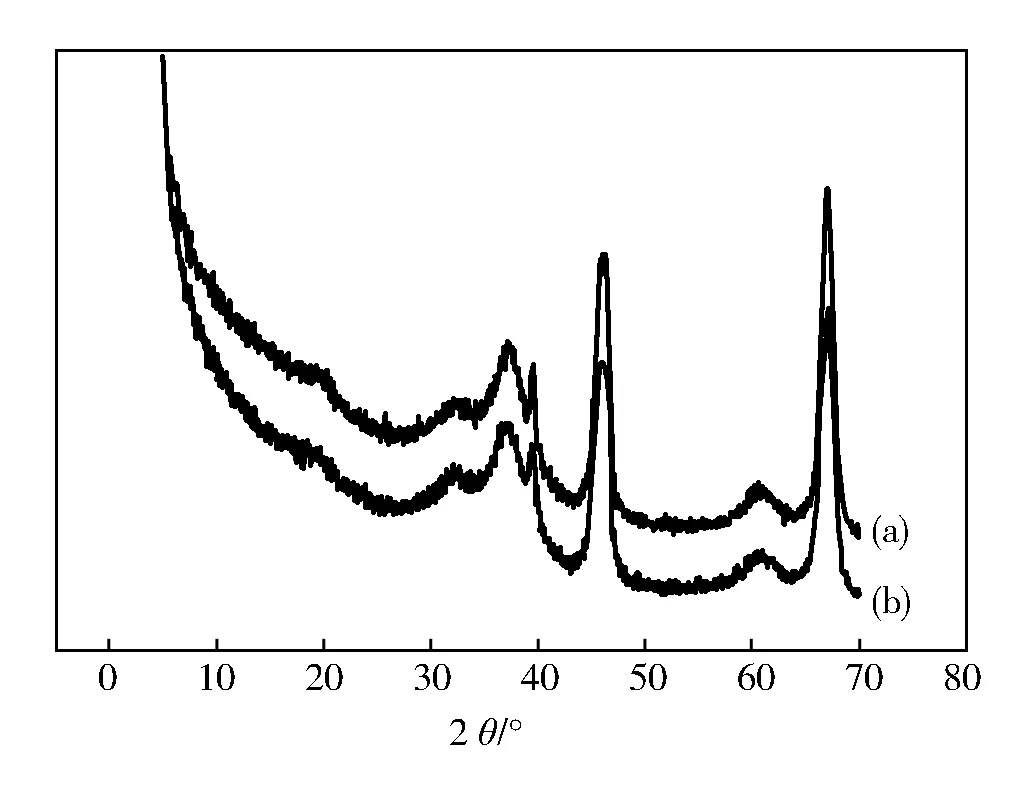
图5 氧化铝的XRD谱(a)Al2O3-B;(b)Al2O3-P
2.3 FT-IR表征
图6为样品Al2O3-B和Al2O3-P的红外光谱。

图6 氧化铝的红外光谱
从图6a可以看出:Al2O3-B的红外光谱图有3个吸收峰,分别位于3 707,3 679 cm-1和3 550 cm-1处。其中3 707 cm-1处的吸收峰为氧化铝(110)晶面HO-μ2-AlⅥ吸收峰[20],3 679 cm-1处的吸收峰为HO-μ3-AlⅥ吸收峰,该羟基主要存在于氧化铝(111)晶面及(100)晶面[21-22],另外,3 550 cm-1处存在一个较宽的吸收峰,该吸收峰归属于氧化铝(100)晶面HO-μ3-AlⅥ氢键的吸收峰,结合该处氢键的吸收峰可以确认3 679 cm-1处的吸收峰为(100)晶面HO-μ3-AlⅥ吸收峰。从图6b可以看出:Al2O3-P的红外光谱有4个吸收峰,分别位于3 752,3 733 ,3 707和3 679 cm-1处,其中3 752,3 733 cm-1处的吸收峰分别属于氧化铝(111)晶面HO-μ3-AlⅥ、HO-μ2-AlⅥ吸收峰[20],3 707 cm-1和3 679 cm-1处的吸收峰分别属于氧化铝(110)晶面HO-μ2-AlⅥ和HO-μ3-AlⅥ吸收峰。通过研究发现两种类型氧化铝的表面羟基性质与表面晶面特性存在很好的对应关系。
2.4 表面酸性质表征
通过吡啶吸附红外光谱对两种氧化铝的表面酸性质进行表征,结果如表1所示。

表1 氧化铝的表面酸性
从表1可以看出:两种氧化铝载体主要以L酸为主,B酸含量较低。其中氧化铝纳米片的L酸含量较高,约为氧化铝纳米棒的1.5倍。对于氧化铝而言,表面配位不饱和的铝离子是L酸中心,因此,氧化铝表面配位不饱和铝离子的类型和数量直接影响其表面酸性质。氧化铝不同晶面示意图如图6所示。
Raybaud等[20]通过计算发现氧化铝表面铝离子配位数越低其L酸性越强,Al2O3-P表面主要以(110)晶面为主,而Al2O3-B表面主要以(100)晶面为主。从图7可以看出:对于一个氧化铝晶胞,(100)晶面暴露16个6配位铝离子,而(110)晶面暴露16个6配位铝离子和23个4配位铝离子,(111)晶面暴露32个6配位铝离子,因此Al2O3-P的L酸量明显高于Al2O3-B。
3 结 论
通过控制n(OH-)∶n(Al3+)比例,采用水热法制备了棒状及片状两种形貌氧化铝,通过TEM和FTIR分析表征了两种氧化铝的晶面特性和表面性质。研究发现氧化铝的表面性质与晶面特性直接相关,棒状氧化铝表面以{100}晶面族为主,片状氧化铝表面以{110}晶面为主。棒状氧化铝表面有两种类型的羟基,分别属于(110)晶面HO-μ2-AlⅥ和(100)晶面HO-μ3-AlⅥ。片状氧化铝表面有4中类型的羟基,分别属于(111)晶面HO-μ3-AlⅥ、HO-μ2-AlⅥ和(110)晶面HO-μ2-AlⅥ和HO-μ3-AlⅥ。两种氧化铝表面以L酸为主,B酸含量较低,片状氧化铝表面L酸量约为棒状氧化铝表面L酸量1.5倍。氧化铝表面配位不饱和铝离子的类型和数量决定了载体表面的羟基类型和表面酸性质。不同表面性质及晶面特性的氧化铝与活性金属的作用方式以及对催化剂活性与活性相的影响有待进一步研究。


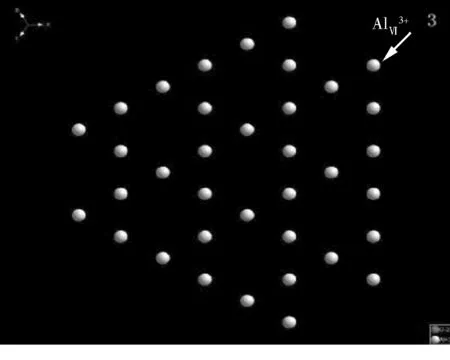
图7 氧化铝晶面示意1—(100)晶面;2—(110)晶面;3—(111)晶面
[1] Zhu H Y, Riches J D, Barry J C.γ-Alumina nanofibers prepared from aluminum hydrate with polyethylene oxide surfactant [J].Chem Mater,2002,14(5):2086-2093.
[2] 李大东.加氢处理工艺与工程[M].北京:中国石化出版社,2004:181-182.
[3] Meephoka C, Chaisuk C, Samparnpiboon P,et al.Effect of phase composition between nano γ- and χ-Al2O3on Pt/χ-Al2O3catalyst in CO oxidation [J].Catal Commum, 2008, 9:546-550.
[4] He S B, Sun C L, Bai Z W, et al.Dehydrogenation of long chain paraffins over supported Pt-Sn-K/Al2O3catalysts: A study of the alumina support effect [J].Appl Catal A,2009,356 (1):88-98.
[5] Domínguez-Crespo M A, Torres-Huerta A M, Díaz-García L, et al.HDS, HDN and HDA activities of nickel-molybdenum catalysts supported on alumina [J].Fuel Process Technol,2008,89:788-796.
[6] Domínguez-Crespo M A, Arce-Estrada E M, Torres-Huerta A M, et al.Support effects on hydrotreating activity of NiMo catalysts [J].Mater Charact,2007,58:864-873.
[7] Sakashita Y.Effects of surface orientation and crystallinity of alumina supports on the micro-structures of molybdenum oxides and sulfides [J].Surf Sci,2001,489:45-58.
[8] Sakashita Y, Araki Y,Shimada H.Effects of surface orientation of alumina supports on the catalytic functionality of molybdenum sulfide catalysts [J].Apple Catal A,2001,215(1):101-110.
[9] Sakashita Y, Yoneda T. Orientation of MoS2clusters supported on two kinds of γ-Al2O3single crystal surfaces with different indices [J]. Journal of Catalysis,1999,185(2): 487-495.
[10] 齐和日玛,李会峰.Al2O3性质对加氢脱硫催化剂Co-Mo/Al2O3活性相形成的影响 [J].催化学报,2011,32(2):240-249.
[11] Morterra C, Magnacca G.A case study surface chemistry and surface structure of catalytic aluminas, as studied by vibrational spectroscopy of adsorbed species [J].Catalysis Today,1996,27(3-4):497-532.
[12] Tsyqanenko A A, Mardilovich P P.Structure of alumina surfaces [J].Journal of the Chemical Society,Faraday Transactions,1996,92(23):4843-4852.
[13] Liu X.Drifts study of surface of γ-Alumina and its dehydroxylation [J].The Journal of Physical Chemistry C,2008,112(13):5066-5073.
[14] Morterra C, Bolis V, Magnacca G. IR spectroscopic and micro calorimetriccharacterization of lewis acid sites on(transition phase)Al2O3using adsorbed CO [J].Langmuir,1994,10(6):1812-1824.
[15] Gribov E N, Zavorotynska O, Agostini G, et al.FTIR spectroscopy and thermodynamics of CO and H2adsorbed on γ-,δ-and α-Al2O3[J]. Physical Chemistry Chemical Physics, 2010,12(24):6474-6482.
[16] Barzetti T, Selli E, Moscotti D, et al.Pyridine and ammonia as probes for FTIR analysis of solid acid catalysts [J]. Journal of the Chemical Society, Faraday Transactions,1996,92(8):1401-1407.
[17] Huggins B A, Ellis P D. Aluminum-27 nuclear magnetic resonance study of aluminas and their surfaces [J]. Journal of the American Chemical Society, 1992, 114(6):2098-2108.
[18] Lunsford J H.Characterization of acidity in zeolites and related oxides using trimethy phosphine as a probe [J].Topics in Catalysis,1997,4(1):91-98.
[19] Paglia G, Bozin E S, Billinge S J L.Fine-scale nanostructure in γ-Al2O3.Chemistry of Materials [J]. 2006,18(14):3242-3248.
[20] Digne M, Sautet P, Raybaud P, et al. Use of DFT to achieve a rational understanding of acid-basic properties of γ-alumina surfaces [J].Journal of Catalysis 2004,226:54-68.
[21] Todd H, Ballinger, John T,et al.IR spectroscopic detection of lewis acid sites on Al2O3using adsorbed CO correlation with Al—OH group removal [J].Langmuir,1991,7(12):3041-3045.
[22] Lavlley J C,Benaissa M.FT-IR study of the effect of pretreatment on the surface properties of alumina produced by flame hydrolysis of aluminium trichloride [J].Applied Catalysis 1986,24:249-255.

