苦瓜籽黄酮对油脂的抗氧化研究
肖付刚,孙军涛,王德国
(许昌学院食品与生物工程学院,河南许昌461000)
苦瓜籽黄酮对油脂的抗氧化研究
肖付刚,孙军涛,王德国
(许昌学院食品与生物工程学院,河南许昌461000)
用超声波辅助法提取苦瓜籽中总黄酮,应用响应面法优化了提取条件。结果表明,最佳提取工艺条件为:乙醇体积分数72.22%,超声提取时间38.67min,液料比为42.22mL/g,此条件下黄酮提取率达到3.89%。油脂抗氧化实验表明,苦瓜籽黄酮对花生油和芝麻油均具有抗氧化作用(以过氧化值为例),对芝麻油的抗氧化活性优于BHA,对花生油的抗氧化活性比BHA稍差。
苦瓜籽;黄酮;响应面实验;超声波辅助提取法;抗氧化活性
黄酮也称黄碱素,广泛存在于自然界,特别是植物中,由于最先发现的黄酮类化合物都具有一个酮式羰基结构,又呈黄色或淡黄色,故称黄酮[1-2]。黄酮具有多种生物活性,它的生理作用一直倍受人们关注。20世纪初中期发现其具有VC活性和抗油脂氧化活性,80年代以后,对其研究开始转向对活性氧自由基的清除及对老年病的防治功能上。许多研究已经证实,黄酮具有抗氧化、抗菌[3]和抗疲劳[4]、清除自由基[5]等作用。黄酮具有的药理活性和医学价值,使其在医药、食品领域有广阔的应用前景。
苦瓜籽为苦瓜的种子,苦甘、无毒[6]。苦瓜籽中含有丰富的活性物质,如VC、类胡萝卜素和黄酮等。关于苦瓜籽中生理功能成分研究主要集中在多肽、甙等[7-9],少见关于黄酮的报道。本试验选用乙醇作为提取剂,以超声波辅助法提取苦瓜籽中的黄酮类物质,为后续研究其抗氧化、抑菌等提供物质基础。苦瓜籽脂肪含量高,会增加提取物中脂溶性物质的含量,而影响黄酮类物质的纯度,所以本试验先采用索氏提取法脱去苦瓜籽中的脂肪,然后采用超声波辅助提取法提取苦瓜籽中的黄酮类物质。
1 材料与方法
1.1 材料、试剂与仪器
苦瓜:市售;花生油和芝麻油:市售新鲜压榨;乙醇、亚硝酸钠、硝酸铝、氢氧化钠均为国产分析纯;芦丁对照品(含量≥98%):上海生工生物有限公司。
752型紫外可见分光光度计:上海光学仪器厂;SK8210LHC超声清洗仪:上海科导超声仪器有限公司;BS124S电子分析天平:德国赛多利斯集团;HX-100型高速中药粉碎机:浙江省永康市溪岸五金药具厂;LGJ-10真空冷冻干燥机:北京四环科学仪器厂有限公司。
1.2 苦瓜籽黄酮的提取流程
苦瓜→苦瓜籽→烘干→粉碎过筛→索氏脱脂→乙醇溶液超声提取→离心分离→减压蒸馏→真空冷冻干燥→苦瓜籽总黄酮
1.3 芦丁标准溶液的配制与标准曲线绘制
以芦丁为标准品,采用亚硝酸钠-硝酸铝-氢氧化钠体系络合化学吸光法测定总黄酮含量。参考文献[10]的方法操作,测得芦丁标准溶液在511 nm处有最大吸收,以芦丁溶液浓度(mg/mL)为横坐标、吸光度为纵坐标绘制标准曲线,得到芦丁标准曲线的回归方程为Y=9.979X-0.005 9,R2=0.998 9,标准曲线在0mg/mL~0.05mg/mL浓度范围内线性良好。
1.4 苦瓜籽黄酮提取的单因素实验、响应面实验
在文献的基础上,首先拟定乙醇体积分数、料液比和提取时间进行单因素实验。在单因素实验的基础上,应用Design Expert7.0软件,利用Box-Behnken设计原理进一步进行3因素3水平的响应面分析试验确定最佳工艺参数。
1.5 苦瓜籽黄酮的油脂抗氧化实验
苦瓜籽黄酮对油脂的抗氧化试验采用Schaal烘箱法[11]。花生油和芝麻油两种油样,按0.5%分别加入提取的苦瓜籽黄酮和BHA,并设空白对照。按GB/T 5009.37-2003《食用植物油卫生标准分析方法》的方法每3天测定各油样的过氧化值[12]。
2 结果与讨论
2.1 乙醇浓度对苦瓜籽黄酮提取率的影响
乙醇浓度对苦瓜籽黄酮提取率的影响如表1。实验条件:液料比为40mL/g,超声提取时间30min。

表1 乙醇浓度对苦瓜籽黄酮提取率的影响Table1 Effect of ethanol concentration on the extraction rate of flavonoids from bitter melon seeds
结果显示,随着乙醇浓度的增加,苦瓜籽黄酮的提取率逐渐增大,乙醇浓度大于70%时,增长趋缓,从节省原料方面考虑,最适乙醇浓度选择70%。
2.2 液料比对苦瓜籽黄酮提取率的影响
液料比对苦瓜籽黄酮提取率的影响如表2。实验条件:乙醇浓度70%,超声提取时间30min。
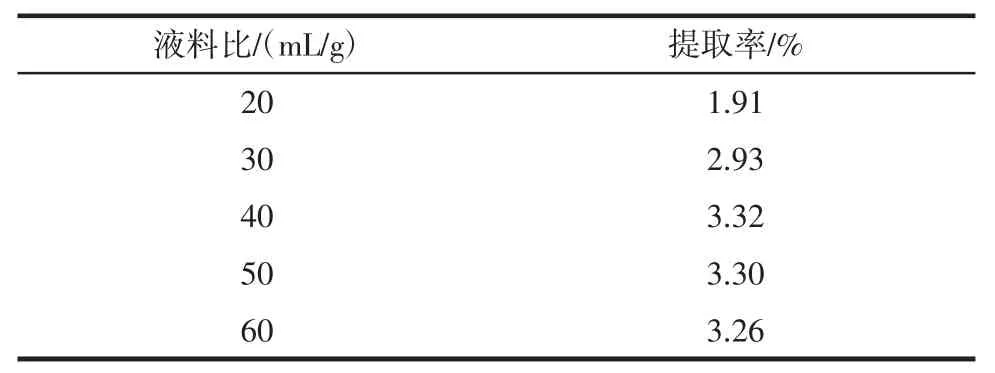
表2 液料比对苦瓜籽黄酮提取率的影响Table2 Effect of solid-liquid ratio on extraction rate of flavonoids from bitter melon seeds
结果显示,液料比20mL/g~30mL/g时提取率增加的幅度较大,30mL/g~40mL/g时提取率增加幅度明显放缓,当超过40mL/g时,提取率反而减少。因此,从提取效果、经济成本等方面综合考虑,选择液料比40mL/g为宜。
2.3 超声提取时间对苦瓜籽黄酮提取率的影响
超声提取时间对苦瓜籽黄酮提取率的影响如表3。实验条件:乙醇浓度70%,液料比40mL/g。

表3 超声提取时间对苦瓜籽黄酮提取率的影响Table3 Effect of extraction time on extraction rate of flavonoids from bitter melon seeds
结果显示,随着超声时间的增加,黄酮的提取率呈上升趋势。超声时间较短时,由于苦瓜籽中的黄酮没有与溶剂充分接触,提取率较低;但当超声时间大于40min时,提取率增长趋缓。这是因为有效成分浓度差是超声波提取的主要推动力,在提取初期,有效成分浓度差较大,故提取速率较快;当超声时间较长时,有效成分浓度差较小且黄酮的提取接近完全,故提取速率减慢。所以,综合考虑到能源消耗和提取效率等因素,可以选定最佳超声提取时间为40min。
2.4 响应面试验结果与分析
综合单因素试验的结果,利用Box-Behnken设计原理进一步进行3因素3水平的响应面分析试验,试验因素水平编码见表4,试验分析方案及结果见表5。

表4 Box-Behnken设计试验因素水平编码表Table4 Factors and levels table of Box-Behnken test
应用Design Expert7.0软件进行多元回归分析,得到以苦瓜籽中黄酮含量(y)为目标的二次多项式回归方程如下:

式中:液料比(x1)、乙醇体积分数(x2)和超声时间(x3)在设计中均经量纲线性编码处理,故方程中各项系数绝对值的大小直接反映了各因素对指标值的影响程度,系数的正负反映了影响的方向。
对超声提取苦瓜籽中黄酮的数学模型进行方差分析,以检验方程的有效性和各因子的偏回归系数,结果见表6。
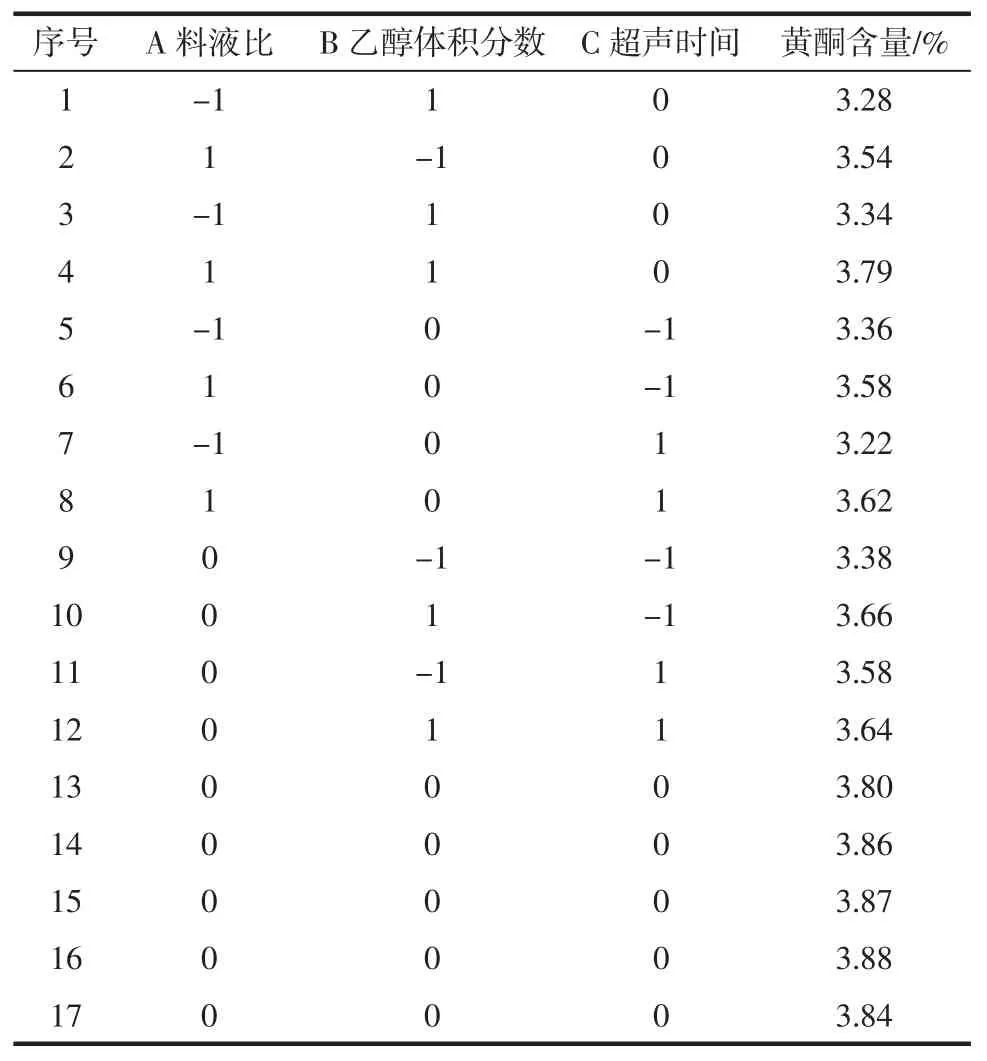
表5 响应面试验结果与分析Table5 Results and analysis of Response Surface Methodology(RSM)
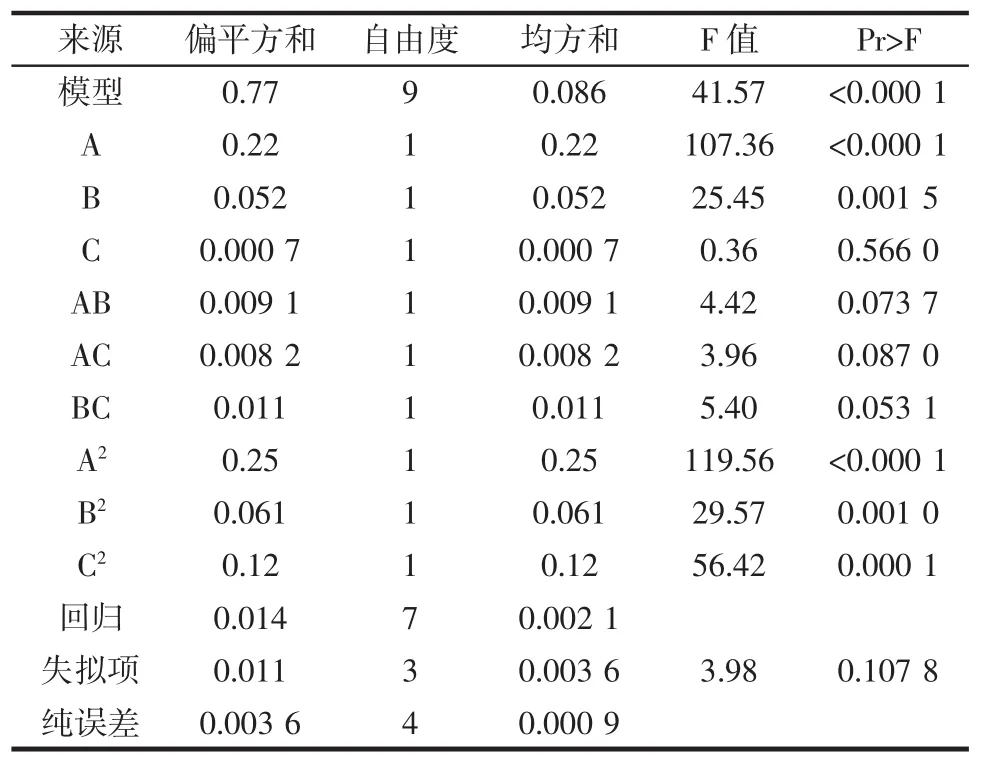
表6 方差分析表Table6 Table of analysis of variance
从表6可以看出,一次项中x1、x2的回归系数极显著,说明料液比和乙醇体积分数对黄酮得率有极显著影响;回归方差分析显著性检验结果表明,该模型回归显著,且失拟项不显著,说明该方程对试验拟合较好。
采用软件中Optimization的Numerical功能,在模型浓度范围内选择最低点为出发点,使用最大值优化,得到超声辅助提取苦瓜籽黄酮的理论最佳工艺条件为:液料比42.22mL/g,乙醇体积分数72.22%,超声时间38.67min,该条件下苦瓜籽总黄酮提取率为3.89%。
2.5 抗氧化试验结果与分析
根据试验数据绘制分别加入苦瓜籽黄酮、BHA以及空白对照的花生油(图1)和芝麻油(图2)的过氧化值变化曲线。

图1 花生油的抗氧化性试验结果Fig.1 Results of peanut oil oxidation resistance test
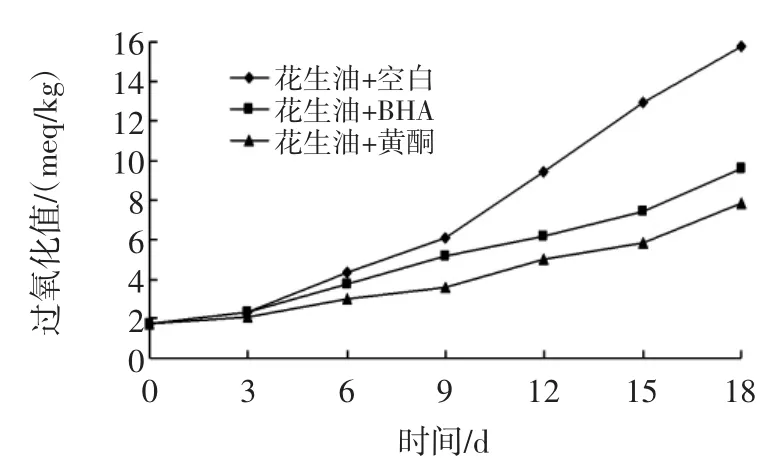
图2 芝麻油的抗氧化性试验结果Fig.2 Results of sesame oil oxidation resistance test
由图1和图2可知:苦瓜籽黄酮、BHA对花生油和芝麻油都有抗氧化效果。对芝麻油苦瓜籽黄酮比BHA的抗氧化效果好,但对花生油却比BHA的抗氧化效果稍差。原因可能是苦瓜籽黄酮为粗提物,并且在油中的溶解性不是很好,因此影响了抗氧化效果。即使在未完全溶解的情况下对芝麻油的抗氧化效果仍比BHA的好,说明苦瓜籽黄酮有很好的抗氧化效果。BHA是人工合成抗氧化剂,对人体存在一定的安全隐患,苦瓜籽黄酮为天然抗氧化剂,无毒副作用,因此苦瓜籽黄酮的应用前景广阔。
3 结论
通过单因素试验和Box-Behnken试验设计以及响应面分析法,对超声提取苦瓜籽总黄酮的工艺进行优化,得出的最佳工艺条件为液料比42.22mL/g,乙醇体积分数72.22%,超声时间38.67min,该条件下苦瓜籽总黄酮提取率为3.89%。并得到苦瓜籽总黄酮提取率与各因素变量的二次回归方程模型,该模型回归显著,对试验拟合较好,有一定应用价值。
油脂抗氧化实验表明,苦瓜籽黄酮对花生油和芝麻油均具有抗氧化作用(以过氧化值为例),对芝麻油的抗氧化活性优于BHA,对花生油的抗氧化活性比BHA稍差。
[1]李凤林,李青旺,冯彩宁,等.天然黄酮类化合物提取方法研究进展[J].中国食品添加剂,2008(5):59-63
[2]杨鹏,巨敏,朱沛沛,等.正交优化微波辅助提取枸杞中总黄酮的工艺研究[J].食品工业,2012(1):28-30
[3]谢鹏,张敏红.黄酮类化合物抑菌作用的研究进展[J].中国动物保健,2004(12):35-37
[4]洪雪娥,高荫榆,罗丽萍,等.薯蔓黄酮的抗疲劳作用研究[J].食品科学,2006,27(2):256-258
[5]MONTORO P,BRACA A,PIZZA C,et al.Structure—antioxidant activity relationships of flavonoids isolated from different species[J]. Food Chemistry,2005,92:349-356
[6]李时珍.本草纲目[M].北京:中医药出版社,1988:16
[7]郭红莲,张泽生.苦瓜籽中营养成分及抗菌蛋白的研究[J].粮油加工与食品机械,2005(6):77-78
[8]傅明辉,田洁.苦瓜籽核糖体失活蛋白的分离纯化及抗氧化活性的研究[J].中国生化药物杂志,2002,23(3):134-136
[9]夏柯,颜钫,叶杨,等.苦瓜籽总甙体外抗HSV—l和RSV活性研究[J].四川大学学报:自然科学版,2007.44(1):160-162
[10]张玉香,屈慧鸽,杨润亚,等.响应面法优化蓝莓叶黄酮的微波提取工艺[J].食品科学,2010,31(16):33-37
[11]魏东.微胶囊多不饱和脂肪酸粉末的氧化稳定性研究[J].食品工业科技,2007,28(7):88-89
[12]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.37-2003食用植物油卫生标准分析方法[S].北京:中国标准出版社,2004:1-8
Study on Extraction and Antioxidant Activity of Flavonoids from Bitter Melon Seed
XIAO Fu-gang,SUN Jun-tao,WANG De-guo
(School of Food and Bioengineering,Xuchang University,Xuchang461000,Henan,China)
Ultrasonic-assisted extraction was applied to extract flavonoids from bitter melon seeds. Response surface methodology (RSM) was applied to optimize the extraction conditions. The result showed that the optimal extraction conditions of ethanol concentration, extraction time and liquid-to-material ratio were 72.22%, 38.67min and 42.22 mL/g, respectively. Under these conditions, the extraction rate of flavonoids was 3.89 %. Result of antioxidation experiment in oil suggested that flavonoids from bitter melon seeds had antioxidant effects on both peanut oil and sesame oil, and the antioxidant activity to sesame oil was better than BHA, but which to peanut oil was slightly lower than BHA.
bitter melon seeds;flavonoids;response surface methodology(RSM);ultrasonic-assisted extraction;antioxidation activity
10.3969/j.issn.1005-6521.2014.010.006
2014-01-13
国家自然科学青年基金(21107090);河南省高等学校青年骨干教师资助计划(2013GGJS-168);许昌学院教研项目(02013128)
肖付刚(1978—),男(汉),副教授,博士,研究方向:粮油食品,食品质量安全。

