罗汉果茎段快繁技术研究
王小敏 叶晓霞 龙海桂
(玉林师范学院 生命科学与技术学院, 广西 玉林 537000)
罗汉果茎段快繁技术研究
王小敏 叶晓霞 龙海桂
(玉林师范学院 生命科学与技术学院, 广西 玉林 537000)
为了获得高质量的罗汉果组培苗,本文主要探究罗汉果从外植体诱导到幼苗移栽的整个过程。实验结果表明:外植体消毒的最佳方法为10%过氧化氢,消毒3min,污染率最低,而外植体成活率高达80%。MS+IBA0.5mg/L+6-BA1.0mg/L和MS+IBA0.5mg/L+6-BA1.5mg/L有利于罗汉果的增殖,其增殖系数达4.45,1/2MS+6-BA1.0mg/L+IBA0.5mg/L最适合罗汉果根的分化。移栽初期有光照并经过炼苗的移栽方法成活率最高,幼苗移栽成活率在80%以上。
罗汉果;丛生芽;增殖;组织培养
罗汉果(Grosvenor Momordica)是葫芦科罗汉果属的多年生藤本药用植物,已广泛应用于医药、保健食品、食品领域。罗汉果对生境的要求较为严格,为我国特有珍贵药材。广西永福、临桂两县为罗汉果的栽培起源中心,而且由于该地独特的土壤环境和气候特点,所产的罗汉果品质优良,具有较好的保健和疗效,在东南亚、日本、欧美等国家誉为“东方神果”。罗汉果含有丰富的果糖、蛋白质、氨基酸类、脂肪酸类和多种维生素等众多成分,其中罗汉果甜甙是主要成分,营养价值和药用价值高[1],近年来,国内外市场上越来越多的罗汉果产品被竞相开发,对罗汉果的需求也急剧增长[2]。罗汉果以种植雌株为主,而种子繁殖后代中雄株比例偏高,所以在传统的生产方式中主要利用雌株压蔓的方式生产种苗,繁殖系数低,且易患病毒病,难以满足生产的需要。利用组织培养技术快速繁殖罗汉果种苗,不仅可以加速品种繁育,而且能在一定程度上保持母本的优良性状。罗汉果组培苗具有种苗不带病毒、繁殖系数高、当年挂果、产量高、不受季节和气候条件影响的优势,所繁殖的组培苗能满足生产的大量需求[3]。目前生产上主要通过种植脱毒组培苗来减少种性退化和病毒病问题,但也出现一些问题,包括组培苗成活率低、遗传性状不够稳定等[3-4]。为了实施组培苗标准化工程,规范种苗市场,适应罗汉果规范化生产要求,本文试对罗汉果从外植体诱导到幼苗移栽的整个过程进行研究,以期为罗汉果种苗的标准化和市场的规范化提供依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
外植体取自广西永福县健康无病毒、挂果率高的罗汉果植株。
1.2 实验方法
1.2.1 外植体的消毒试验
将选取的茎段在超净工作台上用75%酒精预消毒30s,用无菌水冲洗3次,然后分别用0.1%升汞(HgCl2)消毒液和10%过氧化氢(H2O2)分别消毒时间为3、5、7min,并用无菌水分别冲洗5次。然后接入MS+6BA1.0mg/L+IBA0.5mg/L培养基中,培养温度为25±1℃,光照12h/d,光照强度为2500lx,培养10d后调查外植体污染情况。
1.2.2 6-BA浓度对罗汉果增殖效果的影响试验
将无菌苗3~5cm腋芽切割后分别接种在MS+ IBA0.5mg/L+6-BA(0.3、0.5、1.0、1.5、2.0)mg/L各种培养基上,各种培养基均添加蔗糖30g/L、琼脂5 g/L,调pH至5.8~6.0,每种培养基接5瓶,每瓶接4个茎段进行培养。培养温度为25±1℃,光照12h/d,光照强度为2500lx,30d后统计丛生芽的增殖率及芽的生长情况。
1.2.3 生长素浓度对罗汉果根分化的影响试验
将分化获得的3~5cm腋芽切割后分别接种在:MS+6-BA1.0mg/L+IBA(0.2、0.4、0.5、0.6)mg/L培养基上,各种培养基均添加蔗糖30g/L、琼脂5 g/L,调PH至5.8~6.0。每种接5瓶,每瓶接4个茎段进行培养。培养温度为25±1℃,光照12h/d,光照强度为2500lx,30d后统计丛生芽的诱导率及芽的生长情况。
1.2.4 罗汉果移栽试验
将生根良好健壮的幼苗培养瓶分成两组,一组幼苗拿到室外进行炼苗,在散射光条件下培养5d,使培养瓶中幼苗适应外部环境然后移栽。另一组作为对照,直接从瓶中取出幼苗,洗去基部培养基进行移栽。移栽基质为珍珠岩和泥炭土按体积比1:1混合,并经高温灭菌。移栽后,将炼苗的和未炼苗的小苗各分成2组,一组初期盖上遮阳网,连续盖10d后才移除,另一组除了地膜不用遮阳网遮盖,以利于其进行光合作用。在幼苗生长期间,两组幼苗要提供相同的水热肥气等培养条件,以防其他因素干扰试验结果。每组苗移栽10棵,20d后统计移栽成活率。
1.2.5 统计分析
所有实验结果用dps7.05软件进行差异显著性分析。
2 结果与分析
2.1 不同表面消毒剂处理对罗汉果茎段灭菌及成活率的影响
用不同表面消毒剂处理接种,20d后统计茎段污染率及成活率,结果见表1。由表1可见:0.1%升汞和10%过氧化氢对外植体灭菌效果都很明显,但对发芽率有明显影响。用0.1%升汞处理的茎段污染率基本控制在10%以下,说明灭菌效果较好,但成活率随灭菌时间延长而显著下降,最高成活率在处理3min时,达到60%。用10%过氧化氢处理的茎段污染率也控制在10%以下,成活率较升汞有明显提高,在处理3min时的成活率达到76.7%,效果较好。
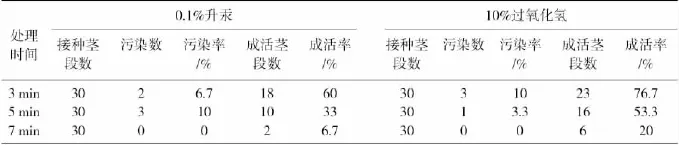
表1 不同消毒时间对罗汉果种子萌发率影响
2.2 不同6-BA浓度对罗汉果增殖效果的影响
在罗汉果丛生芽增殖阶段,采用MS+ IBA0.5mg/L的培养基添加不同浓度6-BA研究丛生芽增殖的情况,培养20d进行统计分析(结果见表2)。由表2得知:不同6-BA浓度对罗汉果增殖效果有明显的影响。在一定范围内,随着6-BA浓度的升高,增殖系数也随之增高,当达到最大值后,6-BA会抑制芽的增殖。增殖效果最好的6-BA浓度为 1.5mg/L,增殖系数达到 4.45,其次为1.0mg/L,增殖系数为4.2,在平均芽长和平均直径上都与其处理条件达到极显著的差异。而且在这两个浓度下,丛生芽叶片颜色及长势都较好,平均芽长、平均芽直径都比其他浓度6-BA生长下的丛生芽好。因此罗汉果增殖适宜培养基为MS+ IBA0.5mg/L+6-BA1.0mg/L和MS+IBA0.5mg/L+6-BA1.5mg/L。
2.3 不同生长素浓度对罗汉果根分化影响实验的结果与分析
当分化的芽长至约4cm时,将芽接入生根培养基,培养30d后统计根生长状况。生根培养基采用
1/2MS+6-BA1.0mg/L附件不同浓度的IBA(结果见表3)。结果表明:IBA对生根影响明显,随着IBA浓度的升高,生根率随之增高,同时根生长状况也逐渐变好,当IBA浓度达到0.5mg/L时,生根率达到最高,为50%,而且根多、粗壮,在平均根长、平均根直径上都与其他处理达到了极显著差异。当IBA浓度达到0.6mg/L时,生根率下降。因此,适宜罗汉果生根的培养基为1/2MS+6-BA1.0mg/L+IBA0.5mg/L。
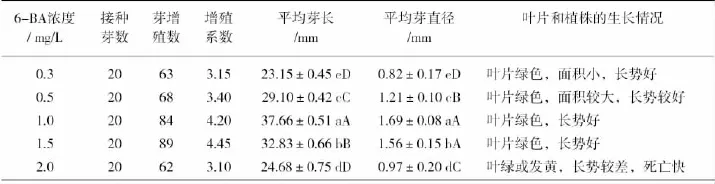
表2 不同6-BA浓度对罗汉果增殖效果的影响
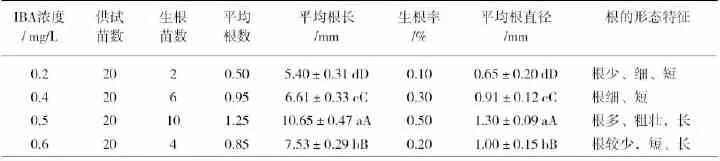
表3 不同生长素浓度对罗汉果根分化影响
2.4 光照及炼苗对罗汉果移栽成活率的影响
在罗汉果组培苗移栽阶段,炼苗、光照处理对组培苗移栽成活率影响较大,结果见表4。表4结果表明:在移栽初期,在避光条件下,移栽组培苗成活率较低,最高成活率只有10%,而光照条件下,组培苗移栽成活率达到80%。同时,炼苗也对移栽成活率影响明显,在避光条件下,炼苗处理后,组培苗移栽成活率达到10%,不炼苗的一组全部不能成活。而在光照条件下,炼苗处理后,组培苗成活率达到80%,不炼苗处理的组培苗成活率仅为30%。
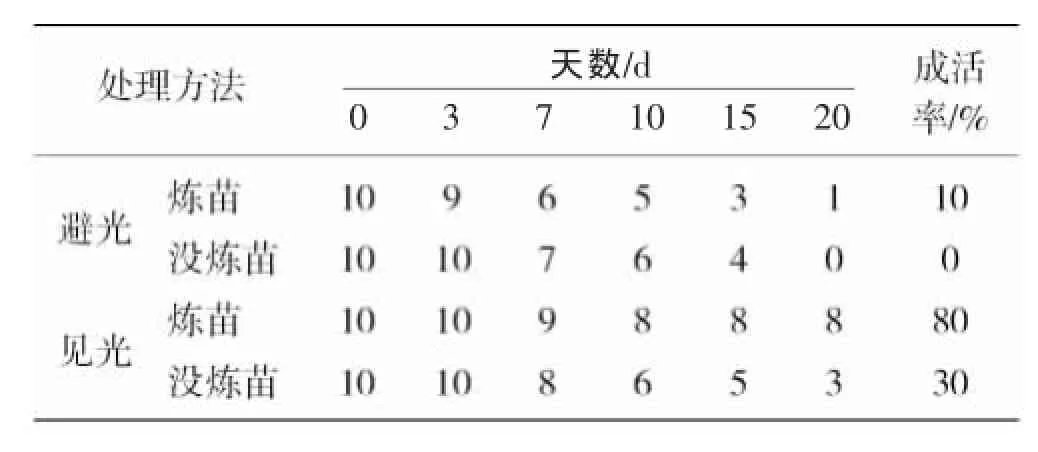
表4 移栽初期不同处理方法对罗汉果成活率的影响
3 结果与讨论
罗汉果的组织培养研究始于1980年[5],经过多年的发展,组培苗生产技术日趋成熟。然而,不同公司或批次的苗木存在着定植成活率、开花结果株率等方面的不稳定性,造成了不同程度的经济损失,增加了种植风险。对罗汉果组织培养研究,摸索更有利于组培苗生产的全过程仍具有较强的实际指导意义。
在外植体选择方面,选择健康、挂果率高的优良品种是保证组培苗生产的重要前提[6-7]。本课题组选择罗汉果原产地桂林永福优良的罗汉果品系茎段作为外植体,保证了种源的可靠性。
细胞分裂素对细胞的分裂增殖起着重要的调节作用[8]。本研究结果也显示,随着细胞分裂素6-BA浓度的增加,丛生芽增殖率也逐步提高,适宜的6-BA浓度为1.0-1.5mg/L,考虑到生产成本的因素,最适宜的浓度选择为1.0mg/L。很多的研究表明生长素浓度对组培苗生根影响明显,但不同的研究表明在生根阶段所使用的激素种类和浓度却有所差异[9-11]。本研究表明,IBA浓度为0.5mg/L时,罗汉果生根较好,生根率和根生长状况都良好,能够满足生产需要。
提高移栽成活率是组培苗工厂化生产的最后环节。罗汉果是一种喜光而不耐强光的植物[12],因此光照对于罗汉果影响较大。本研究结果表明炼苗与光照对罗汉果的移栽成活率较大,经过炼苗处理与移栽初期进行光照培养,移栽成活率可达80%,可能与光照可帮助幼苗进行光合作用,吸收养分,促进根的固定化有关。
4 结语
罗汉果是我国特有的中药材,提高罗汉果组培苗的产量和质量将为推广和种植罗汉果奠定基础。影响罗汉果组培苗生长因素很多,本文从影响罗汉果组培苗生长的几个关键因素进行研究,为罗汉果组培苗规范化生产及组培快繁体系奠定基础。
[1]朱华,陈小波,梁昌祥,等.罗汉果研究概况[J].中国中医药信息杂志,2008(S1):100-102.
[2]袁辉.桂林市罗汉果产业现状及发展对策[J].广西园艺, 2006(6):9-11.
[3]白隆华,蒲瑞翎.罗汉果组培苗栽培技术特点及存在的问题[J].中国医学生物技术应用,2004(1):63-66.
[4]付长亮,马小军,白隆华,等.罗汉果组织培养研究进展[J].中国中药杂志,2005(5):325-328.
[5]林荣,王润珍.罗汉果组织培养获得完整植株[J].广西植物, 1980(01):11+73.
[6]苏玉卿.罗汉果优良品系的选育及组培快速繁殖[D].桂林:广西师范大学,2003.
[7]莫长明,白隆华,马小军,等.罗汉果组培苗繁育标准操作规程研究[J].时珍国医国药,2008(9):2092-2094.
[8]吴晓霞.细胞分裂素与细胞的分裂增殖[J].安徽农业科学, 2007(36):11755-11756.
[9]黄春梅,吴金寿,赖钟雄.罗汉果组织培养与快繁研究进展[J].亚热带农业研究,2006(4):298-303.
[10]陆飞,唐燕梅,韦鹏宵,等.不同激素组合对罗汉果‘桂青1号’生根诱导的影响[J].中国园艺文摘,2013(7):3-5.
[11]蒙爱东,白隆华,蒲瑞翎.罗汉果组培苗的生根培养[J].广西医学,2006(6):803-805.
[12]韦荣昌,唐其,马小军,等.罗汉果组培苗种植关键技术.中国南方果树[J].2013(3):95-97.
(责任编校:马余平)
Study on the Rapid Propagation Technology of Siraitia Grosvenorii Stem
WANG Xiao-min YE Xiao-xia LONG Hai-gui
(College of Life Science and Technology,Yulin Normal College,Yulin,Guangxi 537000)
The research aimed to obtain high-quality tissue culture seedlings of Siraitia Grosvenorii.This research had mainly explored the whole process of Siraitia Grosvenorii from explant inducement to transplanting seedlings.The results showed that:The best way of sterilizing was obtained after 3 minutes surface disinfection Siraitia Grosvenorii explant in (10%)H2O2 solution and the highest explants survival rates reached 80%.The mediums of MS+IBA0.5+6-BA1.0 mg/L and MS+IBA 0.5 mg/L+6-BA 1.5 mg/L were propitious to the propagation of bud clusters and multiplication coefficient was more than 4.45.The medium of 1/2MS+6-BA 1.0 mg/L+IBA 0.5 mg/L was suitable for the differentiation of Siraitia Grosvenorii.root.At the early stage after transplanting,the seedling of survival rate was highest with illuminating and seedling adaptation,and the survival rate of transferred plantlets was up to 80%.
Siraitia Grosvenorii.;clustered buds;proliferation;tissue culture
S 567
A
1672-738X(2014)01-0069-04
2014-01-02
2012年广西自然科学基金青年项目 (2012GXNSFBA053076)和2013年玉林师范学院校级博士启动基金(G20130013)。
王小敏(1979—),男,广西全州人,生物讲师,理学博士。主要研究方向:植株细胞工程与基因工程。

