VPA 对OA 处理的SH-SY5Y 细胞tau 蛋白磷酸化水平的影响
胡江平,蔡克瑞,金花淑,金在顺,李凯军
阿尔茨海默病(Alzheimer's disease,AD)是一种神经系统退行性疾病,以进行性痴呆为主要特征,主要的临床表现为:进行性记忆力减退、认知功能下降及严重的精神障碍。其主要的病理特征是:老年斑(senile plaques,SP)、神经原纤维缠结(neurofibrillary tangles,NFTs)、海马锥体细胞颗粒空泡变性和胆碱能神经元缺失。SP 和NFTs 是AD 的两个标志性病理改变,这两种损害都是病理性蛋白沉积的结果:细胞外β 淀粉样蛋白(Aβ)沉积导致SP 形成;细胞内自我聚集的高度磷酸化的tau 蛋白则是形成NFTs 的结构基础[1]。
Tau 蛋白是一种微管相关蛋白,其与成熟神经元结合,对微管形成和稳定微管起重要作用[2,3]。Tau 蛋白磷酸化对tau 与微管的结合至关重要。但是,异常磷酸化的tau 蛋白聚合成配对的双螺旋细丝(paried helical filaments,PHFs),不利于与微管结合并导致微管网络的不稳定和神经元的死亡[4]。异常磷酸化使tau 蛋白生物学活性丧失,并且与微管蛋白竞争结合正常tau 蛋白或从已经形成的微管上夺取tau 蛋白,导致正常情况下其稳定微管和促进微管蛋白聚合成微管的作用消失,Tau 蛋白的过度磷酸化被认为是关键因素。AD 患者脑中tau 蛋白总量多于正常人,正常tau 蛋白减少而异常过度磷酸化tau 蛋白大量增加,而且数量与患者的痴呆程度成正相关,在痴呆发展过程中起重要作用[5,6]。因此,过度磷酸化的tau 蛋白与AD 的形成和发展有着密切的联系。
冈田酸(Okadaic acid,OA)是一种海洋生物提取物,可选择性抑制蛋白磷酸酯酶,对PP2A 作用最强,使蛋白高度磷酸化,并可以引起氧化损伤,在离体培养的海马神经元中能够诱导tau 蛋白过度磷酸化;OA 对于磷酸酶的调节作用不仅是通过抑制磷酸酶的活性,同时还可以间接激活丝裂原激活蛋白激酶(MAPK)等其它酶完成。正常情况下磷酸化tau 蛋白分布在神经元突起,而非磷酸化的tau 蛋白分布在胞体,经过OA 处理的磷酸化与非磷酸化tau蛋白均趋于胞体内,提示过度磷酸化驱使tau 蛋白在胞体内聚集。OA 在体内能促进Aβ 沉积,造成神经元退化,突触缺失及记忆障碍,产生类似AD 样病理特征。Tau 蛋白的过度磷酸化又促进了APP 蛋白的表达,推测在tau 蛋白的过度磷酸化与Aβ 生成之间可能存在一种调节机制,使AD 出现Aβ 沉积和tau 蛋白的过度磷酸化、NFTs 之间存在相互促进机制,造成AD 患者临床症状加重。因此选用OA 孵育SH-SY5Y 细胞制备tau 蛋白过度磷酸化的细胞模型。
为了在体外验证VPA 对tau 蛋白磷酸化的影响,我们选用SH-SY5Y 细胞作为研究对象,观察VPA 对OA 处理的SH-SY5Y 细胞tau 蛋白磷酸化的影响。
1 材料与方法
1.1 材料 人神经母细胞瘤细胞(SH-SY5Y)购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,DMEM 培养基购自美国Invitrogen公司,胎牛血清购自美国Invitrogen 公司,胰蛋白酶购自美国Invitrogen 公司,冈田酸购自美国santa cruz 公司,小鼠抗p-tau (Thr231)购自美国Invitrogen 公司,小鼠抗GAPDH 抗体购自Kangchen 公司,蛋白marker 购自NEB 公司,PVDF 膜购自美国Millipore 公司,ECL 试剂盒购自美国Pierce 公司,四甲基偶氮唑盐(MTT)购自美国Sigma 公司,DMSO 购自美国Sigma 公司,青霉素、链霉素及其他试剂均为国产分析纯试剂。
1.2 实验分组 常规细胞培养后分为3 组。(1)V 组:正常培养细胞,未加其它干预的SH-SY5Y细胞,加等体积的无血清培养基;(2)C 组:40 nmol/L OA 孵育SH-SY5Y 细胞12 h 后,加入等体积的无血清培养基;(3)T 组:40 nmol/L OA 孵育12 h 后加入10 mmol/L VPA 孵育12 h。
1.3 细胞培养 SH-SY5Y 细胞复苏后,加入适量含10%胎牛血清的DMEM 培养液,将其吹打成细胞悬液,均匀接种于培养瓶中,于37 ℃、5%CO2、100%湿度CO2培养箱中静置培养。
1.4 MTT 测定 细胞用含10%胎牛血清的DMEM 培养液配成单细胞悬液,每孔100 μl 接种于96 孔培养板,移入培养箱,待细胞完全贴壁后,每孔加入终浓度分别为20、40、80、160 nmol/L 的含有OA 的培养液,对照组加等体积的培养液。每种浓度6 个复孔,培养12 h 后,每孔加入5 mg/ml MTT 20 μl,继续孵育3 h,弃上清,每孔加150 μl DMSO,在水平摇床上震荡10 min,使结晶物充分溶解,酶标仪测定光密度值(490 nm);VPA 的MTT 测定方法同上,浓度分别为1、10、20、50、70、100 mmol/L。
1.5 Western blot 检测 收集细胞后进行蛋白提取及浓度的测定,经灌胶、每管50 μg 加样、电泳(浓缩胶内电泳时的电压为90 V,其进入分离胶后将电压调整为110 V)、50 V 室温转膜2 h、5%脱脂奶粉溶液室温封闭1 h、一抗及二抗孵育后,应用HRP-ECL 发光法检测蛋白,用BIO-RAD 凝胶电泳图像分析仪进行图像采集,Image J 软件进行图像分析。
1.6 统计学处理 应用SPSS 16.0 软件,结果以均值±标准差()表示,经方差齐性检验后,对数据进行t 检验,P <0.01 被认为有显著性差异。
2 结果
2.1 OA 对SH-SY5Y 细胞活力的影响 SHSY5Y 细胞经不同浓度OA 处理12 h 后,测定OD值,以正常对照组细胞活力为100%,其余各组OD值与之相比得到各自的细胞活力,结果显示:当OA浓度大于40 nmol/L 时,细胞活力受到明显的抑制,且随着OA 浓度的增加而增强,而低于此浓度的OA对细胞活力没有明显的影响(见图1)。我们选择细胞活力在80%以上的药物浓度处理细胞。
2.2 VPA 对SH-SY5Y 细胞活力的影响 SHSY5Y 细胞经不同浓度VPA 作用12 h 后,测定OD值,以正常对照组细胞活力为100%,其余各组OD值与之相比得到各自的细胞活力。当VPA 浓度小于20 mmol/L 时,细胞活力维持在80%以上(见图2)。我们选择10nmol/LVPA 作为实验浓度。
2.3 VPA 对OA 处理的SH-SY5Y 细胞tau 蛋白磷酸化的影响 SH-SY5Y 细胞经OA 处理(40 mmol/L,12 h)后,加入VPA(10 mmol/L,12 h)提取细胞蛋白,检测p-tau 和总tau 在Thr231 位点的表达水平。Western blot 结果显示,T 组的tau 蛋白磷酸化水平与C 组相比降低了37.1%,与V 组水平相近。光密度值以GAPDH 作为内参校正。数据以平均数±标准差()表示,与对照组相比**P <0.01(见图3)。
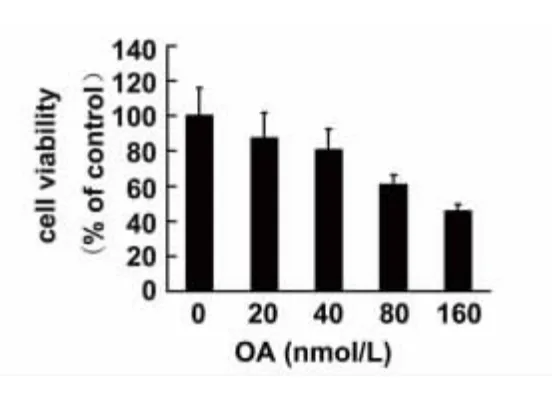
图1 OA 对SH-SY5Y 细胞活力的影响
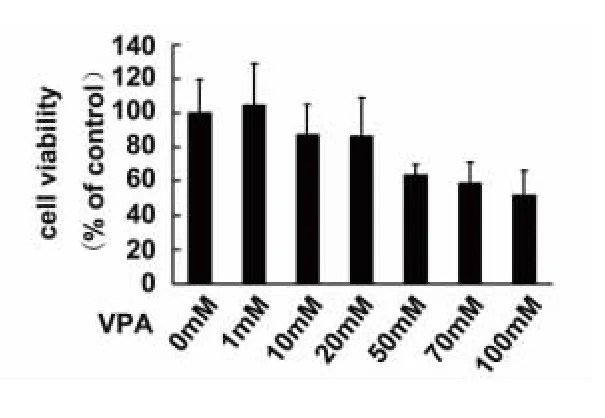
图2 VPA 对SH-SY5Y 细胞活力的影响
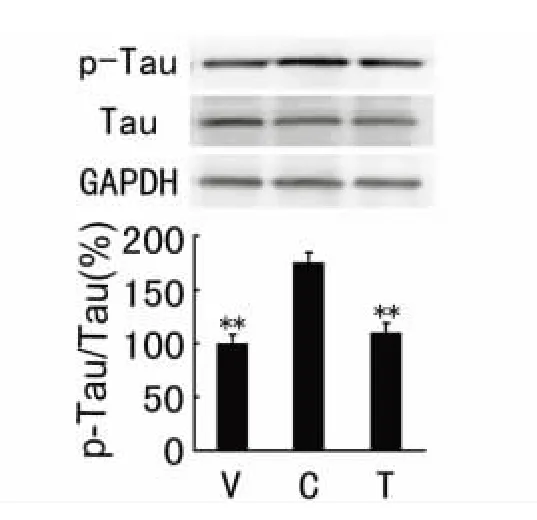
图3 VPA 对OA 处理的SH-SY5Y 细胞tau 蛋白磷酸化的影响
3 讨论
AD 的重要病理变化之一是神经细胞内的NFTs形成,其主要成分就是过度磷酸化的tau 蛋白[7],Tau 是一种微管相关蛋白,与成熟神经元结合,对促进微管形成、稳定微管系统起着重要作用。Tau 蛋白磷酸化对tau 与微管的结合至关重要,异常磷酸化的tau 蛋白聚合成PHFs,不利于与微管结合并导致微管网络的不稳定和神经元死亡。NFTs 的形成与tau 蛋白过度磷酸化密切相关,在AD 患者脑中,过度磷酸化的tau 蛋白明显增加,且NFTs 的数量与痴呆患者的程度呈正相关[8]。在AD 脑组织中,异常过度磷酸化的tau 蛋白含量显著增高,并聚集成双螺旋细丝,Tau 磷酸化程度的增加使tau 结合微管的能力下降,从而丧失了促进微管组装的生物活性,导致细胞骨架的结构异常和神经细胞死亡。AD 患者有21个异常磷酸化位点,其中研究较多的有Ser199、Thr205、Thr212、Thr231、Ser396 和Ser404 等多个磷酸化位点[9],本实验选取常用的Thr231 位点进行检测。
OA 能够阻止tau 蛋白的去磷酸化,导致tau 蛋白的异常过度磷酸化,产生AD 样的病理过程[10],适合用来制备AD 时tau 蛋白过度磷酸化的细胞模型。MTT 实验表明,OA 浓度大于40 nmol/L 时,细胞活力受到明显的抑制,因此我们选择40 nmol/L OA 处理12 h 作为制备AD 时tau 蛋白过度磷酸化的细胞模型。在制备tau 蛋白磷酸化的细胞模型后,进一步观察VPA 对tau 蛋白磷酸化的影响。采用40 nmol/L OA 作用于SH-SY5Y 细胞,建立tau 蛋白磷酸化的细胞模型,然后给予VPA 处理,观察其对tau 蛋白磷酸化水平的影响,当VPA 浓度小于20 mmol/L 时,细胞活力维持在80%以上,我们选择10 mmol/L VPA 作为实验浓度,Western blot 检测显示,VPA 可以降低OA 处理的细胞模型在Thr231 位点的tau 蛋白磷酸化水平。
本实验结果表明,对于OA 诱导的SH-SY5Y 细胞给予VPA 处理,Tau 蛋白磷酸化水平明显降低,与正常细胞tau 蛋白磷酸化水平相当,表明VPA 对tau 蛋白磷酸化具有明显的抑制作用,说明VPA 对AD 的治疗具有积极的作用,其机制很可能是通过减少tau 蛋白磷酸化水平而发挥作用的。
[1]Iqbal K,Liu F,Gong CX,et al.Tau in Alzheimer disease and related tauopathies[J].Curr Alzheimer Res,2010,7(8):656 -664.
[2]Hu JP,Xie JW,Wang CY,et al.Valproate reduces tau phosphorylation via cyclin-dependent kinase 5 and glycogen synthase kinase 3 signaling pathways[J].Brain Res Bull,2010,85(3~4):194 -200.
[3]李凯军,李志强,郭丽双,胡江平.雌激素阻抑OA 诱导的SHSY5Y 细胞tau 蛋白磷酸化[J].中风与神经疾病杂志,2012,29(4):335 -337.
[4]Lahiri DK.Current Alzheimer research:update on lipids,estrogen,neurotrophins and their roles in neurodegeneration[J].Curr Alzheimer Res,2008,5(1):1 -3.
[5]Alonso AC,Li B,Grundke-Iqbal I,et al.Mechanism of tau-induced neurodegeneration in Alzheimer disease and related tauopathies[J].Curr Alzheimer Res,2008,5(4):375 -384.
[6]Crowther RA,Olesen OF,Smith MJ,et al.Assembly of Alzheimer-like filaments from full-length tau protein[J].FEBS Lett,1994,337:135-138.
[7]李凯军,胡江平,李志强.雌激素对SH-SY5Y 细胞tau 蛋白磷酸化的影响[J].医学综述,2013,19(2):346-348.
[8]Perez M,Moran MA,Ferrer I,et al.Phosphorylated tau in neuritic plaques of APP(sw)/Tau (vlw)transgenic mice and Alzheimer disease[J].Acta Neuropathol,2008,116(4):409-418.
[9]McKee AC,Carreras I,Hossain L,et al.Ibuprofen reduces Abeta,hyperphosphorylated tau and memory deficits in Alzheimer mice[J].Brain Res,2008,1207:225-236.
[10]Li X,Liu Y,Yuan HF,et al.Effects of gensenoside Rg1 on tau protein phosphorylation induced by okadaic acid in rat brain slices[J].Zhong Xi Yi Jie He Xue Bao,2010,8:955-960.
——水芹主要害虫识别与为害症状

