日粮中添加叶黄素与角黄素对瓦氏黄颡鱼(Pelteobagrus vachelli Richardson)体色影响研究*
王 斐 彭 淇 吴 彬 谭亦珍 杨 芳 冯 健
(广西大学海洋研究中心 南宁 530004)
一些水产动物品种在野生天然水域生长过程中,由于天然饵料的影响,在特定的机体组织中沉积特定的色素,从而形成特定的体色,如野生三文鱼肌肉为橙红色,野生虾蟹类甲壳为青色,野生黄颡鱼皮肤为黄色等。色素在这些水生动物种类的特定组织中沉积对于这些水生动物种类的健康状况与品质均具有重要意义(Halveret al,2002;冷向军等,2006)。在人工养殖的条件下,由于饵料的改变,这些养殖品种难以从饵料获得足够的相关色素沉积在特定的机体组织中,其体色将与天然水域的同种野生动物品种不同,这将影响这些水产养殖动物的健康与品质;也影响了消费市场对这些人工养殖的水产动物认同,降低了其商品价值(McFarlandet al,1994;冷向军等,2006)。所以在这些水产养殖品种人工养殖时,在饲料中添加与其天然饵料中相同的色素,使这些人工养殖的水产动物达到天然野生动物相同的体色,有助于保证这些养殖品种的健康状况,提高消费市场认同与商品价值,增加养殖经济效益和养殖的可持续发展(Folkestadet al,2008)。目前对人工养殖水产动物饲料色素研究,是水产营养学一个广受关注的课题。
瓦氏黄颡鱼(Pelteobagrus vachelliRichardson)隶属于鲇形目(Siluriformes)、科(Bagridae)、黄颡鱼属(PelteobagrusBleeker)(伍献文,1963),广泛分布于我国主要水系,是近年来我国广泛养殖的一种小型本土经济鱼类。在天然水域,野生瓦氏黄颡鱼体色多呈金黄、土黄、褐黄色等不同程度黄色;但在人工养殖环境下,投喂人工饲料养殖的瓦氏黄颡鱼体色一般呈灰、黑色,严重影响其商品价值与消费市场认可(王武,2000)。目前关于在饲料中添加适宜色素改善人工养殖瓦氏黄颡鱼体色的正式报道甚少。本文研究了在实用日粮中添加天然的叶黄素类色素(叶黄素)和化学合成的叶黄素类色素(角黄素)改善人工养殖瓦氏黄颡鱼体色的效果,其目的在于了解在瓦氏黄颡鱼饲料中使用适宜的色素与添加量,对保证养殖瓦氏黄颡鱼的健康和品质、提高消费市场认同具有重要意义。
1 材料与方法
1.1 试验用鱼与分组
试验组瓦氏黄颡鱼鱼苗来自广西水产良种繁殖场,在广西大学水产养殖基地投喂人工饲料进行培育,试验用鱼共 330尾,分为 11个试验组,每组 30尾鱼平均体重为(10.0±0.3)g,体色为灰黑色至黑色。对照组鱼为在广西邕江南宁段捕获的野生瓦氏黄颡鱼,平均体重为(23.6±3.0)g,体色为褐黄、土黄色、少数为金黄色。
1.2 各试验组基础日粮组成与添加色素
基础日粮组成见表1。其中蛋白质、脂肪、糖的需要量按照作者此前的研究结果制备(黄钧等,2009),复合维生素与复合矿物质按照NRC(1993)斑点叉尾标准增加50%制备。试验1—5组日粮在基础饲料中分别添加0、0.125%、0.25%、0.5%、1%金黄素Y(广州智特奇饲料科技有限公司出产,叶黄素含量为20g/kg),折算成叶黄素添加量分别为0、25、50、100、200mg/kg日粮。6—11组日粮在基础饲料中分别添加0.125%、0.25%、0.5%金黄素Y和0.025%、0.05%加丽素红(广州智特奇饲料科技有限公司出产,角黄素含量为 10%),按 3×2因子设计,折算成日粮中叶黄素和角黄素添加量分别为(25+25)、(25+50)、(50+25)、(50+50)、(100+25)、(100+50)mg/kg。

表1 实验基础日粮组成和近似成分分析(%)1)Tab.1 Composition of the experimental base diets and main nutrients(%)
1.3 饲养管理
试验鱼以 2.5%食盐水消毒,驯化 1周以适应环境和试验日粮,暂养期间投喂1%鱼体重的基础日粮。实验期间,每组 30尾养殖于室外水泥池(180cm×150cm×120cm)中,池中设一个直径为15cm、高3cm食台,每天9:00与18:00投喂二次,每天投喂量为鱼体重的3%—2%(覃志彪等,2011)。实验期间采用循环微流水保持溶解氧充足,每天换水1/6。实验期间进行水质监测(每天测水温二次,每 10天测一次水质),水温为(26.0±3.6)°C,溶解氧为(8.13±0.63)mg/L,pH值为 8.06±0.30,氨氮为(0.99±0.10)mg/L,总硬度为(4.65±0.99)mmol/L,硝酸盐为(0.01±0.00)mg/L,亚硝酸盐为(0.49±0.62)mg/L。试养试验进行60d。每天投喂两次,投喂时间为9:00、18:00,投喂量以鱼体重的 5%—3%称料,平均分成两次投喂,每次把饲料投入网箱中食台内,观察实验鱼的进食情况,投喂后3min后若饲料台上有剩余的饲料,则结束投喂并捞出残饵,记录每次残饵数量与每天余料。每2周称重并调整投喂量。养殖实验持续 60天,光周期为自然周期。
1.4 样品的采集与检测方法
1.4.1 实验各组鱼的存活率和特定生长率、投喂量和饲料效益 实验开始与结束时,对实验各组的鱼记数、逐条称重,计算其存活率和特定生长率。计算每天的余料和残饵数量,计算其投喂量、饲料效益。相关计算公式如下(Halveret al,2002):

其中,Wi试验开始时鱼体重(g);Wf试验结束时鱼体重(g);t养殖试验天数(d);FI摄食量。
1.4.2 实验各组鱼的肝体指数与肠脂指数、基础饲料与鱼体近似成分分析 从每个试验组随机各取 12尾鱼,分别称重,解剖,剥离肝脏称重,计算肝体指数,剥离肠脂称重,计算肠脂指数。基础饲料与鱼体(每组6尾)中的近似成分分析(水分、粗蛋白、粗脂肪和粗灰分含量)按 AOAC(1990)有关标准方法测定,饲料总糖含量采用减量法(总干重减去蛋白质、脂肪和灰分含量)计算而得。肝体指数与肠脂指数相关计算公式如下(Halveret al,2002):

其中,Wt鱼体重;Wh试验结束时鱼体肝脏质量;Wis试验结束时鱼体肠系膜脂肪质量。
1.4.3 实验各组鱼体色大体观察 分别以黑、灰、灰褐、褐黄、土黄、金黄描述试验组与对照组鱼鱼体色。
1.4.4 实验各组鱼皮肤、肌肉、肠脂中的叶黄素测定实验各组各取鱼 20尾,剥取背部皮肤,分离背部肌肉与肠脂,每5尾鱼背部皮肤、肌肉与肠脂制成一个混合样本,每组4个混合样本,进行背部皮肤、肌肉与肠脂叶黄素含量测定,测定方法参考 AOAC(1990)有关标准测定。将皮肤、肌肉样品剪碎,盛于100mL容量瓶中,加入 30mL提取液(己烷︰丙酮︰无水乙醇︰甲苯 = 10︰7︰6︰7),塞上塞子旋转振摇1min,加入 2mL 40% KOH-甲醇溶液,旋转振摇 1min,于56°C水浴加热20min,冷却,于暗处置lh,加入30mL己烷,旋转振摇1min,用10%硫酸钠液定容至100mL,猛烈振摇lmin,于暗处置lh,取上清液于474nm波长下测定其吸光值,计算其叶黄素含量。
1.5 实验数据处理和分析
采用SPSS19.0数据统计软件包对实验各组间数据进行统计分析,试验结果经过一元方差分析(One-way ANOVA)后,用平均数±标准差表示。先进行方差齐性分析,方差齐性则运用 LSD法进行单因素方差多重比较,方差非齐性则采用Tamhane’s T2法进行单因素方差分析,显著水平采用0.05。然后进行Duncan’s多重比较各实验组间差异的显著性,P<0.05表示差异显著。
2 结果
2.1 实验各组鱼的存活率、饲料摄食量、生长性能和饲料效率
在整个试验期间,试验各组鱼的存活率、摄食量、特定生长率、饲料效率见表2。对照组为广西邕江南宁段捕获的野生瓦氏黄颡鱼,平均体重为(23.6±3.4)g。各试验组鱼成活率为 90%—100%。试验鱼平均初始体重为(10.0±0.3)g,实验结束时平均体重为(22.2±2.2)g,试验组 1(未添加色素)鱼的特定生长率最低,与试验 3、4、5、8—11组鱼有显著性差异(P<0.05),日粮中添加叶黄素 50mg/kg以上组鱼生长较好,试验组 1(未添加色素)鱼的饲料效率也最低,日粮中添加叶黄素50mg/kg以上组鱼较高。
2.2 实验各组鱼的肝脏指数和肠脂指数
实验各组鱼的肝体指数和肠脂指数见表3。试验组 1(未添加色素)鱼的肝体指数和肠脂指数最高,与试验3、4、5、8—11组鱼有显著性差异(P<0.05),日粮中添加叶黄素50mg/kg以上组鱼肝体指数和肠脂指数较低。表明日粮中不添加或者添加叶黄素 25mg/kg时,瓦氏黄颡鱼肝脏与肠脂中脂肪沉积较多。

表2 实验各组鱼的存活率、摄食量、特定生长率和饲料效率(n=30)Tab.2 The survival rate(SR),feed intake(FI),specific growth rate(SGR)and feed effectiveness rate(FER)in fish
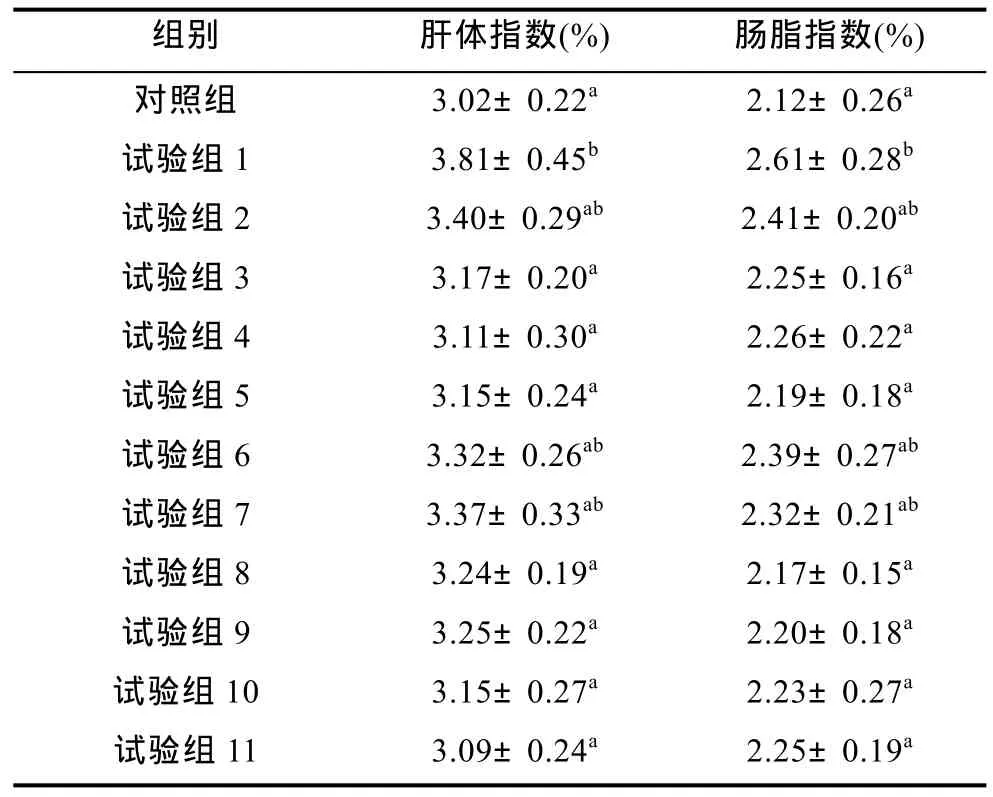
表3 试验各组鱼的肝体指数和肠脂指数Tab.3 The viscerasomatic indices(VIS)and intestinalsomatic indices(ISI)in fish
2.3 实验各组鱼的近似成分分析
实验各组鱼的全鱼鱼体水分、粗蛋白、粗脂肪和灰分含量见表4。各实验组鱼体的水分、粗蛋白、粗脂肪、灰分含量、能量与能量蛋白比组间均无显著性差异(P>0.05)。主要原因是瓦氏黄颡鱼鱼体水分与蛋白质含量较高,组间差异较小,而鱼体脂肪含量较低。
2.4 实验各组鱼体色大体观察
对照组野生瓦氏黄颡鱼体色大多为褐黄、土黄色、少数为金黄色,体内脂肪呈黄色,肌肉呈白色。实验开始时,各试验组瓦氏黄颡鱼体色均为灰黑色。经过60d养殖,试验1组(叶黄素0mg/kg)鱼体色为灰黑色,体内脂肪与肌肉为白色;试验 2组(叶黄素25mg/kg)鱼体色为灰黄色,体内脂肪与肌肉为白色;试验 6、7组(叶黄素25mg/kg、角黄素25、50mg/kg)鱼体大多为灰黄色、少数为褐黄色,体内脂肪为淡黄色,肌肉为白色;试验 3、8、9 组(叶黄素 50mg/kg、叶黄素50mg/kg和角黄素25、50mg/kg)鱼体大多为褐黄、土黄色、少数为金黄色,体内脂肪为黄色,肌肉为白色;试验 4、5、10、11组(叶黄素 100、200mg/kg、叶黄素 100mg/kg和角黄素 25、50mg/kg)鱼体大多为土黄、金黄色少数为褐黄色,体内脂肪为黄色,肌肉为白色。试验3、8、9组鱼体色与对照组鱼体色相似。

表4 实验各组鱼鱼体水分、脂肪、蛋白质与灰分含量(%)Tab.4 The contents of moisture,lipid,protein and ash in fish(%)
2.5 实验鱼皮肤、肌肉与肠脂中的叶黄素含量
实验结束时,各实验组瓦氏黄颡鱼皮肤、肌肉和肠脂组织中叶黄素平均含量见表5。日粮中的2种色素主要沉积在瓦氏黄颡鱼皮肤中。试验 1、2、6、7组(添加0、25mg/kg叶黄素、25mg/kg叶黄素和25、50mg/kg角黄素)鱼皮肤中叶黄素含量明显低于对照组(野生瓦氏黄颡鱼)鱼(P<0.05);试验 3、8、9 组(添加50mg/kg叶黄素、50mg/kg叶黄素和25、50mg/kg角黄素)鱼皮肤中叶黄素含量与对照组(野生瓦氏黄颡鱼)鱼差异不显著(P>0.05);试验 4、5、10、11 组(添加100、200mg/kg叶黄素、100mg/kg叶黄素和25、50mg/kg角黄素)鱼皮肤中叶黄素含量明显高于对照组(野生瓦氏黄颡鱼)鱼(P<0.05)。试验组鱼皮肤中的叶黄素含量主要受到日粮中叶黄素水平的影响,但当日粮中添加 100mg/kg叶黄素以上时,在瓦氏黄颡鱼皮肤、肌肉与肠脂中的沉积率明显下降;而日粮中角黄素水平对瓦氏黄颡鱼皮肤、肌肉与肠脂中叶黄素含量影响较小,表明瓦氏黄颡鱼将日粮中角黄素转化为叶黄素的能力较低,所以在日粮中添加叶黄素对瓦氏黄颡鱼的着色效果明显较角黄素好。在日粮中添加 50mg/kg叶黄素组的瓦氏黄颡鱼皮肤中叶黄素含量与野生瓦氏黄颡鱼相似。试验 4、5、10、11组鱼肌肉、肠脂中叶黄素含量虽然明显高于对照组鱼(P<0.05),但总沉积量仍较低。

表5 各实验组瓦氏黄颡鱼皮肤、肌肉组织中叶黄素含量(mg/kg)Tab.5 Contents of xanthophyll in skin and muscle of fish(mg/kg)
3 讨论
水生动物的色素主要是类胡萝卜素,类胡萝卜素为脂溶性化合物,根据其分子中是否含有氧,可分为两大类:一类为不含氧的胡萝卜素类,包括α-、β-和γ-胡萝卜素等,呈色效果较差;另一类为含氧的叶黄素类,如叶黄素、玉米黄质、黄体素、虾青素和角黄素等,是水产动物主要的呈色色素。类胡萝卜素以游离形式在中肠被吸收,在血液中以与脂蛋白结合的方式转运;肝脏是类胡萝素代谢的主要器官,以游离、酯化或者与蛋白质结合态存在鱼体内(Schiedt,1985)。所有水生动物均不具备自身合成叶黄素类色素的能力,必需从饵料中摄取。一般认为,天然水域中,藻类等水生植物中的色素经过食物链传递至水生动物,从而呈现出特有的体色;但是在人工养殖条件下,一些养殖的水生动物往往由于不能摄取足够的的色素,原有的天然体色就将消褪(Matthewset al,2006)。天然水域中,野生瓦氏黄颡鱼的饵料以水生植物和水生昆虫等为主,将天然饵料中获得的色素转化为鱼体的色素(主要为叶黄素)沉积在皮肤中表现为黄色体色。但在养殖条件下,由于人工饲料中所含有的叶黄素类色素较少,使得在人工养殖的瓦氏黄颡鱼一般体色为灰变黑。这样不但影响人工养殖瓦氏黄颡鱼的商业品质,也影响人工养殖瓦氏黄颡鱼健康状况。因为类胡萝卜素(包括β-胡萝卜素、虾青素、叶黄素和角黄素等)在水生动物体内不仅是色素,也是有效的抗氧化剂,它们与维生素E对机体起到协同抗氧化作用,对保护水生动物健康状况与商业品质具有重要作用(Simpon,1981;Bakeret al,2002;Graydonet al,2012)。本实验发现,当日粮中不添加色素时(试验组 1),瓦氏黄颡鱼的特定生长率和饲料效率均明显降低(表2),其肝脏指数和肠脂指数显著高于野生和其他添加 50mg/kg叶黄素日粮组瓦氏黄颡鱼(表3),表明养殖瓦氏黄颡鱼的饲料中缺少色素,将对瓦氏黄颡鱼的健康形成危害。另外类胡萝卜素对水生动物的繁殖影响较大,能够提高卵子的质量,阻止紫外线和其他环境中的过氧化剂的破坏效果(Johnstonet al,2006;Pratoomyotet al,2008)。大西洋鲑卵黄囊幼鱼中虾青素水平影响上浮的鱼苗与幼鱼成活率(Forsberget al,2006)。因此,在瓦氏黄颡鱼的人工饲料中添加叶黄素类色素,使其体色达到天然野生瓦氏黄颡鱼水平,对保持养殖瓦氏黄颡鱼的健康状况与提高其商业品质均十分必要。
含氧的叶黄素类中的叶黄素、玉米黄质、黄体素、虾青素和角黄素是水产动物目前主要的呈色色素。其中饲料中添加虾青素主要使养殖的水生动物皮肤呈青色或肌肉呈红色,玉米黄质主要使肌肉呈色,叶黄素与角黄素主要使皮肤呈黄色。要使养殖水生动物达到理想的着色,必需根据其野生个体的色素组成和对色素的代谢能力选用适宜色素种类(Katayma,1978)。在天然水域中的野生瓦氏黄颡鱼肌肉与肠脂为白色,皮肤呈不同程度黄色,所以养殖瓦氏黄颡鱼饲料中可以添加叶黄素与角黄素。研究表明天然色素在动物体内的沉积率比人工合成的色素要高(Quackenbushet al,1972;Chaumontet al,1995)。本试验所用叶黄素是从万寿菊中提取的天然色素,而角黄素是采用化学合成法制成(梁明振等,2002)。本实验结果表明,日粮中的叶黄素在瓦氏黄颡鱼皮肤中的沉积率明显高于角黄素,所以在养殖瓦氏黄颡鱼饲料中添加叶黄素是适宜的色素。当日粮中添加100mg/kg叶黄素以上时,瓦氏黄颡鱼皮肤中沉积率明显下降,这可能是因为瓦氏黄颡鱼鱼体存在对日粮叶黄素最大沉积量的限制。由于日粮中添加50mg/kg叶黄素时,养殖的瓦氏黄颡鱼皮肤中叶黄素含量达到野生瓦氏黄颡鱼水平,体色也与野生瓦氏黄颡鱼基本一致,所以养殖瓦氏黄颡鱼饲料中叶黄素的建议添加量为50mg/kg。
王 武,2000.鱼类增养殖学.北京:中国农业出版社,52
伍献文,1963.中国经济鱼类志.北京:科学出版社,51—53
冷向军,李小勤,2006.水产动物着色的研究进展.水产学报,30(1):138—142
黄 钧,冯 健,孙 挺等,2009.瓦氏黄颡鱼(Pelteobagrus fulvidracoRichardson)幼鱼日粮中主要营养素需要量研究.海洋与湖沼,40(4):437— 445
梁明振,梁贤威,2002.着色剂问题探讨.粮食与饲料工业,31(6):26—27
覃志彪,赵海祥,赵华林等,2011.投饲频率对瓦氏黄颡鱼(Pelteobagrus fulvidracoRichardson)幼鱼胃排空、生长效益及体组成影响.海洋与湖沼,42(4):506—511
AOAC(Association of Official Analytical Chemists),1990.Official Methods of Analysis(15thedn.).Arlington,VA,USA:65—72,115
Baker R T,PfeifferA M,Schöner Fet al,2002.Pigmenting efficacy of astaxanthin and canthaxanthin in fresh-water reared Atlantic salmon,Salmo salar.Animal Feed Science and Technology,99(1—4):97—106
Chaumont D,Thepener C,1995.Carotenoid content in growing cells ofHaematococcus pluoialisduring a sunlight cycle.J Appl Phycol,45(7):529—537
Folkestad A,Wold J P,Rørvik Jet al,2008.Rapid and non-invasive measurements of fat and pigment concentrations in live and slaughtered Atlantic salmon(Salmo salarL.).Aquaculture,280(1—4):129—135
Forsberg O I,Guttormsen A G,2006.A pigmentation model for farmed Atlantic salmon:Nonlinear regression analysis of published experimental data.Aquaculture,253(1—4):415—421
Graydon C M,Robert S M,Scheibling Eet al,2012.Canthaxanthin as a potential tracer of salmon feed in mussels(Mytilusspp.)and sea urchins(Strongylocentrotus droebachiensis).Aquaculture,366—367(5):90—97
Halver J E,Hardy R W,2002.Fish Nutrition.third edition.Academic Press,London:35,47,238
Johnston I A,Li X,Vieira Vet al,2006.Alistair muscle and flesh quality traits in wild and farmed Atlantic salmon.Aquaculture,256(1—4):323—336
Katayma T,1978.Carotenoids metabolism in aquatic animals.Kosiesha Kosiekaku,Tokyo:41—59
Matthews S,Ross N W,Lall S Pet al,2006.Astaxanthin binding protein in Atlantic salmon.Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,144(2):206—214
McFarland W,Loew R E,1994.Ultraviolet visual pigments in marine fishes of the family pomacentridae.Vision Research,34(11):1393—1396
NRC(National Research Council),1993.Nutrient Requirements of Fish.National Academy Press,Washington,DC,USA,114
Pratoomyot J,Bendiksen E,Bell J Get al,2008.Comparison of effects of vegetable oils blended with southern hemisphere fish oil and decontaminated northern hemisphere fish oil on growth performance,composition and gene expression in Atlantic salmon(Salmo salarL.).Aquaculture,280(1—4):170—178
Quackenbush F W,Miller S L,1972.Composition and analysis of the carotenoids in marigold petals.J AOAC,55(3):75—81
Schiedt K,1985.Absorption,retention and metabolic transformation of carotenoidsin rainbow trout,salmon and chick.Pure Appl Chem,57(6):685—692
Simpon K L,1981.Carotenoids as colorants and vitamin A precursors.Academic Press,New York,463—537

