牙鲆多聚免疫球蛋白受体基因的克隆、表达及鉴定*
许国晶 绳秀珍 战文斌
(中国海洋大学教育部海水养殖重点实验室 青岛 266003)
多聚免疫球蛋白受体(polymeric immunoglobulin receptor,pIgR)是主要组织相容性复合物(MHC)家族中的重要成员,是由黏膜上皮细胞合成的一种多肽,通常与分泌型多聚免疫球蛋白(IgA或 IgM)形成复合物,有时也以游离型存在(张春刚等,2008)。哺乳动物中,在黏膜局部占主导作用的免疫球蛋白是 IgA,pIgR可以与多聚IgA或IgM结合,介导多聚免疫球蛋白尤其是多聚IgA的跨上皮细胞转运和分泌,发挥IgA 在黏膜屏障中局部清除病原体和毒素的作用。硬骨鱼的皮肤及肠道和哺乳动物的肠道一样,通过pIgR转运IgM或IgT进入黏膜中,这为鱼类粘膜免疫系统的特异性免疫提供了有力证据(Hamuroet al,2007;Zhanget al,2010)。
在硬骨鱼中,有关河豚(Takifugu rubripes)、鲤鱼(Cyprinus carpio)、斜带石斑鱼(Epinephelus coioides)、虹鳟(Oncorhynchus mykiss)、大西洋鲑鱼(Salmo salar)pIgR的研究已有报道(Hamuroet al,2007;Romboutet al,2008;Fenget al,2009;Zhanget al,2010;Tadisoet al,2011);GenBank中可查到斑马鱼(Danio rerio)和牙鲆(Paralichthys olivaceus)pIgR氨基酸序列。哺乳动物的pIgR包含5个免疫球蛋白样功能域(Ig-like domain,D1—D5),鸟类和两栖类pIgR含有4个免疫球蛋白样功能域(Wielandet al,2004;Braathenet al,2007),而硬骨鱼类pIgR仅包含2个对应于哺乳动物D1和D5的免疫球蛋白样功能域(Hamuroet al,2007;Romboutet al,2008)。但是,这种小分子量pIgR可以结合硬骨鱼类 IgM,并且 pIgR基因在鱼皮肤上皮细胞、肠和肝细胞等有较高的表达水平(Hamuroet al,2007)。
pIgR作为重要的黏膜免疫系统的受体分子,由其介导的分泌型抗体的转运过程在生物体抵御病原体的粘附、入侵过程中起着相当重要的作用,是多聚免疫球蛋白发挥黏膜防御功能的必要条件。鱼类pIgR的研究不仅为鱼类 Ig的转运提供直接证据,而且在鱼类养殖中具有一定的应用潜力(Hamuroet al,2007)。牙鲆(Paralichthys olivaceus)作为我国传统的名贵商品鱼和出口创汇重要养殖品种之一,到目前为止尚未见关于其 pIgR的研究报道。本文拟通过PCR技术扩增获得牙鲆 pIgR基因全长开放阅读框(ORF),研究 pIgR基因在大肠杆菌中的表达,通过SDS-PAGE、western-blot及ELISA对pIgR基因表达产物进行验证,为进一步研究pIgR的转运机制及深入了解其在粘膜免疫防御中的作用机理提供分子基础。
1 材料与方法
1.1 实验材料及试剂
健康牙鲆购自山东胶南牙鲆鱼养殖场,平均体长20cm,平均体重30g。于实验室内80cm×50cm×40cm的玻璃钢水槽中暂养,水温(20 ± 0.5)°C,连续充气,每日换水一次,换水量1/3—1/2,暂养7 d后用于实验。
感受态细胞DH5α购自Transgen公司;pET-32(a)表达载体及表达菌株Escherichia coli(E.coli)BL21(DE3)购自Novagen公司;PMD18-T载体、DNA聚合酶、限制酶EcoRI和NotI、T4DNA连接酶、DNA凝胶纯化试剂盒购自TaKaRa公司;IPTG购自INALCO公司;质粒抽提试剂盒和凝胶回收试剂盒购自宝生物;AP标记羊抗小鼠抗体购于SIGMA公司;鼠抗His-tag单克隆抗体购自北京华大蛋白公司。
鼠抗牙鲆血清免疫球蛋白的单克隆抗体由本实验室制备(Liet al,2007),牙鲆IgM参照Liet al(2007)的硫酸铵盐析和离子交换柱层析法进行纯化。
1.2 牙鲆pIgR开放阅读框cDNA的克隆
根据牙鲆pIgR(GenBank:HM536144)开放阅读框cDNA序列和表达载体pET-32(a)的多克隆位点序列,设计了一对特异引物,由上海生物工程技术有限公司合成。为便于基因的克隆及构建表达载体等后续工作,在引物中引入了EcoRI和NotI 的酶切位点(划线表示)。pIgR-1:5′-CCGGAATTC ATGGCGCAACTCT TCACACTC-3′;pIgR-2:5′-TTTTCCTTTTGCGGCCG CTCAGTGCATAAAAACATCCTG-3′。从牙鲆肝脏中提取总RNA,通过RT-PCR合成第一链和进行PCR扩增,PCR程序为94°C预变性5min,30个循环扩增(94°C,50s;58°C,50s;72°C,90s),72°C延长10min。扩增产物纯化后连到pMD18-T载体上,转化感受态DH5α,抗生素和菌落PCR筛选重组子,测序。
1.3 原核表达质粒的构建及鉴定
以EcoRI和NotI分别双酶切pET-32(a)和序列正确的pMD18-T-pIgR质粒DNA,切胶回收纯化后,以T4DNA Ligase连接片段,构建成重组表达质粒pET-32(a)-pIgR,转化感受态表达菌株E.coliBL21(DE3),菌落PCR筛选重组子,并小量制备质粒DNA,以EcoRI和NotI对产物双酶切筛选和鉴定阳性重组质粒。
1.4 pIgR重组蛋白的诱导表达
挑取阳性重组菌BL21的单菌落接种至4mL LB液体培养基中(含100μg/mL AMP),37°C振荡培养过夜,次日以10%的接种量转入5mL 的LB培养基中(含100μg/mL AMP),培养至A600约0.6时,加入IPTG(终浓度为1mg/mL)进行诱导,继续培养10 h,每隔2 h取1mL菌液作为检测样品,利用SDS-PAGE确定最佳诱导时间。大量诱导菌液100mL,6000g离心10min收集菌体,用PBS重悬后超声破碎4min(Sonics &Materials;振幅39%;pulse on,3s;pulse off,3s),6000g离心收集沉淀,以SDS-PAGE鉴定表达结果。
1.5 表达产物的纯化
收集经 IPTG诱导的细菌培养物,6000g离心10min;用缓冲液 A(50mmol/L;Tris-HCl,2mmol/L EDTA,100mmol/L NaCl,pH 8.0)6000g离心洗涤2次,每次 10min;将菌体细胞用缓冲液 B(50mmol/L Tris-HCl,1mmol/L EDTA,100mmol/L NaCl,1%NP-40,pH 8.0)重悬,反复冻融 5次后将菌液分装于10mL离心管,每管 6mL,然后于冰浴条件下进行超声破碎8min(Sonics &Materials;振幅39%;pulse on,4s;pulse off,1s),1500g离心30min收集包涵体沉淀;亲和层析进一步纯化重组蛋白:以 Ni离子螯合的亲和层析柱(HisTrap HP 1mL,GE)对重组蛋白进行纯化,以binding buffer(20mmol/L Na3PO4,0.5mol/L NaCl,30mmol/L咪唑,8mol/L尿素,pH 7.4)溶解收集的包涵体,经0.45 µm的滤膜过滤后向亲和层析柱中加入样品,经 binding buffer平衡后,以 elution buffer(20mmol/L Na3PO4,0.5mol/L NaCl,500mmol/L咪唑,8mol/L尿素,pH 7.4)洗脱目的蛋白,洗脱产物经尿素浓度梯度透析后,最后以PBS进行透析品;透析完成后对样品进行冷冻干燥以浓缩样品,一部分通过SDS-PAGE检测纯化情况,其它用PBS重悬–80°C保存备用。
1.6 重组蛋白的western-blot分析
取诱导后的菌体进行SDS-PAGE,以未经诱导的菌体为对照,纯化后的重组蛋白pIgR为阳性对照。Mini Trans-Blot Transfer Cell(Bio-Rad)转移至PVDF膜上(恒压30 V转移2 h),以封闭液(0.01mol/L pH 7.4的PBS,含5%脱脂奶粉)封闭过夜,加鼠抗His-tag单克隆抗体,37°C反应1 h,PBST洗3次;再加AP标记的羊抗鼠IgG,1︰5000稀释,37°C反应1 h,PBST洗3次后,放入新鲜配制的NBT/BCIP发色液中,室温显色30min后水洗终止反应。
1.7 ELISA检测重组蛋白与IgM的结合
以纯化的牙鲆 pIgR重组表达蛋白包被酶标板,每孔 100μL,包被过夜;然后每孔加入 200μL 含4%BSA的PBS,37°C封闭1h,PBST洗涤3次后,加入纯化的牙鲆IgM孵育4h;同上洗涤3次后,加入鼠抗牙鲆血清Ig单克隆抗体,37°C孵育1h;再加AP标记的羊抗鼠IgG,1︰5000稀释,37°C反应1h,PBST洗3次后,加入PNPP显色液100μL,暗处反应15min,以2mol/L H2SO4终止显色,用酶标仪检测各孔405nm波长处的OD值,检测孔与阴性对照的OD值比值大于2为阳性。以包被His标签蛋白代替牙鲆pIgR重组表达蛋白作为阴性对照;另外,以PBS代替纯化的牙鲆IgM作为阴性对照。
2 结果
2.1 牙鲆pIgR基因开放阅读框的克隆
以牙鲆肝脏的总 RNA作模板,RT-PCR结果显示,在1005bp处扩增出特异性条带(图1)。测序结果表明,pIgR开放阅读框cDNA与报道的牙鲆pIgR开放阅读框 cDNA序列(GenBank:HM536144)有两个碱基差异,但推断的氨基酸序列完全一致,所以可以用于表达。

图1 牙鲆pIgR开放阅读框PCR扩增产物Fig.1 PCR product of pIgR ORF gene
2.2 表达载体的构建及筛选
以EcoRI和NotI双酶切含有 pIgR基因的pMD18-T,回收目的基因片段,插入 pET-32(a)载体的相同酶切位点得到重组表达质粒 pET-32(a)-pIgR,转化大肠杆菌 BL21(DE3)感受态细胞,得到重组菌BL21(DE3)/pET-32(a)-pIgR。在转化平板上随机挑取10个菌落进行菌落 PCR检测,结果均为阳性,选取其中1个进行扩大培养,收集培养菌后利用质粒提取试剂盒提取质粒,利用EcoRI和NotI进行酶切,将酶切产物和酶切前的质粒进行琼脂糖凝胶电泳,结果表明质粒经过酶切后,得到一条分子量在 1005bp左右的基因条带,与表达的目的基因相符(图2)。

图2 表达载体pET32a-pIgR的双酶切检测Fig.2 Double-enzyme digestion of recombitant pET32a-pIgR
2.3 重组牙鲆pIgR的诱导表达、纯化及SDS-PAGE分析
分别取IPTG诱导0h,2h,4h,6h,8h及10h后的表达产物经 SDS-PAGE,结果显示,与未经诱导表达的大肠杆菌相比,诱导后的重组质粒pET-32(a)- pIgR的细胞裂解液在58kDa处有一条特异性蛋白条带,目的基因编码335个氨基酸,表达的蛋白片段理论分子量为 37kDa,质粒 pET-32(a)的标签蛋白大小则约为21kDa左右,结果与理论大小相符,并且 IPTG诱导6h后蛋白表达量趋于稳定(图3)。在优化表达条件后,将经 IPTG诱导表达 6h的细菌裂解液及表达产物经亲和层析纯化后的最终产物进行SDS-PAGE,电泳结果显示获得了纯度很高的目的表达蛋白,无其它明显杂带存在(图4)。
2.4 重组蛋白pIgR的western-blot分析
Western-blot结果显示阳性对照及重组菌株在58kDa处均有一条明显的特异条带(图5),而阴性对照即未经诱导的菌株没有出现相应的条带(图5),表明重组蛋白可与鼠抗His-tag单克隆抗体发生特异性反应,与预期结果一致。
2.5 ELISA检测重组pIgR与IgM的结合
应用抗血清Ig抗体,通过ELISA检测牙鲆pIgR重组表达蛋白与 IgM 的结合活性,结果在检测孔405nm处的OD值达0.5790,与阴性对照孔的OD值(His标签蛋白:O.D.=0.0911;PBS:O.D.=0.0787)比值明显大于2,说明重组pIgR与IgM发生了特异性结合(图6)。

图3 重组蛋白pIgR的诱导时间分析Fig.3 Effect of induction time on the expression of recombinant pIgR

图4 重组蛋白pIgR的纯化Fig.4 The purification of the recombinant pIgR
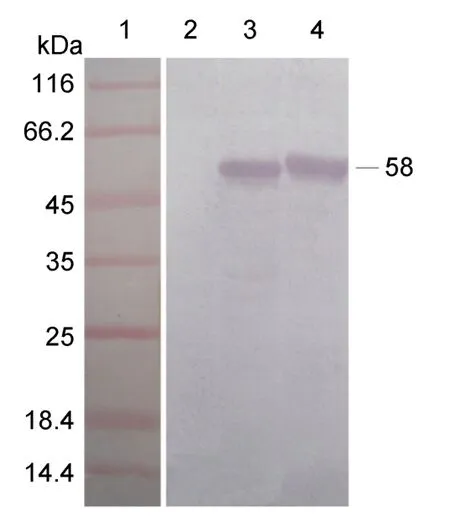
图5 重组蛋白pIgR的 western blot 分析Fig.5 Western blot of the recombinant pIgR

图6 ELISA检测pIgR与IgM的结合Fig.6 Detection of the binding of pIgR to IgM in vitro by ELISA
3 讨论
全基因组序列分析显示,牙鲆pIgR ORF基因片段全长1005bp,编码335个氨基酸残基(GenBank:HM536144)。本文通过PCR技术,扩增pIgR ORF基因片段为1005bp,有两个碱基差异,但推断的氨基酸序列完全一致,可以用于表达。大肠杆菌表达重组蛋白时常常形成包涵体,而对包涵体的变性、复性等操作会影响重组蛋白生物活性。因此,在构建表达载体时,将pIgR基因与表达载体pET-32(a)中N端的6×His-tag进行融合表达,便于后续对重组蛋白进行表达分析和分离纯化等。重组质粒进行诱导表达时,6×His-tag与外源插入片段共同表达,因而融合蛋白带有6×His-tag。在大多数情况下,6×His-tag不影响重组蛋白的结构和功能,可以利用该蛋白标签通过Ni-NTA柱纯化便于融合蛋白的纯化(刘臻等,2010)。本文构建的牙鲆pIgR ORF表达载体pET-32(a)-pIgR转化表达受体菌后,经IPTG 37°C诱导6h 实现了高效表达,获得分子量大小为58 kDa的融合蛋白,与推测的理论产物大小一致,说明牙鲆pIgR ORF能够在BL21(DE3)大肠杆菌中成功表达。6×His-tag标签序列蛋白大小为21kDa,因此得出目的蛋白大小为37kDa,分子量与虹鳟pIgR表达蛋白38 kDa接近(Zhanget al,2010),大于斑马鱼pIgR原核表达蛋白30.75 kDa(王辉,2007)、鲤鱼pIgR原核表达蛋白29kDa(王磊,2009),及斜带石斑鱼pIgR原核表达蛋白28kDa(冯丽娜,2009),但整体相差不大。经过蛋白分析发现,牙鲆pIgR具有与斑马鱼、鲤鱼、虹鳟、河豚及斜带石斑鱼相同的结构,都具有信号肽,2个免疫球蛋白功能域,一段跨膜区以及胞内区(pIgR基因序列及结构特征数据另文发表)。为进一步鉴定该表达系是否能正确表达目的蛋白,本文以未转染pET-32(a)-pIgR的E.coliBL21(DE3)作为对照,应用Western-blot验证重组蛋白可与鼠抗His-tag单克隆抗体发生特异性反应,证明了重组蛋白表达的正确性。
哺乳动物黏膜表面的pIgR在体液免疫中发挥重要作用,位于黏膜下的IgA与穿过表皮屏障的抗原结合,通过pIgR介导的运送机制,将抗原排出体外,或通过类似方式,阻断细胞内病毒的合成和组装(张春刚等,2008)。本研究构建的牙鲆pIgR ORF片段包括胞外区2个免疫球蛋白功能域,即配体结合区,具有结合Ig功能(Hamuroet al,2007)。为了进一步验证重组牙鲆pIgR具有结合Ig的活性,本文在纯化pIgR表达蛋白的过程中,首先将变性条件下的蛋白进行了透析,梯度降低了尿素的浓度,从而使变性的蛋白能够缓慢复性,甚至会恢复到天然构象,从而更好的模拟天然状态的pIgR。本研究通过ELISA方法应用抗血清Ig单克隆抗体研究纯化的重组pIgR与IgM的结合关系,发现牙鲆pIgR重组表达蛋白具有IgM结合活性。这与Hamuro等(2007)、Feng等(2009)及Zhang等(2010)的研究结果一致。在河豚中,Hamuro等(2007)通过非变性电泳发现IgM与pIgR复合物;Feng等(2009)通过流式细胞术检测发现斜带石斑鱼重组pIgR具有结合Ig的能力;Zhang等(2010)也在虹鳟肠黏液中发现了IgT与pIgR复合物,说明pIgR与Ig的转运存在密切联系。
本文通过PCR技术克隆了牙鲆pIgR基因,进行原核表达,并通过western-blot和 ELISA方法,初步验证了pIgR基因的功能。作者后续将应用纯化的重组pIgR,制备抗血清及单克隆抗体,通过免疫荧光及免疫组化等技术分析牙鲆pIgR在黏膜免疫系统中的分布,通过免疫印迹技术等分析pIgR与Ig的结合位点,为深入研究pIgR的转运机制及了解pIgR在黏膜免疫防御中的作用机理奠定基础。
王 辉,2007.斑马鱼多聚免疫球蛋白受体(zpIgR)基因的克隆.济南:山东师范大学硕士学位论文,46—49
王 磊,2009.鲤鱼多聚免疫球蛋白受体(cpIgR)功能的研究.济南:山东师范大学硕士学位论文,27—29
冯丽娜,2009.斜带石斑鱼多聚免疫球蛋白受体基因的克隆和功能分析.广州:中山大学博士学位论文,93—97
刘 臻,罗小华,鲁双庆等,2010.鳜(Sinipercachuatsi)生长激素基因克隆和原核表达.海洋与湖沼,41(3):365—370
张春刚,王加启,刘光磊等,2008.动物多聚免疫球蛋白受体研究概况.中国畜牧兽医,35(7):49—51
Braathen R,Hohman V S,Brandzaeg Pet al,2007.Secretory antibody formation:conserved binding interactions between J chain and polymeric Ig receptor from humans and amphibians.J Immunol,178:5682—5686
Brandtzaeg P,2003.Role of secretory antibodies in the defence against infections.Int J Med Microbiol,293:3—15
Feng L N,Lu D Q,Bei J Xet al,2009.molecular cloning and functional analysis of polymeric immunoglobulin receptor gene in orange-spotted grouper(Epinephelus coioides).Comp Biochem Physiol B,154:282—289
Hamuro K,Suetake H,Saha N Ret al,2007.A teleost polymeric Ig receptor exhibiting two Ig—like domains transports tetrameric IgM into the skin.J Immunol,178:5682—5689
Li Q,Zhan W B,Xing Jet al,2007.Production,characterisation and applicability of monoclonal antibodies to immunoglobulin of Japanese flounder(Paralichthys olivaceus),Fish Shellfish Immunol,23:982—990
Rombout J H W M,van der Tuin S J L,Yang Get al,2008.Expression of the polymeric Immunoglobulin Receptor(pIgR)in mucosal tissues of commlon carp(Cyprinu scarpioL.).Fish Shellfish Immunol,24:620—628
Tadiso T M,Sharma A,Hordvik I,2011.Analysis of polymeric immunoglobulin receptor- and CD300-like molecules from Atlantic salmon.Mol Immunol,49(3):462—473
Wieland W H,Orzaez D,Lammers Aet al,2004.A functional polymeric immunoglobulin receptor in chicken(Gallus gallus)indicates ancient role of secretory IgA in mucosal immunity.Biochem J,380:669—676
Zhang Y A,Salinas I,Li Jet al,2010.IgT,a primitive immunoglobulin class specialized in mucosal immunity.Nat Immunol,11:827—835

