老爷海潟湖内底层缺氧规模对南海季风气候节律的响应*
李 英 张 经 邓 鸿 王道儒 朱卓毅
(1.华东师范大学河口海岸国家重点实验室 上海 200062;2.海南省海洋开发规划设计研究院 海口 570125)
近几十年,底层缺氧(DO<2mg/L或者<30%)已经成为威胁水生态系统(尤其是人工养殖区)的重要环境问题(Zhanget al,2010)。水柱层化和有机质垂向供应是底层缺氧现象得以形成和发展的两个重要条件(Diaz,2001)。浮游植物生产是水生态系统中有机质的重要来源(Duursmaet al,1981),硅藻明显比其它微微型(<2μm)和微型(2—20μm)浮游植物细胞具有更快的垂直沉降速率(Michaelset al,1988),从而硅藻水华常常会伴随有大面积的底层缺氧现象(Rabalaiset al,2007;Lashawayet al,2010)。气象条件常对沿岸潟湖系统中的底层缺氧规模产生重要影响,沿岸潟湖系统所具有的狭窄潮汐通道可以高效地阻挡和过滤海洋潮汐能量(Parker,1991),从而潟湖系统内的物理-化学-生物特征及其一些环境问题(例如缺氧、水华等等)更容易受到上界面气象条件的干扰和控制(Gonencet al,2004;Lloretet al,2008;Kennishet al,2010)。
老爷海位于海南岛东岸(图1a),以龙堡桥为界,可将潟湖划分为外湾和内湾;其中,外湾普遍浅于2m,而内湾中则存在一个面积约0.2km2、深约6m的深坑(图1b)。老爷海是一个典型的沿岸潟湖系统,通过一个宽约 70m的狭窄潮汐通道与南海相连,潟湖内的潮汐振幅(仅约 50cm)远低于潟湖外海域(约130cm)(中国科学院南海海洋研究所,2006)。老爷海所在的海南岛处于南海季风系统控制下:西南季风盛行期(5—10月)气温高、风速低、降雨量大,而在东北季风盛行期(11—2月)则相反地具有气温低、风速高、降雨甚少的特点(Qianet al,2002);春季季风转换期(3—4月)的气象状况年际变动很大,可以显著形成降水充沛的春雨年度和降水稀少的春旱年度之分(俞胜宾等,2006;张黎明等,2006)。
20世纪80年代以来,老爷海潟湖内开始大规模发展水产养殖业,内湾主要开展岸滩养虾,外湾则主要进行网箱养鱼(图1c)。进入90年代后,潟湖水体在养殖活动的持续冲击下已经达到了富营养化状态(李瑞环,2010;Jiet al,2013),网箱养鱼因缺氧而迅速(在短短1—2天内)大面积死亡的事件频繁发生。从新闻报道途径获取的信息来看,老爷海潟湖内的大规模死鱼事件几乎都集中在春季季风转换期,而且通常都出现在形成春旱的年度(翁朝健,2008)(表1)。这暗示着南海季风气候节律可能对老爷海潟湖内的缺氧规模有着重要控制作用。本文就是在不同季风阶段对老爷海潟湖开展生物地球化学调查,通过分析不同季风阶段的气象条件、缺氧规模、水柱结构、全粒径的浮游植物群落、细菌和病毒等参数之间的关系,来剖析老爷海潟湖内底层缺氧规模与南海季风气候节律之间的关系。

图1 研究区域和采样站位Fig.1 Study area and sampling site

表1 老爷海潟湖内大规模死鱼事件的统计及其相对应的气象情况Tab.1 Statisticson the incidence of mass fish mortality occurring at Laoyehai Lagoon,as well as the climate conditions at that time
1 材料与方法
1.1 站位与航次
沿着老爷海潟湖的狭长地貌,从口门到内湾设置7个固定站位(图1c),并在2008—2011年间共执行7个航次调查(表2)。2009年海南岛形成了充沛的春季降水(水利部水文局,2009),本文于4月份执行了2个航次(记为CY2009-1和CY2009-2航次),航次期间的月累积降水量比40年平均的同期水平偏多约6倍,CY2009-1航次期间的日平均风速(3.2m/s)比 40年平均的同期水平(约 2.9m/s)偏高,而 12天之后的CY2009-2航次日平均风速降到0.8m/s。2010年海南岛形成了显著春旱(水利部水文局,2010),本文于 4月份执行了2个航次(记为CH2010-1和CH2010-2航次),航次期间的月累积降水量比40年平均的同期水平偏少约1/2,风速明显偏低约2/3。在2008年、2009年和2011年8月份西南季风盛行期分别执行1个航次(记为XN2008、XN2009和XN2011航次),这3个航次期间的气象条件都与40年同期平均水平相一致,表现为高温、多雨和低风速。此外,所有7个航次都进行了溶解氧和水文调查,而生物(浮游植物、异养细菌和病毒)调查仅在CY2009-1、CY2009-2、CH2010-1和XN2009这4个航次中进行。
1.2 溶解氧、水柱稳定度和水下光照特征的现场测定


表2 航次执行期间的季风特征和气象状况Tab.2 Monsoon and climate conditions during cruises
1.3 浮游植物(<10μm组分)、异养细菌和病毒样品的采集及其流式细胞仪测定
将水样用20μm筛绢滤去大颗粒后分装到3个冷冻管(3mL)中,加入多聚甲醛(1%终浓度)后在室温下暗处固定 15min,放入液氮冷冻保存。在室内,将液氮冷冻水样取出并解冻后,添加球体直径分别为1.002、2.139和9.816μm的荧光微球(美国Polysciences公司)作为内标,在流式细胞仪(FACScan,美国Becton Dickinson 公司)的高速(61.0µL/min)进样档位下运行并收集光学信号(Panet al,2005;Reulet al,2006)。为测定异养细菌丰度,向解冻水样中加入荧光染料 SYBR-Ⅰ(美国 Molecular Probes公司)(商品母液、水样比为1︰10000),并在暗处染色15min后,在流式细胞仪的低速(15.4µL/min)进样档位下运行并收集光学信号(Panet al,2005)。为测定病毒丰度,先用TE缓冲液(10mmol/L Tris,1mmol/L EDTA,pH=8)将解冻水样稀释400—1000倍;加入荧光染料SYBR-Ⅰ并在暗处 80°C水浴中染色10min后,在流式细胞仪的低速进样档位下运行并收集光学信号(Panet al,2005)。使用FCS Express软件对收集到的前项散射光(FSC)、侧向散射光(SSC)、绿色荧光(FL1)、橙色荧光(FL2)和红色荧光(FL3)等光学信号进行组合分析,判别浮游植物(<10μm)、异养细菌和病毒类群,并进行丰度计数。
1.4 浮游植物(>10μm 组分)的样品采集及其显微镜测定
在采样现场,将 1L水样用甲醛(4%终浓度)固定后,暗处保存。回到室内,将甲醛固定水样静置 48h,缓慢虹吸后获得 30—50mL浓缩藻液。用 1mL计数框在倒置显微镜(Leica DMIRB,德国 Leica公司)200×和400×视野下检测浓缩藻液。每个样品计数>400个细胞,计数误差<10%(Liet al,2013)。物种鉴定尽可能达到种的水平;对于不能到种水平的种类,则确定到属水平。淡水藻类鉴定参考胡鸿钧等(1980),海水藻类鉴定参考金德祥等(1965,1982,1992)和Tomas(1997)。用显微镜内置标尺对每种浮游植物细胞的线性维度进行测量,并结合细胞的几何形状求出等效球径(equivalent spherical diameter,ESD)(Hillebrandet al,1999)。
1.5 浮游植物细胞丰度的碳生物量转换
微微型浮游植物细胞直接使用细胞碳含量作为碳转换系数:原绿球藻(Prochlorococcus)、聚球藻(Synechococcus)和微微真核(picoeucaryotes)的细胞碳含量分别使用53fgC/cell(Campbellet al,1994)、175fg C/cell(Veldhuiset al,1997)和975fg C/cell(Reckermannet al,1997)。微型和小型浮游植物细胞使用单位体积碳含量作为碳转换系数:硅藻和甲藻分别使用288×V0.811fg C/cell和216×V0.99fg C/cell(Menden-Deueret al,2000),隐藻、绿藻、裸藻和蓝藻都使用183×Vfg C/cell(Caronet al,1995),式中,V代表细胞体积。
2 结果
2.1 底层缺氧
在所有7个航次调查中,潟湖水体的溶解氧含量都从表层向底层降低,并在内湾的深坑底层降到最低值(图2)。底层缺氧(DO<30%)规模随季风阶段的不同而差异显著。具体而言,在CY2009-1和CY2009-2航次中,底层缺氧规模都极小,甚至观察不到;在 CH2010-1和CH2010-2航次中都形成了大规模缺氧,缺氧水团在深坑水柱中直达表层,并向外湾网箱养殖区蔓延;在XN2008、XN2009和XN2011航次中都形成了小规模缺氧,缺氧水团被囚禁在深坑底层内约2m以深。
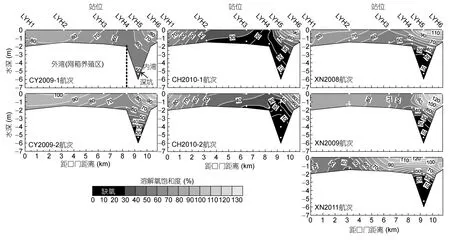
图2 航次期间老爷海潟湖内溶解氧饱和度(%)的空间分布Fig.2 Space distribution of dissolved oxygen level(%)in Laoyehai Lagoon during cruises
2.2 盐度、温度和水体稳定度
盐度在所有 7个航次中都从口门向内湾逐步降低,而内湾水体的盐度则随季风阶段的不同而有所差异(图3)。在CH2010-1和CH2010-2航次中,内湾水体都呈现为高盐度格局,最低盐度达到 21;相比较而言,在其余 5个航次 CY2009-1、CY2009-2、XN2008、XN2009和XN2011中,内湾水体都表现为低盐度格局,最低盐度值在 11—15之间变化。潟湖水温在所有 7个航次中都表现为高温(图3)。在XN2008、XN2009和 XN2011航次中,水温在 28—33°C 之间变化;在 CY2009-1、CY2009-2、CH2010-1和CH2010-2航次中,水温在25—29°C之间变化。

图3 航次期间老爷海潟湖内盐度和温度(°C)的空间分布Fig.3 Space distribution of salinity and temperature(°C)in Laoyehai Lagoon during cruises黑色等值线为盐度,白色等值线为温度


表3 调查期间潟湖内湾深坑水柱的垂直稳定度Tab.3 Vertical stability of water column in the deep hole of inner bay
2.3 浮游植物、异养细菌和病毒类群的种类组成
用流式细胞计检测等效球径(ESD)<10μm的浮游植物类群,除了可检出海洋调查中经常观察到的原绿球藻、聚球藻和微微型真核(图4a1—a3)以外,还可检出另外 4个独特的浮游植物类群,分别标记为Pico-1、Nano-1、Nano-2 和 Nano-3(图4b1—b4)。从前项散射光(与尺寸相关)和内标(2.0μm 和 10.0μm 的荧光微球)来判断,Pico-1、Nano-1、Nano-2和Nano-3的 ESD分别约为 2.0、5.0、8.0和5.0μm;从而,Pico-1可归为微微型浮游植物,而Nano-1、Nano-2和Nano-3则归为微型浮游植物。Pico-1、Nano-1、Nano-2和Nano-3的叶绿素红色荧光强度依次增强,其中,Pico-1和Nano-1的红色荧光分别与原绿球藻和聚球藻相接近。Pico-1缺乏橙色荧光,而Nano-1、Nano-2和Nano-3都具有橙色荧光;其中,Nano-2和Nano-3的橙色荧光强度彼此接近,且明显强于Nano-1。就侧向散射光强度而言,Pico-1最弱,Nano-2最强,Nano-1和Nano-3的侧向散射光比较接近。

图4 使用流式细胞仪和倒置显微镜在老爷海潟湖水样中检出的主要浮游植物类群、异养细菌和病毒粒子Fig.4 Main phytoplankton species,heterotrophic bacteria and virus detected by flow cytometry and inverted microscope in water samples of Laoyehai Lagoon
用倒置显微镜检出的ESD属于10—20μm范围的有13种硅藻、6种甲藻、1种绿藻和1种裸藻,它们分别隶属于角毛藻、扇形藻、卵形藻、小环藻、桥弯藻、双壁藻、直链藻、舟形藻、菱形藻、拟菱形藻、针杆藻、海线藻、海链藻、角藻、膝沟藻、多甲藻、原甲藻、斯氏藻、浮球藻和裸藻等;其中,可被高丰度观察到的物种有颤动扁裸藻(Phacus oscillans,ESD≈14.4µm)(图 4c1)和 尖 刺 拟 菱 形 藻(Pseudonitzschia pungens,ESD≈12.1µm)(图4c2)。检出的ESD>20μm的有 15种硅藻和 6种甲藻,它们分别隶属于星脐藻、星杆藻、盒形藻、角管藻、圆筛藻、半管藻、楔形藻、直链藻、斜纹藻、根管藻、双菱藻、三角藻、亚历山大藻、鳍藻、裸甲藻、螺沟藻、原甲藻和原多甲藻等;其中,可被高丰度观察到的物种有海洋角管藻(Cerataulina pelagica,ESD≈22.1µm)(图4c3)和细长翼根管藻(Rhizosolenia alataf.gracillima,ESD≈26.0µm)(图4c4)。此外,用显微镜还检出了 ESD属于2—10μm尺寸范围的以下8个种类:具槽帕拉藻(Paralia sulcata,ESD≈9.1µm)、中肋骨条藻(Skeletonema costatum,ESD≈6.0µm)、盘星藻(Pediastrumsp.,ESD≈9.1µm)、栅藻(Scenedesmussp.,ESD≈5.5µm)、华美十字藻(Crucigenia lauterbornei,ESD≈4.0µm)、优美平列藻(Merismopedia elegans,ESD≈5.0µm)、两栖颤藻(Oscillatoria amphibian)(ESD≈3.1µm)和红海束毛藻(Trichodesmium erythraeum,ESD≈6.0µm),因为它们都形成了链状或团状群体,从而未能被流式细胞计检出。
异养细菌在流式细胞仪上未能详细划分类群,而病毒粒子却明显可以分成 Virus-Ⅰ型和 Virus-Ⅱ型2个类群(图4d);其中,Virus-Ⅰ型病毒类群明显具有比Virus-Ⅱ型病毒类群更强的绿色荧光。
2.4 浮游植物群落的尺寸结构和优势种
在 CY2009-1和 CY2009-2航次中,浮游植物群落的尺寸结构以 ESD<10µm 组分占绝对优势,在每个水样中 ESD<10µm 组分都可以贡献浮游植物总生物量的 99%以上(图5)。在 CH2010-1航次中,ESD>20µm 组分对浮游植物总生物量的贡献明显增加,尤其是在潟湖内湾水样中 ESD>20µm 组分普遍可以占到浮游植物总生物量的50%以上。XN2009航次的浮游植物群落尺寸结构与CY2009-1和CY2009-2这2个航次非常相类,同样也是以 ESD<10µm组分占优势;只是,在内湾水样中,ESD属于10—20µm组分对浮游植物总生物量的贡献略有增加。

图5 航次期间老爷海潟湖内浮游植物群落碳生物量尺寸结构(%)的空间分布Fig.5 Space distribution of size structure(%)of phytoplankton carbon biomass in Laoyehai Lagoon during cruises
在CY2009-1和CY2009-2航次中,Pico-1、Nano-1和 Nano-3是优势种,它们在绝大部分站位都可以贡献浮游植物总生物量的95%以上(表4)。在CH2010-1航次中,Pico-1、Nano-3和属于硅藻门的海洋角管藻是优势种;尤其在潟湖内湾水体中,海洋角管藻可以贡献浮游植物总生物量的 55%左右,并且形成褐色水华(海洋角管藻最大细胞丰度达到 1.3×106cell/L)。除了海洋角管藻以外,尖刺拟菱形藻和细长翼根管藻这2种硅藻也在CH2010-1航次的外湾水域中形成较高的细胞丰度,最大细胞丰度分别达到 0.6×106cell/L 和 0.1×106cell/L。在 XN2009航次中,Pico-1、Nano-1、Nano-2和Nano-3是优势种,它们在绝大部分站位可以贡献浮游植物总生物量的 80%左右;作为补充,颤动扁裸藻以较大丰度(最大细胞丰度为3.3×106cell/L)在内湾水域出现。
2.5 浮游植物群落碳生物量、异养细菌丰度和病毒丰度的空间分布特征
在CY2009-1、CY2009-2、CH2010-1和XN2009这4个生物航次中,浮游植物群落碳生物量都从口门向内湾迅速增加,并在外湾水柱中总是近乎垂直均一(图6a)。然而,内湾深坑水柱中浮游植物群落碳生物量的垂直分布特征则随季风阶段不同而有所差异:在CY2009-1、CY2009-2和XN2009这3个航次中都垂直层化(表层具有更高的碳生物量),在 CH2010-1航次中则垂直均一。

表4 生物航次各站位浮游植物优势种的碳生物量百分比贡献(%)Tab.4 Contribution(%)of dominant species in each station during cruises
异养细菌丰度、Virus-Ⅰ型和 Virus-Ⅱ型病毒丰度的空间分布特征都与浮游植物群落碳生物量基本一致(图6b—d)。它们在所有 4个生物航次中都从口门向潟湖内湾迅速增加,并在外湾水柱中垂直均一,而在内湾深坑水柱中则随季风阶段不同而有所差异;在CY2009-1、CY2009-2和XN2009这3个航次中都垂直层化(表层具有更高丰度的异养细菌、Virus-Ⅰ型病毒和Virus-Ⅱ型病毒),而在CH2010-1航次中则近乎垂直均一。
就异养细菌、Virus-Ⅰ型和 Virus-Ⅱ型病毒的绝对丰度而言,它们在不同航次之间都存在着一定程度的差异。异养细菌明显在CY2009-1、CY2009-2和XN2009这3个航次中都获得比CH2010-1航次更高的细胞丰度;CY2009-1、CY2009-2和XN2009航次中的异养细菌细胞丰度从口门站位的约 4.0×109cell/L增加到内湾的约18.0×109cell/L,而CH2010-1航次中的异养细菌细胞丰度则是从口门站位的约2.0×109cell/L 增加到而内湾的约 12.0×109cell/L(图6b)。与之相反,Virus-Ⅰ型病毒则在CH2010-1航次中明显获得比CY2009-1、CY2009-2和XN2009这3个航次更高的丰度;CH2010-1航次中的Virus-Ⅰ型病毒丰度从口门站位的约 10.0×109virus/L增加到内湾的约 60.0×109virus/L,而 CY2009-1、CY2009-2和 XN2009航次中的 Virus-Ⅰ型病毒丰度则是从口门站位的约5.0×109virus/L 增加到内湾的约 35.0×109virus/L(图6c)。Virus-Ⅱ型病毒同样也是在 CH2010-1航次中获得更高的丰度,只是 Virus-Ⅱ型病毒丰度普遍要比Virus-Ⅰ型病毒丰度高出约1倍(图6d)。

图6 航次期间老爷海潟湖内浮游植物群落碳生物量(mg/L)、异养细菌丰度(×109cell/L)和病毒丰度(×109virus/L)的空间分布Fig.6 Space distribution of phytoplankton carbon biomass(mg/L),heterotrophic bacteria abundance(×109cell/L)and virus abundance(×109virus/L)in Laoyehai Lagoon during cruises
3 讨论
3.1 水柱结构对季风气象条件的响应
在对老爷海内水柱结构的调查结果进行讨论之前,我们先了解一下老爷海内的水体交换时间,以及南海季风气象条件对老爷海水体的层化能力。鉴于降水利于水体中盐度跃层的形成、高温利于水体中温度跃层的形成、而高风速则会破坏水柱层化,从而我们可以建立某时段内气象条件对下界面受控水体的层化能力指数及其年际变率如下:


将老爷海潟湖内的水平衡和盐平衡参数分别带入LOICZ箱式模型(Gordonet al,1996)中可得出:潟湖水交换时间在干季时期为20天(内湾)和8天(外湾),而在湿季时期为13天(内湾)和4天(外湾)(表5);也即,潟湖内湾的水交换时间远大于外湾,而干季的水交换时间又明显大于湿季。将琼海站(与老爷海潟湖最近的国际地面交换站)近40年(1971—2010年)的气象数据带入公式(1)、(2)后,可得出:在 40年平均状态下,西南季风盛行期气象条件对老爷海潟湖水体具有很高的层化能力(平均层化能力指数D约为 0.3),而且,这种高层化能力具有年际稳定的特征(层化指数的年际变率CV约为80%)(图7)。恰相反地,春季季风转换期气象条件对潟湖水体的层化能力较低(D约为0.1),但是这种低层化能力明显具有年际变化大的特征(CV约为150%)。

表5 老爷海潟湖水体的水平衡参数、盐平衡参数以及用LOICZ箱式模型得出的水交换时间Tab.5 Estimation of water residence time using LOICZ box model for Laoyehai Lagoon
在本研究于3个不同年份(2008、2009和2011年)所执行的3个西南季风盛行期航次中,潟湖内湾深坑水柱总是表现出很高的垂直稳定度,这显然与西南季风气象条件的高层化能力指数及其低年际变率有关。在2009年和2010年春季季风转换期所执行航次中,潟湖内湾深坑水柱的垂直稳定度表现出了显著年际差异,这显然与春季季风转换期气象条件对潟湖水体的层化能力具有很高的年际变率有关。其中,2009年春季季风转换期(形成充沛春雨)的气象条件(特别是高风速)不利于层化的形成,而 2010年春季季风转换期(形成春旱)的气象条件(少雨和微风)则有利于增加水柱的垂直稳定度。最后,在水深很浅的外湾水域,水柱结构在7个航次调查中总是呈现为近乎于垂直混合均一的状态,这应该与外湾水体的水停留时间短暂有很大的关系,当然也与外湾水域更容易受到口门附近的潮流冲刷混合影响有关。
3.2 浮游植物群落组成对盐度格局调整的响应
作为一个被人类活动扰动剧烈的水产养殖区,老爷海潟湖水体显然并不缺乏营养盐。在本研究4个生物航次调查中,潟湖水体中的溶解态营养盐被高丰度浮游植物群落吸收利用后依然保持有较高的浓度;其中,无机氮 DIN、无机磷和硅酸盐在外湾水体中的平均浓度分别可以达到 60、2和20μmol/L以上,而在内湾水体中的平均浓度更可达到 80、3和 35μmol/L 以上(李瑞环,2010;李延伟,2011)。由此可见,营养盐元素的摩尔比并不会对潟湖中浮游植物群落结构组成构成明显的调控作用。然而,航次调查期间淡水加载随降水的大幅变化却直接导致了潟湖内盐度格局的变化(例如:在 XN2009、CY2009-1和 CY2009-2航次充沛降水情况下形成的低盐度格局,在CH2010-1航次干旱情况下形成的高盐度格局),而冗长的水停留时间又使得潟湖内湾区域可以在一定时段内形成相对稳定的盐度格局。从而,盐度格局调整可能直接导致了本研究中浮游植物群落组成的转变(从低盐度格局航次中的以 ESD<10µm类群Pico-1、Nano-1、Nano-2和Nano-3占优势转变为高盐度格局航次中的以 ESD>10µm 的硅藻海洋角管藻占优势)。进一步对本研究浮游植物优势种类的盐度适应性进行深入分析,也的确证明了这一点。微微型藻类Pico-1缺乏橙色荧光,而橙色荧光是藻红蛋白(phycoerythrin,PE)的荧光特征,从这点来看,Pico-1应该是在河流(Cristiana,2008)、水库(Corzoet al,1999)、湖泊(Nicholaset al,2003)和河口低盐水(Shanget al,2007)等陆地水体中常常被流式细胞计所检测到的富含藻蓝蛋白(phycocyanin,PC)的微微型蓝藻。微型藻类Nano-1、Nano-2和Nano-3都具有橙色荧光,由此来判断它们应该属于隐藻门,因为在微型浮游植物类群中只有隐藻具有藻红蛋白(Liet al,2001);而且,隐藻也常在低盐度盐沼水中被高丰度地观察到(Nuccioet al,2003;Badylaket al,2004)。海洋角管藻(硅藻)则是沿岸高盐水体中的常见种,它常常在 20—34盐度的海水中生长适宜并形成水华(Tayloret al,1985;Horneret al,2005);从而,在本研究2010年春季季风转换期航次的高盐度(最低盐度为21)内湾水体中观察到海洋角管藻水华是很合理的。

图7 近40年期间(1971—2010)老爷海潟湖上界面气象因子的多年平均值及其年际变率Fig.7 Average values of weather factors and its interannual variability above Laoyehai Lagoon in 40 years(1971—2010)
3.3 浮游植物生物量的空间分布格局及其与异养细菌和病毒之间的耦合
在本研究中,浮游植物群落总是在潟湖内湾获得比外湾更高的生物量,这应该与内湾具有比外湾更长的水交换时间有关。因为浮游植物细胞在弱交换水体中有更充足的时间吸收利用营养盐而容易累积成高生物量,然而在水交换快的水体则容易因冲刷稀释而保持在低丰度水平;如果说浮游植物在弱交换水体中的生长近似于封闭体系中的“批量培养”,那么在水交换快的水体中的生长就更近似于开放体系中的“连续培养”(Yin,2003)。在硅藻海洋角管藻形成水华的CH2010-1航次中,浮游植物生物量在内湾深坑水柱中垂直均一,这应该与硅藻细胞具有更快的沉降速度有关。而在Pico-1、Nano-1、Nano-2和Nano-3这4个ESD<10µm组分占优势的航次期间,浮游植物群落生物量在内湾深坑水柱中明显垂直层化,这应该是因为:ESD<10µm组分的重力沉降速度慢,使得它们在水柱表层因光照充足而形成高生物量,而在水柱底层因光限制而形成低生物量。本文塞氏深度测量的结果也表明,老爷海潟湖水体的真光层深度在3—4m左右波动,从而在内湾深坑(水深达到6m左右)水柱底层存在约2m厚的无光照水体。
在本研究中,异养细菌和病毒丰度的空间分布格局与浮游植物生物量几乎完全一致,这显然归因于它们彼此之间的“消费-供给”关系:浮游植物通过分泌和破裂(例如浮游动物啃食、病毒裂解等)而向水体释放出的“活性有机质(labile organic matter)”是异养细菌生长的良好基质(Hanamachiet al,2008),而浮游植物和异养细菌又都是浮游病毒粒子的宿主(Weinbauer,2004)。具有强绿色荧光(FL1)信号(DNA含量更高)的 Virus-Ⅰ型病毒容易感染浮游植物,而弱绿色荧光信号(DNA含量低)的Virus-Ⅱ型病毒类群容易感染异养细菌(Robinsonet al,1999)。此外,已经有不少的野外现场研究调查都表明,硅藻相较于其它种类的藻类细胞更容易被 Virus-Ⅰ型病毒感染(Bettarelet al,2005;Tomaruet al,2009)。而本研究调查结果也表明,无论是 Virus-Ⅰ型病毒还是 Virus-Ⅱ型病毒都是在以硅藻占优势的航次中获得更高的丰度,而异养细菌则刚好相反是在以 ESD<10µm 组分占优势的航次中获得更高的细胞丰度。
3.4 底层缺氧规模对季风气候节律的响应
自然水体中溶氧的主要来源是从大气向水体中溶入氧气和浮游植物光合作用释放氧气,因为这两者都是在表层(真光层)水体中达到最大,从而自然水柱中的溶解氧含量通常都呈现为从表到底逐渐降低的趋势。在本研究中,我们也观察到溶解氧含量在水深浅(真光层直达水底)和水交换快的潟湖外湾水域中总是相对较高,而在水交换慢的内湾深坑水柱(深度达到 6m 左右)中溶解氧含量总是随着深度增加而降低,并在深坑最底层达到最低值。
水柱层化阻碍底层水体的复氧(表层高溶氧水体向底层输运),以及充足有机质在底层水体中的生物耗氧是底层缺氧现象得以形成的两个重要条件(Diaz,2001)。在本研究形成充沛春雨的春季季风转换期(CY2009-1和CY2009-2航次),气象条件主要表现为高风速和多雨,这不利于内湾深坑水柱的层化,但是可以在内湾形成适合低盐度生态型藻类(例如ESD<10µm 的 Pico-1、Nano-1、Nano-2 和 Nano-3)生长的低盐度生境。这些微微型和微型藻类的生物量、以及异养细菌和病毒粒子的丰度都在内湾深坑水柱中呈现出显著层化(表层高,而底层很低),这不仅反映了微微型和微型藻类细胞具有垂直沉降慢的特点(Richardsonet al,2007),同时也间接反映了航次期间浮游植物合成有机质的垂向通量很低(主要在表层被转换利用,供养了表层高丰度的细菌和病毒粒子)。从而,垂直混合加速复氧以及浮游植物合成有机质垂向通量低二者相耦合,是春季季风转换期(形成充沛春雨)航次中很难形成底层缺氧现象的主要原因(图8)。在本研究形成春旱的春季季风转换期(CH2010-1航次),气象条件表现为少雨和微风,这有利于内湾深坑水柱层化,并且可以在内湾营造出适合高盐度生态型藻类(例如硅藻海洋角管藻)生长的高盐度生境格局。浮游植物群落(以海洋角管藻为绝对优势)生物量、以及异养细菌和病毒粒子的丰度都在内湾水柱中几乎垂直一致,甚至浮游植物群落生物量在内湾LYH-6站位还表现出了底层略高于表层的现象(图6a)。这不仅反映了硅藻细胞具有沉降快的特点(Miklaszet al,2010),同时也间接反映了航次期间浮游植物合成有机质有着可观的垂向通量(在整个水柱被转换利用,进而供养了整个水柱丰度基本一致的细菌和病毒粒子)。从而,水柱层化阻碍复氧以及浮游植物合成有机质垂直通量高二者相耦合,是春季季风转换期(形成显著春旱)航次中形成大规模缺氧的主要原因。在本研究不同年度所执行3个西南季风盛行期航次中的气象条件都表现为高温、微风和多雨,这种气象条件有利于水柱层化,并且在内湾形成适合低盐度生态型藻类(例如 Pico-1、Nano-1、Nano-2和Nano-3)生长的低盐度生境。从而,水柱层化阻碍复氧以及浮游植物合成有机质垂向通量低二者相耦合,是西南季风盛行期航次中总是容易形成小规模缺氧的主要原因。最后,在CH2010-1航次中形成了大规模底层缺氧,这与“该航次期间浮游植物生物量和异养细菌的现存量比其他航次都低约0.5—2倍”二者之间似乎矛盾。但是这种矛盾可以从 CH2010-1航次期间病毒的异常高丰度(比其他航次高 2—3倍)给出合理解释,因为 Virus-Ⅰ型病毒可以裂解硅藻细胞释放大量有机质,这些有机质供养了高丰度异养细菌,而 Virus-Ⅱ型病毒又通过感染裂解将异养细菌压制到低丰度。
4 结论
(1)老爷海潟湖内湾具有独特的深坑地形,深坑水柱底层的无光照水体总是获得整个潟湖水体中的最低溶解氧含量;潟湖上界面的南海季风气象条件通过干涉深坑水柱结构和浮游植物群落组成来影响到底层缺氧规模。

图8 老爷海潟湖内底层缺氧规模对南海季风气候节律响应的概念图Fig.8 Conceptual diagram of the response of bottom hypoxia in Laoyehai Lagoon to the monsoon climate rhythm in the South China Sea
(2)春季季风转换期气象条件的年际变化大,导致此时期深坑底层的缺氧规模也表现出显著的年际变化。在形成充沛春雨的年度(气象条件表现为高风速和多雨),深坑水柱垂直稳定性差,低盐度生境促成了浮游植物群落以微微型和微型藻类(沉降速度慢)占优势,从而常常观察不到底层缺氧现象。而在形成显著春旱的年度(气象条件表现为微风和少雨),深坑水柱明显层化,高盐度生境促成了硅藻(容易沉降)占优势,从而可以形成大规模底层缺氧,缺氧水体蔓延到外湾网箱养殖区,可以造成鱼类大规模死亡。
(3)西南季风盛行期有着相当稳定的气象条件(高温、微风和多雨),深坑水柱层化强烈,但是低盐度生境中占优势的小尺寸藻类的沉降速度慢(有机质通量低),从而容易形成小规模底层缺氧现象。
致谢在海南岛野外采样期间,得到了来自华东师范大学、中国海洋大学、海南省海洋开发规划设计研究院、德国不来梅大学热带海洋研究中心和汉堡大学的各位老师和研究生们的帮助和协作,特此表示感谢。
中国科学院南海海洋研究所,2006.神州半岛老爷海水务研究及整治报告.广州:中国科学院南海海洋研究所,9—47
水利部水文局,2003.全国水情年报.北京:中国水利水电出版社,1—128
水利部水文局,2009.全国水情年报.北京:中国水利水电出版社,23—24
水利部水文局,2010.全国水情年报.北京:中国水利水电出版社,1—164
李延伟,2011.海南东部近海地区磷和硅的研究.青岛:中国海洋大学硕士学位论文,43—51
李瑞环,2010.海南东部近海地区营养盐动力学的研究.青岛:中国海洋大学硕士学位论文,52—54
吴 棉.万宁再次整治老爷海.海南日报,2002-01-25
张黎明,魏志远,漆智平等,2006.近30年海南不同地区降雨量和蒸发量分布特征研究.中国农学通报,22(4):403—407
金德祥,1965.中国海洋浮游硅藻类.上海:上海科学出版社,1—230
金德祥,程兆第,刘师成等,1992.中国海洋底栖硅藻类(下卷).北京:海洋出版社,1—437
金德祥,程兆第,林均民等,1982.中国海洋底栖硅藻类(上卷).北京:海洋出版社,1—325
胡鸿钧,李尧英,魏印心等,1980.中国淡水藻类.上海:上海海科学技术出版社,1—530
俞胜宾,翟盘茂,张强等,2006.1961—2004海南岛干旱演变特征分析.热带作物学报,27(3):111—115
翁朝健.拯救老爷海.海南日报,2008-04-27
唐文浩,岳 平,饶义平等,2007.海南高位池海水养殖污染控制技术研究.海口:海南出版社,44—52
海南省水务厅,2008.海南省水资源公报.海口:海南省水务厅水资源水土保持处,1—20
海南省地方志办公室,2005.海南省志水利志.海口:南海出版公司,809
琼 文.这“虫”那“菌”吞噬海水养殖户几千万.海南经济报,2010-03-18
Badylak S,Phlips E,2004.Spatial and temporal patterns of phytoplankton composition in subtropical coastal lagoon,the Indian River Lagoon,Florida,USA.Journal of Plankton Research,26(10):1229—1247
Bettarel Y,Kan J,Wang Ket al,2005.Isolation and preliminary characterisation of a small nuclear inclusion virus infecting the diatomChaetoceroscf.gracilis.Aquatic Microbial Ecology,40(2):103—114
Campbell L,Nolla H,Vaulot D,1994.The importance ofProchlorococcusto community structure in the central North Pacific Ocean.Limnology and Oceanography,39(4):954—961
Caron D A,Dam H G,Kremer Pet al,1995.The contribution of microorganisms to particulate carbon and nitrogen in surface waters of the Sargasso Sea near Bermuda.Deep Sea Research Part I,42(6):943—972
Cloern J E,1987.Turbidity as a control on phytoplankton biomass and productivity in estuaries.Continental Shelf Research,7(11):1367—1381
Corzo A F,Jimnez-Gmez F J,Gordillol Ret al,1999.SynechococcusandProchlorococcus-like populations detected by flow cytometry in a eutrophic reservoir in summer.Journal of Plankton Research,21(8):1575—1581
Cristiana C,2008.Picophytoplankton in freshwater ecosystems:the importance of small-sized pototrophs.Freshwater Reviews,1(1):1—28
Diaz R J,2001.Overview of hypoxia around the world.Journal of Environmental Quality,30(2):275—281
Duursma E K,Dawson R,1981.Marine Organic Chemistry.Elsevier Scientific Publishing,Amsterdam,Holland:521
Gonenc I E,Wolflin J P,2004.Coastal Lagoons:Ecosystem Processes and Modeling for Sustainable Use and Development.CRC Press,Florida,US:193—229
Gordon D C,Boudreau P R,Mann K Het al,1996.LOICZ Biogeochemical Modelling Guidelines.Netherlands Institute for Sea Research,Texel,Holland:1—96
Hanamachi Y,Hama T,Yanai T,2008.Decomposition process of organic matter derived from freshwater phytoplankton.Limnology,9(1):57—69
Hillebrand H,Dürselen C D,Kirschtel Det al,1999.Biovolume calculation for pelagic and benthic microalgae.Journal of Phycology,35(2):403—424
Holmes R W,1970.The Secchi disk in turbid coastal waters.Limnology and Oceanography,15(4):688—694
Horner R A,Postel J R,Halsband-Lenk Cet al,2005.Winter-spring phytoplankton blooms in Dabob Bay,Washington.Progress in Oceanography,67(3):286—313
Ji T,Du J,Moore W Set al,2013.Nutrient inputs to a Lagoon through submarine groundwater discharge:The case of Laoye Lagoon,Hainan,China.Journal of Marine Systems,111:253—262
Kennish M J,Paerl H W,2010.Coastal Lagoons:Critical Habitats of Environmental Change.CRC Press,Florida,US:17—42.
Lashaway A R,Carrick H J,2010.Effects of light,temperature and habitat quality on meroplanktonic diatom rejuvenation in Lake Erie:implications for seasonal hypoxia.Journal of Plankton Research,32(4):479—490
Li W,Dickie P,2001.Monitoring phytoplankton,bacterioplankton,and virioplankton in a coastal inlet(Bedford Basin)by flow cytometry.Cytometry,44(3):236—246
Li Y,Wang D R,Su Jet al,2013.Impact of monsoon–driven circulation on phytoplankton assemblages near fringing reefs along the east coast of Hainan Island,China.Deep Sea Research Part II,96:75—87
Lloret J,Marín A,Marín-Guirao L,2008.Is coastal lagoon eutrophication likely to be aggravated by global climate change? Estuarine,Coastal and Shelf Science,78(2):403—412
Menden-Deuer S,Lessard E J,2000.Carbon to volume relationships for dinoflagellates,diatoms,and other protist plankton.Limnology and Oceanography,45(3):569—579
Michaels A F,Silver M W,1988.Primary production,sinking fluxes and the microbial food web.Deep Sea Research Part I,35(4):473—490
Miklasz K A,Denny M W,2010.Diatom sinking speeds:Improved predictions and insight from a modified Stokes'law.Limnology and Oceanography,55(6):2513—2525
Nicholas D C,Katrin T,Thomas W,2003.Flow-cytometric mapping provides novel insights into the seasonal and vertical distributions of freshwater autotrophic picoplankton.Aquatic Microbial Ecology,33:53—66
Nuccio C,Melillo C,Massi L,2003.Phytoplankton abundance,community structure and diversity in the eutrophicated Orbetello lagoon(Tuscany)from 1995 to 2001.Oceanologica Acta,26(1):15—25
Pan L A,Zhang L H,Zhang Jet al,2005.On-board flow cytometric observation of picoplankton community structure in the East China Sea during the fall of different years.FEMS microbiology ecology,52(2):243—253
Parker B,1991.Tidal Hydrodynamics.John Wiley &Sons,New York,US:169—181
Qian W,Kang H S,Lee D K,2002.Distribution of seasonal rainfall in the East Asian monsoon region.Theoretical and Applied Climatology,73(3):151—168
Rabalais N N,Turner R E,Gupta B K Set al,2007.Sediments tell the history of eutrophication and hypoxia in the northern Gulf of Mexico.Ecological Applications,17(5):S129—S143
Reckermann M,Veldhuis M J W,1997.Trophic interactions between picophytoplankton and micro-and nanozooplankton in the western Arabian Sea during the NE monsoon 1993.Aquatic Microbial Ecology,12:263—273
Reul A,Muñoz M,Criado-Aldeanueva F,2006.Spatial distribution of phytoplankton<13μm in the Gulf of Cádiz in relation to water masses and circulation pattern under westerly and easterly wind regimes.Deep Sea Research Part II,53(11):1294—1313
Richardson T L,Jackson G A,2007.Small phytoplankton and carbon export from the surface ocean.Science,315(5813):838—840
Robinson J P,1999.Current Protocols in Cytometry.John Wiley&Sons,Inc.,New York,US:Supplement 11
Shang X,Zhang L H,Zhang J,2007.Prochlorococcus-like populations detected by flow cytometry in the fresh and brackish waters of the Changjiang Estuary.Journal of the Marine Biological Association of the United Kingdom,87(3):643—648
Taylor F,Taylor N,Walsby J,1985.A bloom of the planktonic diatom,Cerataulina pelagica,off the coast of northeastern New Zealand in 1983,and its contribution to an associated mortality of fish and benthic fauna.Internationale Revue der gesamten Hydrobiologie und Hydrographie,70(6):773—795
Tomaru Y,Takao Y,Suzuki Het al,2009.Isolation and characterization of a single-stranded RNA virus infecting the bloom-forming diatomChaetoceros socialis.Applied and Environmental Microbiology,75(8):2375—2381
Tomas C R,1997.Identifying Marine Phytoplankton.Academic Press,San Diego,US:1—856
Tomczak M,Godfrey J S,1994.Regional Oceanography:An Introduction.Elsevier Science Ltd.,Oxford,UK:1—422
Veldhuis M J W,Kraay G W,Van Bleijswijk J D Let al,1997.Seasonal and spatial variability in phytoplankton biomass,productivity and growth in the northwestern Indian Ocean:The southwest and northeast monsoon,1992—1993.Deep Sea Research Part I,44(3):425—449
Weinbauer M G,2004.Ecology of prokaryotic viruses.FEMS Microbiology Reviews,28(2):127—181
Yin K D,2003.Influence of monsoons and oceanographic processes on red tides in Hong Kong waters.Marine Ecology Progress Series,262:27—41
Zhang J,Gilbert D,Gooday A Jet al,2010.Natural and human-induced hypoxia and consequences for coastal areas:synthesis and future development.Biogeosciences,7(5):1443—1467

