北黄海海域虾夷扇贝体内脂溶性藻毒素分析*
陈建华 于仁成 孔凡洲 高 岩 罗 璇 王云峰 周名江
(1.中国科学院海洋研究所海洋生态与环境科学重点实验室 青岛 266071;2.中国科学院大学 北京 100049)
海洋中的部分有毒藻类能够产生藻毒素,这些藻毒素的化学结构差异很大,致毒机理也不相同。在联合国粮农组织(Food and Agriculture Organization,FAO)、政府间海洋学委员会(Intergovernmental Oceanographic Commission,IOC)和世界卫生组织(World Health Organization,WHO)联合召开的海洋生物毒素会议上,按照藻毒素的化学结构,将其分为 8类(Toyofuku,2006),即原多甲藻酸类(Azaspiracids,AZAs)、短裸甲藻毒素类(Brevetoxins,BTXs)、环亚胺类(Cyclic imines,CIs)、软骨藻酸类(Domoic acid,DAs)、大田软海绵酸类(Okadaic acid,OAs)、扇贝毒素类(Pectenotoxins,PTXs)、石房蛤毒素类(Saxitoxins,STXs)和虾夷扇贝毒素类(Yessotoxins,YTXs)。在这些藻毒素中,除石房蛤毒素类和软骨藻酸类之外,均为脂溶性毒素。这些脂溶性藻毒素易于在滤食性贝类体内累积,人们食用染毒贝类后,会出现各种急性和慢性中毒症状(Daranaset al,2001;Creppyet al,2002;Itoet al,2002;Dragunowet al,2005)。
贝类沾染脂溶性藻毒素是沿海国家常见的水产品食品安全问题之一(Shumway,1990;Hallegraeff,1993;Zhouet al,1999)。因脂溶性藻毒素沾染导致的中毒事件在日本、美国和欧洲等国家时有报道(Picotet al,2011)。近年来,对中国沿海贝类样品中的毒素调查结果显示,脂溶性藻毒素沾染问题也同样不容忽视(表1)。2011年5月25—31日,在福建宁德和浙江宁波两地就发生了因食用被腹泻性贝毒沾染的紫贻贝引起的中毒事件,中毒人数多达200人。经检测发现,贝类中主要的毒素成分是OA和DTX1(Liet al,2012a)。其他脂溶性毒素在中国沿海的贝类中也时有检出,通过高效液相色谱-质谱联用分析方法,在我国北海的缘齿牡蛎中发现了环亚胺类毒素 GYM(刘仁沿等,2008),在大连海域的虾夷扇贝中发现了YTXs(高春蕾等,2010),在我国北方海域贝类中检测到了PTXs毒素(Liet al,2010;Liuet al,2011)。此外,脂溶性毒素SPX和AZA1在我国贝类中也有检出报道(姚建华等,2010a)。
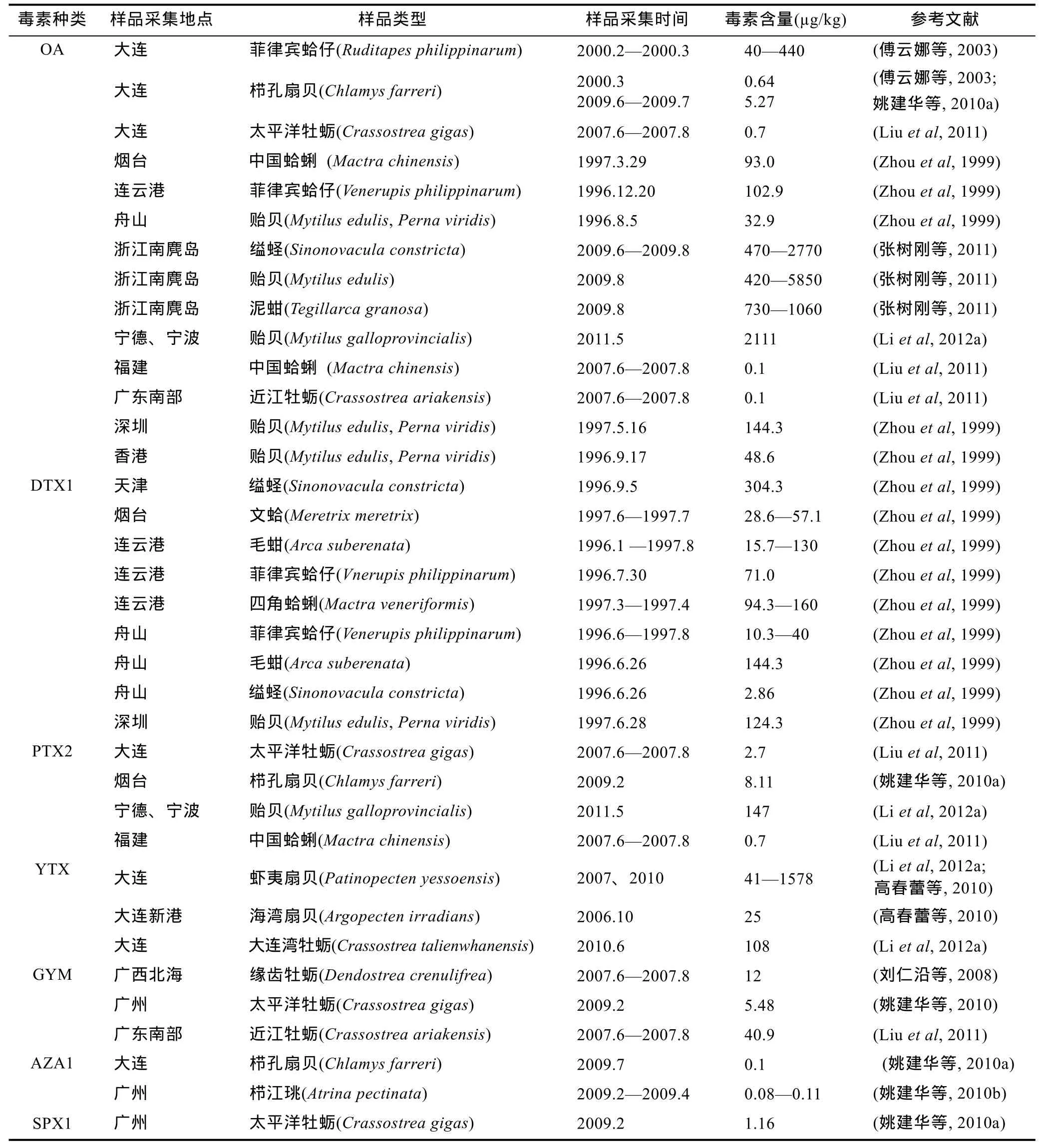
表1 中国沿海贝类中脂溶性藻毒素的检出情况Tab.1 Lipophilic phycotoxins detected in shellfish samples collected along the coast of China
对于常见脂溶性藻毒素的检测,通常采用生物毒性测试法或化学分析法。小鼠生物测试法是最为常用的毒性测试方法,对于OA、PTX、YTX等脂溶性藻毒素成分,小鼠生物测试法仍然是毒性初筛的重要方法。但是,生物学测试方法存在特异性低、灵敏度差、假阳性率高、准确性和重现性低等问题。高效液相色谱-质谱联用方法是最具应用潜力的藻毒素分析方法,依靠质谱强大的定性和定量分析能力,可以实现多类脂溶性毒素的同步分析。Quilliam(2003)最早应用酸性的水/乙腈流动相进行梯度洗脱,建立了多类脂溶性毒素的同步分析方法,但是,由于采用了阳离子模式进行检测,这个方法不能对YTX类毒素进行分析。Stobo等(2005)采用了含有醋酸铵的中性(pH 6.8)水/乙腈流动相进行梯度洗脱,能够对欧盟标准中提及的所有毒素进行分离,并获得了更好的分离效果。Fux等(2007)发展了一种UPLC方法,采用含有甲酸铵和甲酸的水/乙腈梯度洗脱流动相,结合质谱的快速极性转换,可以在6.6分钟内实现对21种脂溶性藻毒素的分离。Gerssen等(2009)则提出了碱性流动相洗脱方法,结合质谱的快速极性转换,能够得到更好的色谱分离效果,特别适合于多类脂溶性毒素的同步分析。
北黄海海域是我国虾夷扇贝的主要增养殖区,以往虾夷扇贝中曾检测到脂溶性藻毒素成分,个别样品甚至出现了毒素含量超标情况(杨莉等,2006;雷芳,2009)。然而,已有研究中大多采用了小鼠法对毒性进行测试,存在假阳性和毒素成分不明确等缺点。本研究应用液-质联用技术,通过Gerssen等(2009)建立的碱性流动相方法,对北黄海海域虾夷扇贝样品中的脂溶性藻毒素进行了分析,以求了解北黄海海域贝类中脂溶性藻毒素的沾染状况,为针对性地开展贝类质量监控和有毒藻类监测提供科学依据。
1 实验材料与方法
1.1 样品采集与保存
虾夷扇贝样品于2011年7月和8月采集于北黄海海域,具体采样地点和贝类情况见图1和表2;用海水冲洗去除贝类外壳附着物后,将样品放入密封袋中,送回实验室内,于–20°C冰箱中保存直至分析。

图1 北黄海虾夷扇贝样品采集区域示意图Fig.1 The sampling area of Patinopecten yessoensis in the northern Yellow Sea

表2 虾夷扇贝样品描述Tab.2 Sample specifications of scallops Patinopecten yessoensis collected from the northern Yellow Sea
1.2 仪器与试剂
仪器:带有二元梯度泵和自动进样器的美国安捷伦高效液相色谱系统(Agilent 1200,USA)、美国应用生物系统公司的三重四级杆串联质谱系统(API 4000,Applied Biosystems,Foster City,CA,USA)、美国 Waters公司的 C18反相色谱柱(Waters,X-Bridge C18,5μm,3mm×150mm)、德国Sigma台式高速冷冻离心机(sigma 3-16K)、Philips手持式搅拌机(Philips Viva Collection,hand blender,HR1613)、德国IKA高速组织匀浆机(IKA,homogenizer workcenter,T 10 B S25)、德国IKA旋转震荡器(IKA,MS1 Minishaker)、固相萃取仪(天健奥特赛恩斯仪器有限公司,ASE-12固相萃取仪)、固相萃取柱(Waters,HLB,30mg/mL)、美国Millipore Simplicity超纯水机等。
试剂:甲醇、乙腈、氨水等试剂均为色谱纯级,脂溶性藻毒素标准品(OA、PTX2、YTX、SPX1、AZA1和 GYM)购自加拿大国家研究院海洋生物科学研究所,脂溶性藻毒素DTX1标准品购自日本Wako公司。
1.3 毒素提取
冷冻贝样于室温下自然解冻后,用解剖刀将贝肉与贝壳分离,置于纱布上沥水 5min,将贝肉分成闭壳肌、外套膜、内脏团和性腺四部分,分别取适量贝组织于搅拌机内搅碎、混匀。毒素提取参照 Gerssen等(2009)对贻贝的提取方法,称取1g匀浆组织于5mL离心管内,并加入3mL甲醇,震荡混匀1min后,放入离心机中2000g离心5min,将上清液转移到15mL离心管中。重复上述操作2次,合并上清液,并用甲醇定容至10mL,5000g离心1min后,经0.22μm有机滤膜(ANPEL,SCAA-104,13mm,0.22µm)过滤。
1.4 固相萃取
提取的毒素溶液以HLB固相萃取柱纯化。固相萃取柱首先用1mL 甲醇活化,并以30%(V/V)甲醇溶液淋洗平衡。吸取1.2mL毒素提取液于5mL离心管中,加入2.8mL超纯水后充分混匀,得到甲醇浓度为30%的提取液,并转移至萃取柱中。用1mL 20%甲醇溶液清洗萃取柱,去除杂质。再用1.2mL甲醇溶液(含0.3%氨水)洗脱待测物,并移至进样瓶内。实验数据表明,该处理方法对几种毒素的回收率分别为OA:91.%3±7.3%,DTX1:101.3%±1.8%,YTX:98.7%±25.9%,PTX2:52.5%±4.6%,AZA1:80.0%±3.4%,GYM:64.9%±5.1%,SPX1:40.9%±3.3%。考虑到毒素PTX2、GYM和SPX1等毒素的回收率较低,但回收率较为稳定(RSD<10%),因此最终毒素含量结果以检测结果除以回收率计算。
1.5 毒素分析
参照 Gerssen等(2009)建立的多类脂溶性毒素同步分析方法,根据实验室实际条件稍作修改。具体检测条件简述如下:采用两相洗脱液,流动相A为100%超纯水,流动相 B为 90%乙腈,两者都含有6.7m mol/L NH4OH(pH 11.0)。采用梯度洗脱,洗脱梯度条件如表3所示,洗脱液流速 400μL/min,进样量20μL,色谱柱温为25°C。采用快速极性转换方法,多反应模式对毒素进行检测,第0—5min采用阳离子扫描模式,主要分析检测软骨藻酸 DA,但是,由于本文采用的毒素提取方式对DA回收率过低,因此文中未对DA进行定量分析;第5—8.5min采用阴离子扫描模式,检测OA、DTX1和YTX;第8.5—17min采用阳离子模式,检测GYM、AZA1、PTX2和SPX1。分析前以标准毒素溶液对质谱检测器进行调谐,优化质谱检测器的参数,调谐后的质谱参数为:阳离子监测模式下电喷雾电压 5500V,碰撞室入口电压10V,碰撞室出口电压 10V,幕帘气压 10Pa,碰撞气压8 Pa,离子源温度500°C;在阴离子监测模式下电喷雾电压为–4500V,碰撞室出口电压为–10V,其余参数与阳离子模式下相同。检测离子及调谐后的相应去簇电压和碰撞能参数如表4。
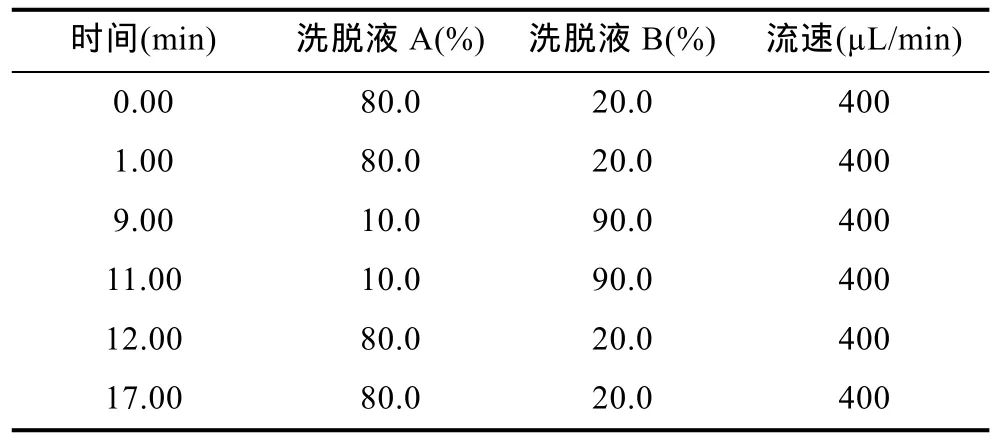
表3 液相色谱-串联质谱联用法分析脂溶性毒素的洗脱梯度Tab.3 Gradient elution in detection of marine lipophilic phycotoxin using HPLC-MS/MS

表4 脂溶性毒素的检测离子及其相应的去簇电压和碰撞能Tab.4 The characteristic ions for detection of lipophilic phycotoxin and corresponding value of declustering potential and collision energy
2 实验结果
2.1 虾夷扇贝各组织中脂溶性毒素成分与组成
扇贝样品中脂溶性毒素分析的色谱图如图2所示。在扇贝的闭壳肌、外套膜、内脏团和性腺组织中均检测到OA、DTX1、PTX2和YTX四种脂溶性藻毒素成分,毒素含量如表5所示,未检出AZA1、SPX1和GYM毒素。在检出的各种毒素中,YTX含量最高,在各组织中所占比例均达90%以上(96.21%,90.24%—99.49%)。同一地点扇贝样品的各种组织之间,OA、DTX1和PTX2毒素的组成没有明显差别,而不同地点扇贝样品之间毒素组成的差异较为明显。在扇贝样品2的各种组织中,OA和DTX1所占比例可达91%(87%—98%),而在样品3的各种组织中,OA和DTX1毒素所占比例仅为61%(37%—72%)。
2.2 虾夷扇贝各组织中脂溶性藻毒素的含量
四种脂溶性毒素成分在各组织间的含量分布存在明显差异(图3)。毒素主要集中在内脏团中,含量由高到低依次为内脏团>性腺>外套膜>闭壳肌。扇贝各组织中藻毒素含量如表5所示。内脏团YTX的平均含量为2670µg/kg(825—6680µg/kg),性腺中平均含量为449µg/kg(146—915µg/kg),外套膜中含量为355µg/kg(32.5—1240µg/kg),在闭壳肌中含量最低,为140µg/kg(73.1—214µg/kg);OA在内脏团中平均含量为12.30µg/kg(1.97—34.5µg/kg),在性腺中含量为 1.61µg/kg(0.37—2.27µg/kg),在外套膜中含量为 1.29µg/kg(0—3.75µg/kg),闭壳肌中含量为0.93 µg/kg(0.41— 1.34µg/kg);PTX2在内脏团中平均含量为 16.90 µg/kg(1.12—50.10µg/kg),性腺中为 5.70 µg/kg(0.28—11.02µg/kg),在闭壳肌中含量只有0.60µg/kg(0.13—1.34µg/kg);DTX1在各组织中的含量分布表现为内脏团>性腺>闭壳肌>外套膜,内脏团中含量为 26.50µg/kg(4.97—77.30µg/kg),性腺中为3.42µg/kg(2.51—4.32µg/kg),闭壳肌中为3.02µg/kg(0.65—6.45µg/kg),外套膜中含量最低,仅为 1.46µg/kg(0—5.07µg/kg)。
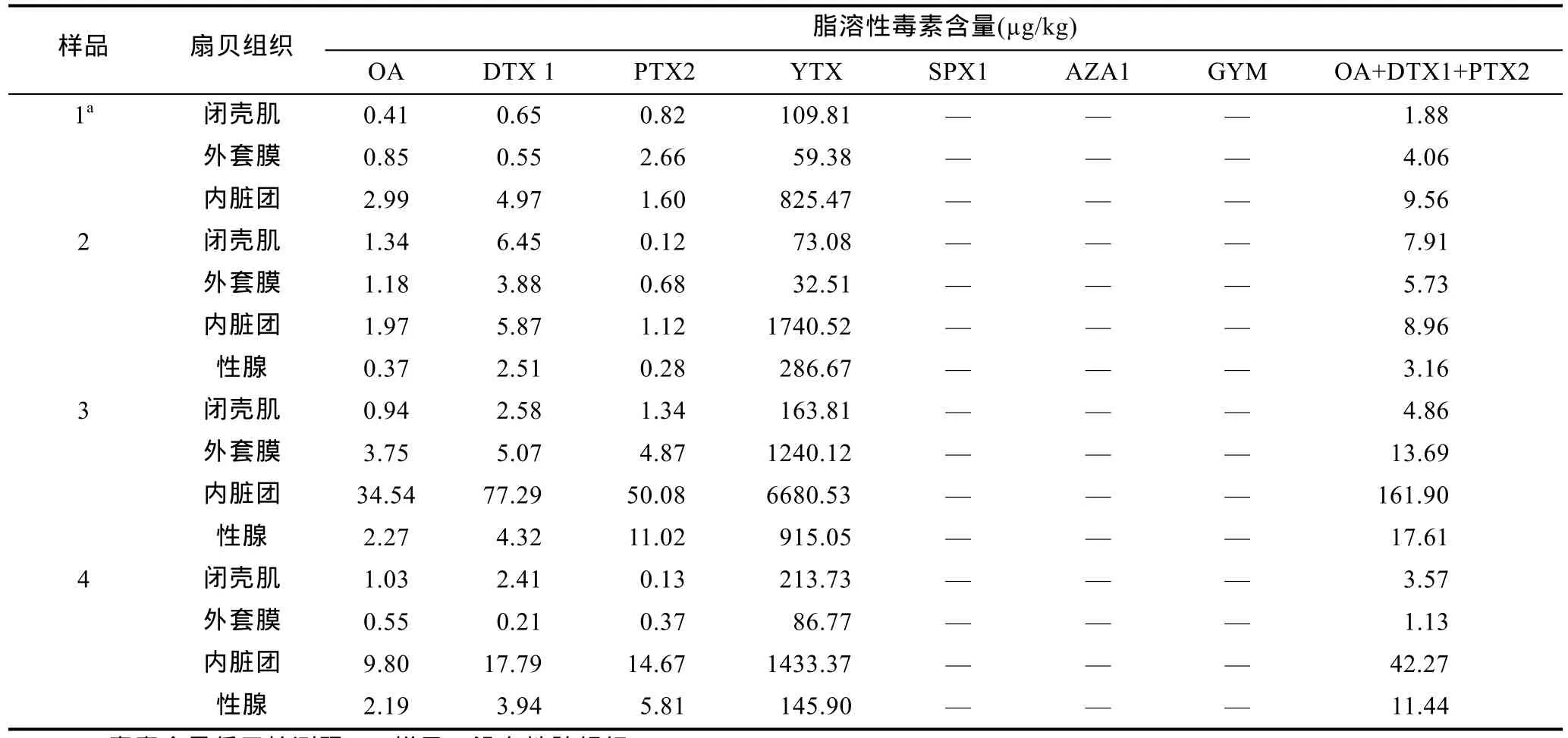
表5 北黄海海域虾夷扇贝各组织中脂溶性毒素的组成与含量Tab.5 Profile and content of lipophilic phycotoxin in different tissues of scallops
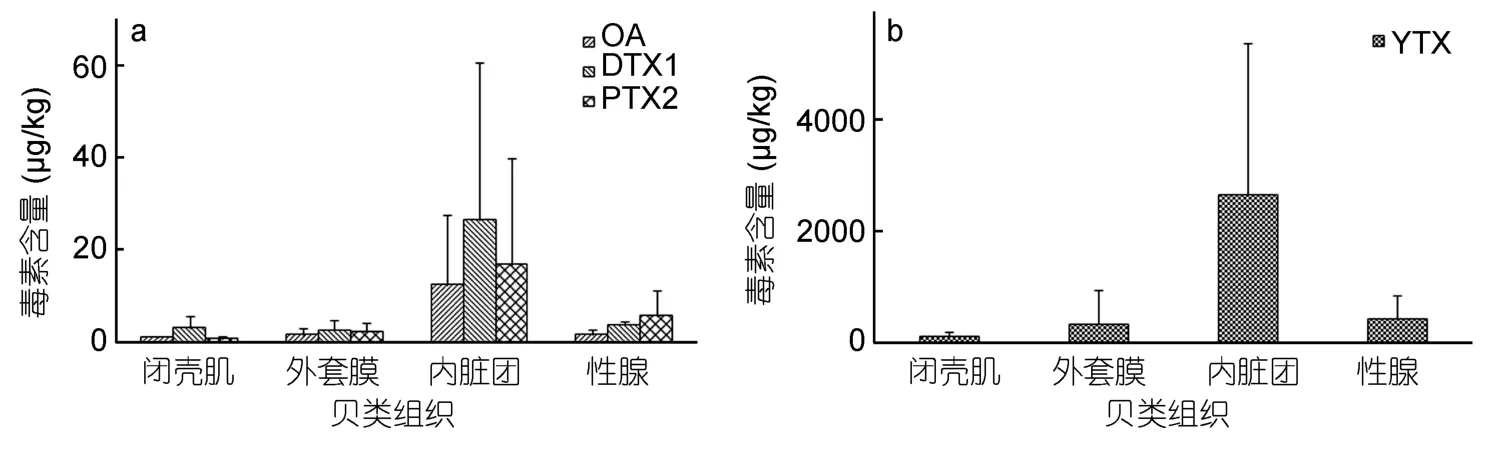
图3 虾夷扇贝各组织中的脂溶性毒素含量情况Fig.3 Content of lipophilic phycotoxin in different tissues of the scallops
3 讨论
3.1 北黄海虾夷扇贝体内的脂溶藻性毒素沾染状况
我国是一个贝类养殖大国,藻毒素沾染问题在我国沿海贝类中普遍存在。北黄海是我国重要的贝类养殖区,水产品食品安全状况同样受到藻毒素沾染的威胁。在以往研究中,通过小鼠生物测试法曾多次检测到有毒贝类样品。近年来,借助于液-质联用技术,不断有新的脂溶性毒素被发现,先后从北黄海海域的虾夷扇贝、海湾扇贝、栉孔扇贝、牡蛎等贝类样品中检测到了YTX、AZA1、PTX2和GYM等脂溶性毒素成分(高春蕾等,2010;姚建华等,2010a;Liuet al,2011;Liet al,2012a)。
在本研究中,应用高效液相色谱-质谱联用技术,在北黄海海域虾夷扇贝体内检测到了OA、DTX1、PTX2和YTX等四种毒素成分。应当指出的是,贝类样品中可能还存在这四种毒素的同系物。但是,受到检测能力和标准品的限制,本研究所采用的多类脂溶性毒素同步分析方法,没有对各种藻毒素的同系物进行逐一分析。因此,在后续研究中,仍有必要针对DTX、PTX和YTX等各类脂溶性毒素的同系物进行详细分析。
在检测到的各种脂溶性毒素中,YTX是主要的毒素成分。2010年,高春蕾等首次在北黄海采集的虾夷扇贝中检测到了YTX毒素成分(25—41µg/kg);2012年,李爱峰等人再次从采自大连海域的虾夷扇贝中检测到YTX(1578µg/kg)。本研究发现,虾夷扇贝内脏团中YTX含量最高可达6680µg/kg,是其他脂溶性毒素含量总和的6—194倍。综合这些结果可以看出,YTX应当是北黄海海域最为常见的脂溶性毒素成分。根据欧盟规定(Anonymous,2011),贝肉中脂溶性毒素YTXs含量不得超过1mg/kg,以此标准为参考,在所分析的几个扇贝样品中,大部分扇贝的内脏团中YTX含量超出标准,样品3外套膜中的YTX含量也超出了欧盟标准。可见,北黄海海域YTX毒素的沾染问题值得密切关注。
除YTX外,本研究还从虾夷扇贝中检测到了OA、DTX1和PTX2毒素。OA和DTX1是腹泻性贝毒的主要毒素成分,有促使肿瘤形成的作用;PTX2是一类大环聚醚化合物,有明显的肝脏毒性效应,也被称为肝损伤性贝毒。OA和DTX1类毒素在中国近海较为常见,在辽宁、天津、山东、江苏、浙江、福建、广东以及香港等地贝类中均有检出(Zhouet al,1999;傅云娜等,2003)。PTX2以往也曾经在烟台的栉孔扇贝(Chlamys farreri)、福建的蛤蜊(Mactra chinensis)及贻贝(Mytilus galloprovincialis)、大连海域的牡蛎(Crassostrea gigas)中检出(Liet al,2012a;Liuet al,2011;姚建华等,2010a)。其中,2012年采自福建宁德和浙江宁波两地贻贝(Mytilus galloprovincialis)中检出OA,DTX1和PTX2(147µg/kg),可能与两地发生的腹泻性贝毒中毒事件有关。在北黄海海域的贝类样品中,也曾多次检测到OA、DTX1和PTX2毒素(表1)。但是,在北黄海虾夷扇贝样品中,PTX2 是首次检测到。根据欧盟规定(Anonymous,2011),贝肉中脂溶性藻毒素OA、DTXs、PTXs的含量总和不得超过160 µg/kg,参照这一标准,扇贝样品3的内脏团中OA、DTXs和PTXs总含量(162µg/kg)已超过欧盟的食用安全标准。因此,对于贝类中的OA类和PTX类毒素,也应给予密切关注。
本文首次对北黄海虾夷扇贝各组织中脂溶性藻毒素的分布情况进行了研究,结果表明,虾夷扇贝各组织中脂溶性藻毒素的含量存在明显差异,在一定程度上反映出各组织对脂溶性毒素富集能力的差异。在各个组织中,内脏团的毒素含量最高,闭壳肌最低,各组织中脂溶性毒素含量依次为:内脏团>性腺>外套膜>闭壳肌。
3.2 虾夷扇贝中脂溶性毒素来源浅析
以往研究表明,贝类中的OA、DTX1和PTX2毒素主要来自于甲藻中鳍藻属和原甲藻属的有毒藻种,包括Dinophysis fortii、D.acuminata、D.acuta、D.norvegica、D.mitra、D.rotundata、D.triposs,以及Prorocentrum lima、P.maculosum、P.redfield等(杨维东等,2005)。其中,鳍藻属中D.fortii、D.acuta和D.acuminata是重要的产毒藻,在中国沿海也较为常见(王朝晖等,1998;张树林等,2003;王金辉等,2006;Liet al,2012a)。对本研究同时采集的浮游植物样品分析发现(详细数据未给出),北黄海海域鳍藻细胞丰度较高,最高达 3100 cells/L,鳍藻优势种是渐尖鳍藻(D.acuminate)和倒卵形鳍藻(D.fortii),都是潜在的产毒藻种。罗璇研究了胶州湾海域鳍藻的产毒状况,发现胶州湾的渐尖鳍藻能够产生OA、DTX1和PTX2毒素;倒卵形鳍藻和圆形鳍藻也都能够产生PTX2毒素,但产毒状况有明显差别(罗璇,2011)。因此,在北黄海海域贝类样品中的脂溶性毒素 OA、DTX1和 PTX2应主要来自该海域的有毒鳍藻。在研究中发现,不同站位的扇贝样品之间OA、DTX1和PTX2毒素组成有所差异,可能是由该海域产毒鳍藻的分布差异所致。除鳍藻之外,另外一种重要的产毒藻——利玛原甲藻(Prorocentrum lima)在我国近海也有发现。南海海域有观察到利马原甲藻的报道(王朝晖等,1998;Liet al,2012b),北黄海大连海域也发现有原甲藻的存在(张树林等,2003),但是否与虾夷扇贝中的脂溶性毒素有关,还需进一步研究。
YTXs是1987年Murata等人从虾夷扇贝体中发现的一类藻毒素,YTXs主要来源于网状原角藻、多边舌甲藻和具刺膝沟藻(Hesset al,2007)。但是,这三种甲藻并不是常见的赤潮藻种,在赤潮监测中常被人们忽视。北黄海海域的扇贝中检出YTX,说明该海域存在着相应的产毒藻种。2007年,中国海洋环境质量公报指出我国韭山列岛东部海域发生过具刺膝沟藻赤潮,此外,在黄渤海表层沉积物中曾发现网状原角藻、多边舌甲藻和具刺膝沟藻孢囊(高春蕾等,2010;邵红兵等,2012)。今后应加强对YTX产毒藻种的监测工作。
GYM毒素目前只在我国广东沿海的牡蛎(Crassostreagigas和C.ariakensis)中有检出(姚建华等,2010a;Liuet al,2011),AZA1毒素在采自广州的江珧(Atrinapectinata)和采自大连的栉孔扇贝(Chlamys farreri)中有检出(姚建华等,2010a),SPX1毒素仅在采自广州的牡蛎(Crassostrea gigas)中有检出(姚建华等,2010a),这些毒素的检出率和含量并不高,本研究并没有发现这些脂溶性藻毒素,这可能是因为北黄海海域不存在这些毒素的产毒藻种,也可能与各种藻毒素在不同贝类品种间的富集能力存在差异有关,例如牡蛎对GYM的富集能力高于其它贝类,栉江珧对AZA1的富集能力较强等(姚建华等,2010b)。
4 结论
本研究通过高效液相色谱-质谱联用法从北黄海海域虾夷扇贝的闭壳肌、外套膜、内脏团和性腺组织中检出了OA、DTX1、PTX2和YTX四种脂溶性毒素,未检出AZA1、SPX1和GYM毒素,其中从我国沿海虾夷扇贝中检测到PTX2系首次报道。毒素在四种组织中的含量由高到低依次为内脏团>性腺>外套膜>闭壳肌;不同组织间的毒素组成无明显差别,以YTX含量最高,占脂溶性毒素总含量的90%以上,部分扇贝样品内脏团中的YTX含量超过欧盟安全食用标准。与扇贝样品同期采集的浮游植物样品中鳍藻密度较高,有可能是扇贝样品中OA,DTX1和PTX2的潜在来源。为防范藻毒素对水产品消费者造成危害,应该加强对北黄海海域贝类中藻毒素及海水中有毒藻类的监测。
王金辉,秦玉涛,刘材材等,2006.长江口赤潮多发区潜在有毒藻类和赤潮毒素的初步调查.海洋环境科学,25(1):15—19
王朝晖,吕颂辉,陈菊芳等,1998.广东沿海几种赤潮生物的分类学研究.武汉植物学研究,16(4):310—314
刘仁沿,高春蕾,梁玉波等,2008.Gymnodimine,首次在我国北海缘齿牡蛎中发现的一种腹泻性贝毒组分.海洋学报,30(6):171—176
杨 莉,杨维东,刘洁生等,2006.广州市售贝类麻痹性贝毒和腹泻性贝毒污染状况分析.卫生研究,(4):435—439
杨维东,彭喜春,刘洁生等,2005.腹泻性贝毒研究现状.海洋科学,29(5):66—72
张树刚,邹 清,陈 雷等,2011.浙南海域腹泻性贝毒分析.海洋科学,35(1):44—47
张树林,赵 晖,2003.大连湾春秋季浮游植物的调查研究.海洋科学,27(2):45—48
邵红兵,石雅君,刘东艳,2012.北黄海中部及四十里湾海域甲藻孢囊种类多样性研究.海洋通报,31(5):557—565
罗 璇,2011.青岛近海鳍藻种群动态与产毒特征研究.青岛:中国科学院研究生院(海洋研究所)博士学位论文
姚建华,谭志军,周德庆,2010a.液相色谱-串联质谱检测贝类组织中5种脂溶性贝毒素.分析化学,38(12):1714—1720
姚建华,谭志军,周德庆等,2010b.液相色谱-串联质谱法检测贝类产品中的原多甲藻酸贝类毒素.色谱,28(4):363—367
高春蕾,刘仁沿,梁玉波等,2010.虾夷扇贝毒素 yessotoxins(YTXs),中国沿海贝类中首次发现的一组贝类生物毒素.海洋学报,3:129—137
傅云娜,陈则玲,2003.腹泻性贝毒的高效液相色谱法测定条件改进及其运用.海洋通报,22(1):92—95
雷 芳,2009.深圳市售贝类麻痹性贝类毒素和腹泻性贝类毒素污染状况研究.广州:暨南大学硕士学位论文
Anonymous,2011.Commission Regulation(EU)No 15/2011 of 10 January 2011 amending Regulation(EC)No 2074/2005 as regards recognised testing methods for detecting marine biotoxins in live bivalve molluscs.Official Journal of the European Union,L6:3—6
Creppy E E,Traore A,Baudrimont Iet al,2002.Recent advances in the study of epigenetic effects induced by the phycotoxin okadaic acid.Toxicology,181:433—439
Daranas A H,Norte M,Fernandez J J,2001.Toxic marine microalgae.Toxicon,39:1101—1132
Dragunow M,Trzoss M,Brimble M Aet al,2005.Investigations into the cellular actions of the shellfish toxin gymnodimine and analogues.Environmental Toxicology and PHarmacology,20(2):305—312
Fux E,McMillan D,Bire Ret al,2007.Development of an ultra-performance liquid chromatography-mass spectrometry method for the detection of lipophilic marine toxins.Journal of Chromatography A,1157(1—2):273—280
Gerssen A,Mulder P P,McElhinney M Aet al,2009.Liquid chromatography–tandem mass spectrometry method for the detection of marine lipophilic toxins under alkaline conditions.Journal of Chromatography A,1216(9):1421—1430
Hallegraeff G M,1993.A review of harmful algal blooms and their apparent global increase.Phycologia,32(2):79—99
Hess P,Aasen J,2007.Chemistry,origins,and distribution of yessotoxin and its analogues.In:Botana L M ed.Phycotoxins:chemistry and origins.Blackwell Publishing,Oxford,187—202
Ito E,Satake M,Ofuji Ket al,2002.Chronic effects in mice caused by oral administration of sublethal doses of azaspiracid,a new marine toxin isolated from mussels.Toxicon,40(2):193—203
Li A F,Ma J G,Cao J Jet al,2012a.Toxins in mussels(Mytilus galloprovincialis)associated with diarrhetic shellfish poisoning episodes in China.Toxicon,60(3):420—425
Li J,Li M Y,Pan J Yet al,2012b.Identification of the okadaic acid-based toxin profile of a marine dinoflagellate strainProrocentrum limaby LC-MS/MS and NMR spectroscopic data.Journal of Separation Sciences,35(7):782—789
Li Z X,Guo M M,Yang S Get al,2010.Investigation of pectenotoxin profiles in the Yellow Sea(China)using a passive sampling technique.Marine Drugs,8(4):1263—1272
Liu R Y,Liang Y B,Wu X Let al,2011.First report on the detection of pectenotoxin groups in Chinese shellfish by LC-MS/MS.Toxicon,57(7—8):1000—1007
Picot C,Thuan A N,Carpentier F Get al,2011.Relevant shellfish consumption data for dietary exposure assessment among high shellfish consumers,Western Brittany,France.International Journal of Environmental Health Research,21(2):86—105
Quilliam M A,2003.The role of chromatography in the hunt for red tide toxins.Journal of Chromatography A,1000(1—2):527—548
Shumway S E,1990.A review of the effects of algal blooms on shellfish and aquaculture.Journal of the World Aquaculture Society,21(2):65—104
Stobo L A,Lacaze J,Scott A Cet al,2005.Liquid chromatography with mass spectrometry——Detection of lipophilic shellfish toxins.Journal of AOAC International,88(5):1371—1382
Toyofuku H,2006.Joint FAO/WHO/IOC activities to provide scientific advice on marine biotoxins(research report).Mrine Pollution Bulletin,52(12):1735—1745
Zhou M J,Li J,Luckas Bet al,1999.A recent shellfish toxin investigation in China.Marine Pollution Bulletin,39(1):331—334

