头孢拉定、诺氟沙星及罗红霉素在中华鳖(Pelodiscus sinensis)日本品系体内残留代谢的比较研究*
何 欣 张海琪 戴志远① 王 扬 李诗言
(1.浙江工商大学食品与生物工程学院 杭州 310035;2.浙江省水产质量检测中心 杭州 310012)
中华鳖(Pelodiscus sinensis)属于龟鳖目(Testudinata)、鳖科(Trionychidae)、鳖属(Pelodiscus),是我国重要的水产养殖品种,2012年产量为33.1万t。目前大陆养殖中华鳖的种类主要包括国家水产新品种中华鳖日本品系、清溪乌鳖,本地种中华鳖太湖群体、黄河群体、广西群体、江西群体,引进种台湾群体、泰国群体以及杂交种,以中华鳖日本品系养殖为最多。中华鳖日本品系的养殖模式主要包括温室养殖、外塘养殖、两段法养殖、稻鳖共生、虾鳖混养等,以两段法养殖最为普遍,经 7—8个月温室养殖和 4个月的外塘养殖,平均规格在0.75kg以上。随着中华鳖日本品系的养殖推广,种质管理不严,相互引种混杂导致其优良性能降低,尤其是在人为控温、高密度集约化的温室养殖环境下,一些养民为追求高产加大了苗种放养密度,受空间制约、管理水平及水质恶化等影响,其养殖病害时有发生,迫使其使用一些抗生素进行病害的有效治疗和预防。已有报道在中华鳖养殖中使用的渔药有庆大霉素、氨卞青霉素、新霉素、土霉素、四环素、链霉素、磺胺类药物、头孢拉定、诺氟沙星、罗红霉素等(孙红祥等,2000;黄钧等,2008;谭爱萍等,2011;冷闯等,2012;朱凝瑜等,2013)。这些渔药的使用虽可在短期内起到很明显的疗效,但会引起病原的抗药性,为下一次疾病治疗埋下隐患;还会导致其在养殖生物体内的积累,进而以食物的途径进入人体,影响消费安全。虽然大多渔药的半衰期不长,但由于频繁使用并进入环境,其引起的环境污染及其可能导致的生态风险已成为国内外关注的热点环境问题之一。通过渔药代谢的研究,不仅可以了解渔药在中华鳖日本品系体内的代谢特征,还可以获得渔药在中华鳖体内的残留状况,为其合理应用和食用安全提供理论依据。
渔药的代谢受品种、温度、给药方式等因素的影响,因此不同药物及同种药物在不同生物体内的残留代谢不尽相同(湛嘉等,2003)。中华鳖具有独特的水陆两栖生活习性,有别于鱼虾等水产动物,也有别于其他陆生生物,其药物残留代谢有其自身的特点,不能用鱼虾等其它水生动物体内的药动学规律来套用。目前有关中华鳖体内药物代谢规律的研究已有一些报道,涉及的药物主要有:氟苯尼考(朱丽敏等,2006;张海琪等,2013b)、诺氟沙星(陈文银等,1997;周辉明等,2009;朱秋华等,2001)、磺胺甲基异恶唑(尹文林等,2004b)、红霉素(尹文林等,2004a)等,与其他的水产品种相比研究偏少。头孢拉定属于β-内酰胺类抗生素,已有在兔(李忠思等,2005)、羊(黄伟雄等,2000)、鼠(吴桂月等,2001)等动物体内的药动学研究报道,而水产动物体内尚未见有报道。诺氟沙星为喹诺酮类渔药,已有一次口灌、一次注射、连续注射及一次拌饵口服等不同给药方式在中华鳖体内的代谢研究(陈文银等,1997;朱秋华等,2001;潘连德等,2005;周辉明等,2009),但未见有连续多次拌饵给药方式下中华鳖体内的代谢研究报道。罗红霉素属于大环内酯类抗生素,是红霉素经过修饰,即9位成肟衍生物的产物(Chantotet al,1986),其在人体中的消除半衰期为12.69h(秦玉花等,2003),在家犬体内罗红霉素消除半衰期为19.50h(唐星等,2003),未见有其在水产动物中的药代研究报道。本试验将头孢拉定、诺氟沙星、罗红霉素添加到饲料中制作成药饵口服给药,并应用液相色谱-串联质谱(HPLC-MS/MS)分别测定分析中华鳖日本品系在连续 7d给药后各组织中头孢拉定、诺氟沙星、罗红霉素的残留变化规律,为三种药物的安全合理用药及休药期的制定提供科学依据。
1 材料与方法
1.1 主要仪器与试剂
渔药浓度测定用仪器为API 4000型高效液相色谱-三重四极杆串联质谱仪。标准物质头孢拉定纯度大于 91.8%,诺氟沙星纯度大于 97.8%,罗红霉素纯度大于96.5%。渔药头孢拉定(上海新先锋药业有限公司),诺氟沙星(宁波四明制药有限公司),罗红霉素(康普药业股份有限公司)。
1.2 实验动物
实验动物采用中华鳖日本品系,来自杭州某生物科技有限公司,取中华鳖日本品系450只,体重为(250±50)g,体质健壮,随机分为三组,每组 150只,分别放养在大棚控温水泥池中。试验前驯养7d,经抽样测定头孢拉定、诺氟沙星或罗红霉素残留均未检出,然后开始给药实验。
1.3 给药方法
分别制作头孢拉定浓度30mg/kg,诺氟沙星浓度300mg/kg及罗红霉素浓度 30mg/kg的配合饲料。在(25±2)°C水温下,分别连续7d投喂大棚控温水泥池中养殖的中华鳖日本品系,日投喂药饵量为体重的1%—2%。每天8:00时和16:00时各投喂一次,投放于食台上,以30min之内摄食结束为止。
1.4 样品采集与浓度测定
自最后一次投喂之后按 1h、2h、4h、8h、16h、24h、48h、72h、120h、144h、168h、240h 和 360h进行取样,每次分别从三个养殖池塘中随机各抽取9只,以3只中华鳖的混合组织为一组,3个平行,取血液于肝素化处理过的离心管中,取肝脏、肌肉组织分别保存于无菌的采样袋中,20°C冰箱保存待测定。分别参照《GB/T 22960-2008河豚鱼和鳗鱼中头孢唑啉、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定 液相色谱-串联质谱法》(中华人民共和国国家质量监督检验检疫总局,2008)、《农业部783号公告-2-2006水产品中诺氟沙星、盐酸环丙沙星、恩诺沙星残留量的测定-液相色谱法》(中华人民共和国农业部,2006)和《SN/T 1777.2-2007动物源性食品中大环内酯类抗生素残留测定方法 第2部分:高效液相色谱串联质谱法》(中华人民共和国国家质量监督检验检疫总局,2007)进行中华鳖组织中头孢拉定、诺氟沙星和罗红霉素残留浓度测定。采用加标回收和精密度评价检测方法。
1.5 数据分析
采用药代动力学 3p97软件进行数据处理,得出药动学参数,建立相关方程。
2 结果与分析
2.1 液相色谱-串联质谱方法学评价
根据头孢拉定、诺氟沙星和罗红霉素的理化性质和分子量,通过一级质谱 Q1扫描获得母离子峰,再进行二级质谱 Q2扫描,得到碎片离子信息,分别筛选两个离子强度较高的离子与母离子组建成MRM离子对,然后优化去簇电压(declustering potential,DP)、碰撞能量(collision energy,CE)、离子喷雾电压(ion spray voltage,IS)、离子源温度(ion source temperature,TEM)、碰撞气(Collision-Activated Dissociation,CAD)、射入电压(entrance potential,EP)、射出电压(collision cell exit potential,CXP)等质谱参数。三种药物优化后的部分质谱条件如表1所示。色谱柱为 ACQUITY UPLC BEN Shield RP18分析柱(50mm×2.1mm,1.7μm);流动相为:乙腈–0.1%甲酸水溶液。以空白基质样品分别添加 1、2、4μg/kg 头孢拉定,100、200、400μg/kg的诺氟沙星和5、10、20μg/kg的罗红霉素,采用上述建立的液相色谱串联质谱方法进行方法学的评价,回收率等结果如表2所示。由表2可见,与以往大多药物代谢动力学研究所采用的液相色谱法相比,液相色谱-串联质谱法更具快速、准确、灵敏等优势,是一种适宜的药物代谢动力学研究手段。

表1 三种药物优化后的部分质谱条件Tab.1 MS conditions after optimization of three drugs

表2 三种药物的液相色谱-串联质谱的方法学评价(n=6)Tab.2 The methodological evaluation of the determination of three drugs by HPLC-MS/MS(n=6)

表3 头孢拉定、诺氟沙星和罗红霉素在中华鳖各组织中的浓度(μg/kg)Tab.3 Concentrations of cefradine,norfloxacin and roxithromycin in different tissues from soft-shelled turtles(μg/kg)
2.2 各组织中渔药残留浓度变化情况
经过对中华鳖日本品系中三种药物不同时间点残留的检测,头孢拉定、诺氟沙星和罗红霉素在中华鳖各组织中的浓度如表3所示。头孢拉定在肝脏和肌肉组织中均在2h时出现最高峰,浓度分别为15.9μg/kg和5.05μg/kg,随着时间推移,渔药浓度逐渐下降,直至96h时不再测及。在血液中出现了双峰,分别在2h和8h时,浓度分别为6.00μg/kg和6.93μg/kg。诺氟沙星在血液、肝脏和肌肉组织中均在 4h出现最高峰,浓度分别为 121.8μg/kg、371μg/kg和 35.61μg/kg。随着时间推移,浓度逐渐下降。血液和肌肉中分别于168h和 360h时不再有检出,而在肝脏中至 360h仍能检出。罗红霉素2h在血液中达到最高浓度19.03μg/kg,随后逐步下降,至 144h未有检出。而在肝脏和肌肉中则出现了双峰现象,最高峰的浓度分别为8.252μg/kg和 13.983μg/kg。
2.3 药动学参数的计算
通过药动学 3P97分析软件,分别计算了头孢拉定、诺氟沙星和罗红霉素在中华鳖血液,肝脏和肌肉中的药动学参数。经过分析,以Akaike Information Criterion法(AIC信息准则)作为评判标准,头孢拉定和诺氟沙星在中华鳖血液,肝脏和肌肉中的代谢符合一室消除模型。罗红霉素在中华鳖血液,肝脏和肌肉中的代谢符合二室消除模型。三种药物在中华鳖日本品系组织中的药动学参数如表4、表5、表6所示。

表4 头孢拉定在中华鳖日本品系三种不同组织中的药动学参数Tab.4 Pharmacokinetic parameters of cefradine in three different tissues from soft-shelled turtles Japanese strain
头孢拉定中C血液= 11.69×e-0.1130t,R2=0.9316;C肝脏=20.16×e-0.0684t,R2=0.9691;C肌肉= 3.599×e-0.0770t,R2=0.9061;诺氟沙星中C血液= 129.21×e-0.0308t,R2=0.9267;C肝脏= 409.6×e-0.0167t,R2=0.9996;C肌肉= 31.24×e-0.0179t,R2=0.9486;罗红霉素中C血液= 40.21×e-0.8514t+1.471×e-0.1798t,R2=0.9884;C肌肉= 3.349×e-0.0816t+5.358×e-0.04430t,R2=0.9342;C肝脏= 4.942×e-0.07221t+0.7362×e-0.006898t,R2=0.9396。头孢拉定在中华鳖日本品系血液、肌肉和肝脏中消除半衰期T1/2(Ke)分别为6.132h、9.002h和 10.132h。诺氟沙星在中华鳖日本品系血液、肌肉和肝脏中消除半衰期T1/2(Ke)分别为22.526h、39.715h和 41.585h。罗红霉素在中华鳖日本品系血液、肌肉和肝脏中消除半衰期T1/2(β)分别为38.54h、15.65h和100.5h。

表5 诺氟沙星在中华鳖日本品系三种不同组织中的药动学参数Tab.5 Pharmacokinetic parameters of norfloxacin in three different tissues from soft-shelled turtles Japanese strain
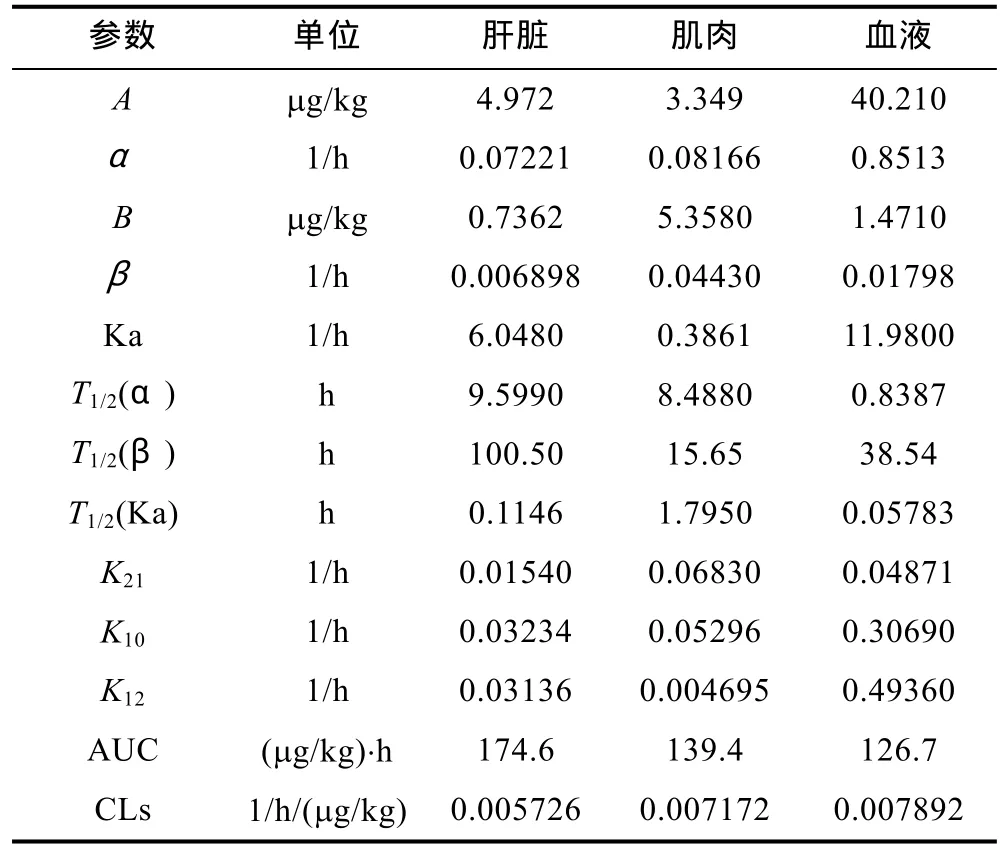
表6 罗红霉素在中华鳖日本品系三种不同组织中的药动学参数Tab.6 Pharmacokinetic parameters of roxithromycin in three different tissues from soft-shelled turtles Japanese strain
3 讨论
3.1 药时曲线中多峰现象的讨论
本次实验中华鳖经过连续7d投喂三种药物之后,其中头孢拉定和罗红霉素的药-时曲线中出现了双峰的现象。该现象也存在于不少药动学研究中,如给家兔灌胃阿司匹林肠溶片后,受试动物的药时曲线均有双峰现象(谈恒山等,1994)。目前有关多峰的产生大致有两种可能的机制:一是由于药物在胃肠道中存在的不同部位有多个吸收位点,口服后在不同部位的吸收时间和吸收速率产生了不一致,被吸收的药物在血液中叠加形成双峰或多峰现象;二是药物的肝肠循环作用,即药物在肠道被重吸收所导致(Manishet al,2003;魏凤环等,2005)。
3.2 三种药物在中华鳖日本品系体内不同组织的消除半衰期规律的探讨
本试验选用头孢拉定、诺氟沙星和罗红霉素进行连续给药 7d拌饵投喂的方式给药,从三种药物在中华鳖日本品系体内的半衰期来看,头孢拉定在中华鳖日本品系血液、肝脏和肌肉中消除半衰期分别为6.132h、10.132h和9.002h,时间最短。诺氟沙星在血液、肝脏和肌肉中的消除半衰期分别是 22.526h、41.585h和39.715h。罗红霉素在血液、肌肉和肝脏中的消除半衰期分别为38.54h、15.65h和100.5h,时间最长。罗红霉素的蛋白结合率高达90%—95%,有较强的渗透能力,呼吸道及血液内的浓度高,能够穿透并能进入吞噬细胞内(单靖珊,1999),主要由胆汁与粪便排除体外,尿排出量很少(陈强,1994)。诺氟沙星的口服后约35%—45%的给药量可被吸收,蛋白结合率为14%(李海滨等,1997),排泄主要通过肾脏,其次通过肝脏消除(曾振灵等,1992)。而头孢拉定除了在体内的转化外,原药几乎全部从肾脏中排除(张志林等,1989)。因此体内的蛋白结合率与原药排泄的途径是影响药物在动物体内消除半衰期的重要因素之一。
与其他研究相比,头孢拉定在中华鳖血液中的半衰期远长于人血液中的1.13h(石焱等,2009)、老鼠血液中的 145.65min(梁骏,2008)和鸡血液中的65.493min(杜云良等,2010)。有学者认为导致种属间差异的原因包括某种酶的有无或活性的差别,以及血浆蛋白结合率,靶器官结合率等(邹文等,2007)。此外,温度的不同也是重要因素,本实验中采用的水温是(25±2)°C,中华鳖体内温度远低于鸡的 41.5—43.0°C、人和老鼠的35—38.5°C的正常体温,因此半衰期相对要长一些。本实验在(25±2)°C的水温下,诺氟沙星采用连续给药 7d的给药方式,在中华鳖日本品系血液中至144h时不再有检出,肌肉在240h仍能检出,而肝脏则在 360h时仍然能检出残留,结果与以往研究结果相似,如潘连德等(2005)研究表明,经单次口服灌胃给药,患病和健康的中华鳖血液中的诺氟沙星适合于一室消除模型,其消除半衰期分别为 17.279h和 45.112h;朱秋华等(2001)在 30°C的水温中以3种水平混入饲料中投喂中华鳖,其血液中的诺氟沙星在120h时仍能检出残留,直到240h才未检出。肌肉组织中可达到相对较高水平,在停药后肌肉中药物残留量较高,直到240h排出75.8%。在生产实践中,诺氟沙星大多采用多次拌饵的给药方式进行,因此本结果更具应用性。本实验中罗红霉素(25±2)°C下在中华鳖日本品系血液、肌肉和肝脏中的消除半衰期分别为38.54h,比人体血液的12.69h和家犬体内的 19.50h要高,也比红霉素在中华鳖中的消除半衰期要长(尹文林等,2004a),因此罗红霉素作为渔药使用,需要更长的休药期。
3.3 渔药残留监控组织的选择
不同的渔药在水产动物体内各组织中的残留持久性不尽相同,因此对水产品质量安全监控提出不同的要求。目前,我国允许诺氟沙星作为渔药使用,其在水产品中的限量标准(MRL)为50μg/kg(《NY5070-2001无公害食品 水产品中渔药残留限量》)。2005年中华人民共和国农业部第 560号公告将罗红霉素和头孢拉定列为抗生素、合成抗菌药及农药类范畴(中华人民共和国农业部,2006),至今未有相关限量标准。罗红霉素和红霉素都属于大环内酯类抗生素,红霉素属于无公害标准的禁用渔药,由于罗红霉素的结构和治疗功效与其相似,因此罗红霉素是替代红霉素的首选渔药。通过罗红霉素于红霉素在中华鳖组织中的代谢情况的分析,罗红霉素比红霉素的消除半衰期更长,需要更长的休药期方能上市。在以往的水产品质量安全残留监控中,全部采用肌肉组织作为监控组织。但从本文的三种药物以及本实验室以往报道的氟甲喹的结果来看(张海琪等,2013a),肝脏组织的浓度要远高于肌肉组织。肝脏器官作为代谢场所,除了通过肾脏以原型药物排出体外之外,渔药在体内的转化必须要通过的细胞色素P450酶系在肝脏中的含量最丰富(Slaughteret al,1995),因此肝脏组织浓度普遍高于其它组织。在人们对水产品质量安全要求越来越高的背景下,建议在残留监控时,选择肝脏组织进行分析。
中华人民共和国农业部,2006.水产品中诺氟沙星、盐酸环丙沙星、恩诺沙星残留量的测定——液相色谱法.北京:中国标准出版社,1—3
中华人民共和国国家质量监督检验检疫总局,2007.动物源性食品中大环内酯类抗生素残留测定方法 第 2部分:高效液相色谱串联质谱法.北京:中国标准出版社,1—4
中华人民共和国国家质量监督检验检疫总局,2008.河豚鱼和鳗鱼中头孢唑啉、头孢匹林、头孢氨苄、头孢洛宁、头孢喹肟残留量的测定.液相色谱-串联质谱法.北京:中国标准出版社,1—4
尹文林,沈锦玉,钱 冬等,2004a.红霉素在中华鳖体内的药代动力学及中长期残留的研究.水产学报,12(28):69—72
尹文林,沈锦玉,钱 冬等,2004b.磺胺甲基异恶唑在中华鳖体内药代动力学及残留研究.水产学报,12(28):58—62
石 焱,弓小雪,张 洋等,2009.头孢拉定胶囊人体药代动力学和生物等效性.临床军医杂志,37(6):1097—1099
朱丽敏,杨先乐,林启存等,2006.肌注和口服氟苯尼考在中华鳖体内残留分析及药代动力学.水产学报,8(30):515—519
朱秋华,钱国英,2001.3种药物在甲鱼体内的残留研究.中国水产科学,8(3):50—53
朱凝瑜,孔 蕾,贝亦江等,2013.中华鳖迟缓爱德华氏菌的分离鉴定与致病性研究.海南:中国水产学会鱼病专业委员会2013年学术研讨会论文摘要汇编,184
孙红祥,舒妙安,2000.中华鳖溶血性腹水病病原菌的分离鉴定及药敏性研究.浙江大学学报(农业与生命科学版),26(2):177—180
杜云良,刘彦威,韩 博等,2010.鸡单剂量口服头孢拉定的药代动力学研究.江苏农业科学,(2):232—233
李忠思,张小娜,陈 方等,2005.HPLC法测定头孢硫脒大鼠体内分布浓度及其药动学研究.中国抗生素杂志,30(10):611—616
李海滨,林美清,1997.诺氟沙星的临床药理.云南民族学院学报(自然科学版),6(1):73—75
吴桂月,孙成春,董玉波等,2001.硫酸头孢噻利在兔体内的药动学研究.中国药房,22(1):24—26
邹 文,周 文,2007.药物代谢的种属和性别差异研究.齐鲁药事,26(12):735—737
冷 闯,邓舜洲,张文波等,2012.中华鳖致病性嗜水气单胞菌的分离鉴定及药敏试验.动物医学进展,33(2):124—129
张志林,朱天痒,1989.头抱拉定的药理和临床.新药与临床,8(5):271—275
张海琪,何 欣,钱鸣蓉等,2013a.氟甲喹在中华鳖日本品系组织中的残留代谢规律研究.西南大学学报(自然科学版),35(9):36—42
张海琪,林 静,黎 飞等,2013b.中华鳖日本品系体内氟苯尼考药物代谢动力学研究.动物学杂志,48(3):465—473
陈 强,1994.大环内酯类抗生素的临床评价.上海医药情报研究,35(4):13—17
陈文银,印春华,1997.诺氟沙星在中华鳖体内的药代动力学研究.水产学报,12(21):434—437
周辉明,张爱芳,吴志强,2009.两种抗生素在甲鱼组织中的残留研究.江西水产科技,(3):23—26
单靖珊,1999.罗红霉素药理作用特点.河北医药,21(1):44
秦玉花,赵红卫,丁祖锐等,2003.罗红霉素胶囊剂药代动力学及相对生物利用度的研究.数理医药学杂志,(16):149—150
唐 星,张 倩,邵瑞莹等,2003.罗红霉素缓释胶囊在家犬体内的药动学及相对生物利用度.沈阳药科大学学报,11(20):391—394
谈恒山,姚 斌,顾培德,1994.阿司匹林药-时曲线的双峰研究.中国药理学通报,10(5):387
黄 钧,朱 芸,韦友传,2008.中华鳖“浮肿病”致病菌的分离与鉴定.广西畜牧兽医,24(6):375—376
黄伟雄,宋国维,甘小庄等,2000.羊的膜肺过程对头孢拉定药代动力学的影响.基础医学与临床,20(5):82—84
梁 骏,2008.头孢拉定在糖尿病大鼠和正常大鼠体内药代动力学的比较性研究.大连:大连医科大学硕士学位论文,22
曾振灵,冯淇辉,1992.兽用氟喹诺酮类药物研究与临床应用进展.中国兽医科技,25(3):39—41
湛 嘉,李佐卿,康继韬等,2003.影响水产动物药代动力学的因素.中国兽药杂志,37(12):38—41
谭爱萍,赵 飞,姜 兰等,2011.中华鳖致病性蜡样芽孢杆菌的分离鉴定与特性分析.广东农业科学,(20):115—119
潘连德,石张东,邓华美等,2005.中华鳖对诺氟沙星的代谢动力学研究.上海:中国水产学会鱼病学专业委员会第六次委员大会暨国际学术讨论会论文(摘要)集,236—243
魏凤环,王永刚,罗佳波,2005.药动学多峰现象研究概况.中国药学杂志,(23):1772—1774
Chantot J F,Bryskier A,Gasc J C,1986.Antibacterial activity of roxithromycin:a laboratory evaluation.J Antibiot,39(5):660—668
Manish I,Shio K S,Bhrameshwar Met al,2003.Pharmacokinetics,in-situ absorption and protein binding studies of a new neuroleptic agent centbutindole in rats.Eur J Pham Sci,(19):105
Slaughter R L,Edwards D J,1995.Recent advances:the cytochrome P450 enzymes.Ann Pharmacother,29(6):619—624

