液相色谱-质谱法和高效液相色谱法定性定量测定籽瓜中的L-瓜氨酸
席冬华,李维霞,高 晶,阿塔吾拉·铁木尔,李 玲,吴 斌,*
(1.新疆大学化学化工学院,新疆 乌鲁木齐 830046;2.新疆大学理化测试中心,新疆 乌鲁木齐 830046;3.新疆农业科学院农产品贮藏加工研究所,新疆 乌鲁木齐 830091)
液相色谱-质谱法和高效液相色谱法定性定量测定籽瓜中的L-瓜氨酸
席冬华1,李维霞1,高 晶2,阿塔吾拉·铁木尔3,李 玲1,吴 斌3,*
(1.新疆大学化学化工学院,新疆 乌鲁木齐 830046;2.新疆大学理化测试中心,新疆 乌鲁木齐 830046;3.新疆农业科学院农产品贮藏加工研究所,新疆 乌鲁木齐 830091)
建立一种非衍生化样品前处理的液相色谱-质谱和高效液相色谱方法,对籽瓜中的L-瓜氨酸进行定性、定量分析,通过单因素试验和正交试验优化提取条件。液相色谱-质谱条件:Acuity C18(50 mm×2.1 mm,1.7 μm)色谱柱;流动相:10%乙腈和90%甲醇溶液(甲醇-水体积比1∶1);流速0.2 mL/min;柱温:40 ℃;进样量10 μL。在电喷雾离子源正模式、多反应监测扫描方式下分析,L-瓜氨酸的定性离子对为m/z 176.09/158.9,m/z 176.09/112.9,定量离子对为m/z 176.09/158.9。高效液相色谱条件:Platisil ODS C18(250 mm×4.6 mm,5 μm)色谱柱,以0.03 mmol/L磷酸为流动相,流速0.7 mL/min,柱温30 ℃,检测波长202 nm。结果表明:L-瓜氨酸标准品在0.5~100 μg/mL范围内线性关系良好(R2=0.999 9),平均回收率在95.12%~104.21%之间,相对标准偏差为1.86%~4.75%(n=3)。籽瓜中含有丰富的L-瓜氨酸,本方法测得籽瓜样品中L-瓜氨酸的平均含量为0.656~2.563 mg/g。
籽瓜;L-瓜氨酸;非衍生化;液相色谱-质谱法;高效液相色谱法
瓜氨酸名称来源于西瓜的拉丁名Citrullus vulgaris,是首先从西瓜汁中发现的人体内非蛋白质α-氨基酸,它具有肽键形成的能力,但是不参与蛋白质的合成,与大多数氨基酸构像一样为L型,故又称为L-瓜氨酸[1]。L-瓜氨酸具有防治前列腺疾病,提高男性性功能、抗衰老、增强免疫力、保持胆固醇正常、诊断类风湿性关节炎、维护关节运动技能、平衡正常的血糖水平、提高脑力清晰度、护肤祛斑等功效[2]。L-瓜氨酸可以通过化学合成[3]、发 酵法、酶法合成[4]和天然产物分离提取[5-6]等方法获得。化学合成L-瓜氨酸的方法存在产品纯度不够和环境危害,应用受到限制;发酵法生产的难点在于单位体积L-瓜氨酸产率低,最高仅为1.7 g/L,成本较高[7];酶法合成L-瓜氨酸产物浓度高,但是转化率较低,同时会产生杂酶, 影响瓜氨酸的生产;而天然产物中分离的L-瓜氨酸纯度较好,具有绿色、无毒副作用等特点倍受青睐。西瓜、天花粉和栝楼根中含有L-瓜氨酸[8-9],但受到原料来源有限和含量不高制约,生产规模较小。因此找到一种广泛生长的富含L-瓜氨酸的植物也是一种很好的研究方向[2]。
目前,分析L-瓜氨酸的方法主要有阿氏法[10]、薄层色谱法[11]、酶法[12]、分光光度法[6,13]、高效液相色谱(high performance liquid chromatography,HPLC)法[14-16]、气相色谱-质谱法[17]和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS-MS)法[18-19]等。由于L-瓜氨酸具有高的亲水特性和弱的紫外吸收,大多数研究报道的分析方法均需要衍生,衍生过程较复杂,衍生试剂毒性较高。因此建立一种非衍生化分析检测L-瓜氨酸的方法成为近年来研究方向之一。
籽瓜(又称打瓜)是葫芦科西瓜属普通西瓜的栽培变种,一种极具地域特色的农产品,籽瓜主要产于中国,新疆是中国籽瓜最大的产区。目前,对籽瓜的利用只有取籽加工,其余约占瓜质量95%以上的部分都作为废物而被丢弃[20],造成极大的资源浪费。本实验建立一种非衍生化的前处理LC-MS-MS法对籽瓜中L-瓜氨酸做了定性分析,以及HPLC方法快速简便测定籽瓜中L-瓜氨酸含量,为籽瓜功能性成分研究和籽瓜资源的深加工提供了理论依据,也为植物源L-瓜氨酸的研究与应用提供新的原料来源。
1 材料与方法
1.1 材料与试剂
不同籽瓜品种材料来源见表1;L-瓜氨酸标准品(纯度≥98%) 中国食品药品检定研究院;甲醇、乙腈(均为色谱纯) 霍尼韦尔贸易有限公司;磷酸、甲醇(均为分析纯) 天津市福晨化学试剂厂。实验室用水均为高纯水(≥18 MΩ·cm)。

表1 不同品种籽瓜材料Table 1 Different seeding watermelon cultivars
1.2 仪器与设备
1260 HPLC仪(配有可变波长紫外检测器、示差折光检测器和EZChrom Elite工作站) 美国安捷伦公司;Platisil ODS C18(250 mm×4.6 mm,5 μm)色谱柱北京迪马科技有限公司;Quattro Premier LC-MS-MS联用仪(配有电喷雾离子源和MassLynx4.1软件操作系统) 美国Waters公司;UV-2600紫外-可见分光光度计日本岛津公司;DZG-303A“艾柯”实验室专用超纯水仪成都唐氏康宁科技发展有限公司;Anke GL-20G-Ⅱ型高速冷冻离心机 上海安亭科学仪器厂;IKA®A 11基本型研磨机 广州仪科实验室技术有限公司;LGJ-10冷冻干燥机 北京松源华兴科技发展有限公司;SK720H型超声波清洗器 上海科导超声仪器有限公司。
1.3 方法
1.3.1 样品前处理
将籽瓜清洗去籽,去表皮,分离瓜心、瓜瓤和瓜皮,冷冻,粉碎,保存在-80 ℃冰箱待用。称取1.0 g籽瓜样品,精确至0.01 g,置于50 mL离心管,加入40 mL提取剂(甲醇-1 mol/L盐酸(9∶1,V/V))摇匀后,超声提取30 min,加入8 mL 0.5 mol/L的氢氧化钠溶液调节pH值,用滤纸过滤,12 000 r/min离心20 min,取上清液用0.22 μm有机滤膜过滤,待测。
1.3.2 标准溶液的配制
精确称取0.020 0 g L-瓜氨酸标准品,用50%甲醇溶液溶解定容至100 mL,该储备液质量浓度为200 μg/mL,再依次配制成0.5、1.0、5.0、10、20、50、100 μg/mL一系列不同质量浓度的标准工作溶液。
1.3.3 液相色谱-质谱分析条件
色谱条件:Acuity C18(50 mm×2.1 mm,1.7 μm);流动相:10%乙腈和90%甲醇溶液(甲醇-水(1∶1,V/V));流速0.2 mL/min;柱温:40 ℃;进样量10 μL。
质谱条件:毛细管电压3.0 kV;脱溶剂温度350 ℃;锥孔气流量50 L/h;干燥气为氮气,流量为650 L/h,碰撞气体为氩气,流量为0.18 mL/min;电喷雾离子源;正离子模式扫描;多反应监测(multi reaction monitoring mode,MRM)方式检测。其他参数见表2。

表2 检测L-瓜氨酸的质谱条件Table 2 MS conditions for the detection of L-citrulline
1.3.4 HPLC分析条件
色谱柱:Platisil ODS C18(250 mm×4.6 mm,5 μm);流动相:0.03 mmol/L磷酸;流速:0.7 mL/min;柱温:30 ℃;检测波长:202 nm;进样量20 μL。
1.3.5 提取条件优化
提取条件单因素水平:提取剂 为a(甲醇-1 mol/L盐酸(9∶1))、b(甲醇-1 mol/L盐酸(18∶1))、c(乙醇-1 mol/L盐酸(9∶1))、d(乙醇-1 mol/L 盐酸(18∶1))、e(pH值为3的盐酸溶液)、f(高纯水);料液比(g/mL)为1∶10、1∶20、1∶30、1∶40、1∶50;提取时间为5、10、20、30、45、60 min(超声时用温度计实时监测温度,控制温度变化小于5 ℃)。
2 结果与分析
2.1 籽瓜中L-瓜氨酸的鉴定
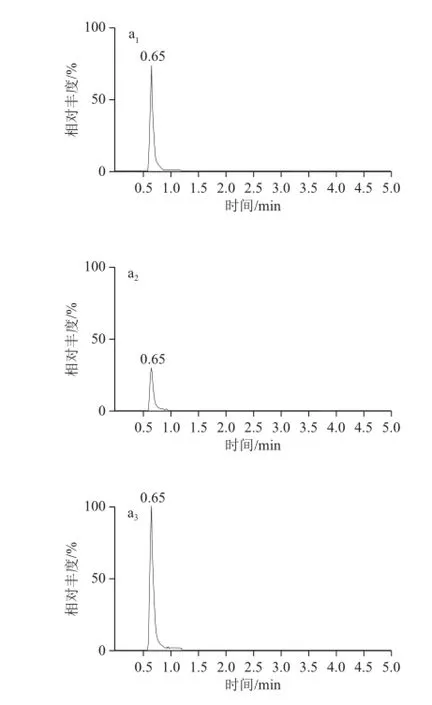

图 11 L-瓜氨酸标准品和籽瓜样品MRM色谱图Fig.1 MRM chromatograms of L-citrulline in standard solution and seeding watermelon sample
对1 μg/mL L-瓜氨酸标准物质进行一级全扫描和子离子扫描,确定L-瓜氨酸的母离子和子离子,选择两个丰度较高、干扰较少的子离子作为定性离子和定量离子,其MRM色谱图如图1a所示。将籽瓜瓤样品按样品处理方法处理稀释后,进样10 μL,得到MRM色谱图如图1b所示。可以看出籽瓜样品中目标物质的峰与L-瓜氨酸标准品的峰保留时间一致,选择的特征离子的保留时间及丰度之比与标准品的一致,确定目标物质为L-瓜氨酸,该方法能够用于籽瓜样品中L-瓜氨酸的定性分析。在此基础上,本实验建立了一种快速简便的HPLC方法检测籽瓜中L-瓜氨酸的含量。
2.2 提取条件的优化
以L-瓜氨酸的提取量为指标,采用单因素试验和正交试验对提取条件进行了优化。由于甲醇的沸点为64.5 ℃,提取温度过高容易造成提取剂的损失,影响实验结果,钱骅等[9]研究表明25 ℃时瓜氨酸提取率较高,提取一次即可提取完全。因此选择考察提取剂、料液比和提取时间3 个参数。
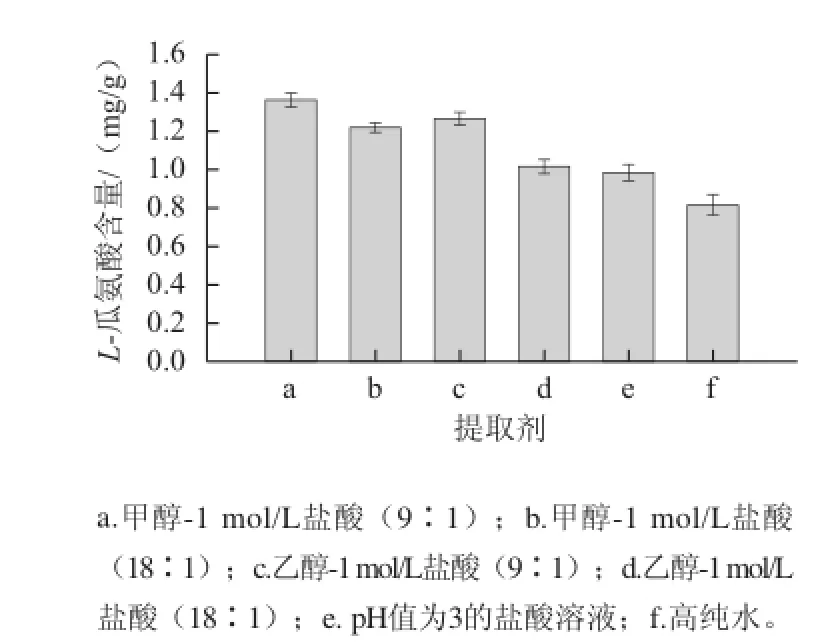
图2 提取剂对籽瓜中L-瓜氨酸含量的影响Fig.2 Effect of extraction solvents on L-citrulline recovery from seeding watermelon
2.2.1 提取溶剂的优化提取液中加入盐酸是为了调节提取液pH值呈酸性,提取液pH值在L-瓜氨酸等电点(pH 5.97)时,溶解性最低,提取效果不好,呈酸性时水溶性增大,也避免了碱性条件下的糊化现象,提取效果较好[5]。如图2所示,在相同酸性条件下,由于甲醇穿透细胞壁的能力比乙醇强,L-瓜氨酸的提取量:a高于c,b高于d;在无有机提取剂的条件下,盐酸溶液提取量比高纯水高,说明酸性条件下有利于提取L-瓜氨酸,本实验选择a作提取液。甲醇毒性大,宜用于分析测试过程中少量提取,在实际大量生产提取时,可选择价格低廉、无毒的乙醇或者盐酸溶液做提取溶剂。
2.2.2 料液比的优化

图3 料液比对籽瓜中L-瓜氨酸含量的影响Fig.3 Effect of material/liquid ratio on L-citrulline recovery from seeding watermelon
由图3可知,提取液使用量越大,L-瓜氨酸含量越高,在料液比为1∶40时,L-瓜氨酸的含量不再随着提取液用量增大而提高,提取液浓度太低也会增加后续分离工作的负担,故选择料液比为1∶40提取。
2.2.3 提取时间的优化
由图4所示,提取时间低于30min时,L-瓜氨酸的提取量随时间的延长又较明显的提高,随后呈下降趋势,可能由于杂质增多影响L-瓜氨酸的提取分离。

图4 提取时间对籽瓜中L-瓜氨酸含量的影响Fig.4 Effect of extraction duration on L-citrulline recovery from seeding watermelon
2.2.4 正交试验
在单因素试验基础上,对提取剂、料液比和提取时间3 个因素设计L9(33)正交试验设计及结果见表3。

表3 正交试验设计及结果Table 3 Results of orthogonal experiments and range analysis
由表3可知,影响籽瓜中L-瓜氨酸提取量主次因素为B>C>A,即提取剂为最主要因素,料液比和提取时间为次要因素。从各因素极差分析结果得出最佳提取条件为A2B1C2,正交试验中4号试验恰好是此条件的组合,故最优提取条件为甲醇-1 mol/L盐酸溶液(9∶1,V/V)作提取剂、料液比1∶40、提取时间30 min。
2.3 液相分离条件优化
研究表明C18柱能分离西瓜中的L-瓜氨酸[14],为了选择适合分析籽瓜样品的色谱柱,本实验选用Platisil ODS C18(250 mm×4.6 mm,5 μm)和Anilent Technologies C18(100 mm×4.6 mm,3.5 μm)色谱柱进行分离实验。实验结果表明Platisil ODS C18(250 mm×4.6 mm,5 μm)分离效果较好。同时考察不同浓度的磷酸的分离效果,最终确定0.03 mmol/L磷酸作为流动相。通过紫外-可见分光光度计在190~400 nm扫描,优化检测波长为202 nm。
2.4 标准品及籽瓜中L-瓜氨酸的色谱图
将L-瓜氨酸标准品和籽瓜样品提取液分别注入HPLC仪,色谱图见图5。可见L-瓜氨酸信号峰能与其他杂质峰分离,此方法可用来分析籽瓜中的L-瓜氨酸。

图 55 L-瓜氨酸标准品(A)和籽瓜样品(B)HPLC色谱图Fig.5 Chromatograms of L-citrulline standard (A) and seeding watermelon sample (B)
2.5 方法考察
2.5.1 标准曲线和检出限
外标法以标准品溶液的峰面积Y和其质量浓度X/(μg/mL)作图,如图6所示,得回归方程Y=183 581.261 76X+30 791.954 61,R2=0.999 9。将最小质量浓度的标准品溶液无限稀释,按照既定方法进样测定空白和稀释的标准品溶液,计算信噪比,3倍信噪比对应的标准品质量浓度确定的检出限为0.02 μg/mL,10倍信噪比对应的标准品质量浓度确定的定量限为0.08 μg/mL。

图6 6 L-瓜氨酸标准曲线Fig.6 Standard calibration curve of L-citrulline
2.5.2 方法精密度

表4 精密度实验结果(n=5)Table 4 Results of precise tests (n = 5)
在HPLC色谱条件下,分别对10 μg/mL和50 μg/mL的L-瓜氨酸标准品溶液,进样量20 μL,重复进样5 次,计算相对标准偏差分别为0.74%和0.31%,表明仪器精密度良好。
2.5.3 重复性实验
精密称取同一籽瓜样品5 份,制备成供试样品溶液,用HPLC分别测定,计算相对标准偏差为3.16%,表明该方法重复性较好。

表5 重复性实验结果(n=5)Table 5 Results of repeatability tests(n=5)
2.5.4 加标回收实验
在黑丰1号籽瓜的瓜心、瓜瓤和瓜皮样品中分别加入一定量外源标准L-瓜氨酸,然后按照样品溶液测定步骤进行定量分析。根据标准曲线,利用峰面积计算平均回收率和相对标准偏差,见表6。该方法回收率在95.12%~104.21%之间,相对标准偏差在1.86%~4.75%之间,表明该方法能准确测定籽瓜中L-瓜氨酸的含量。
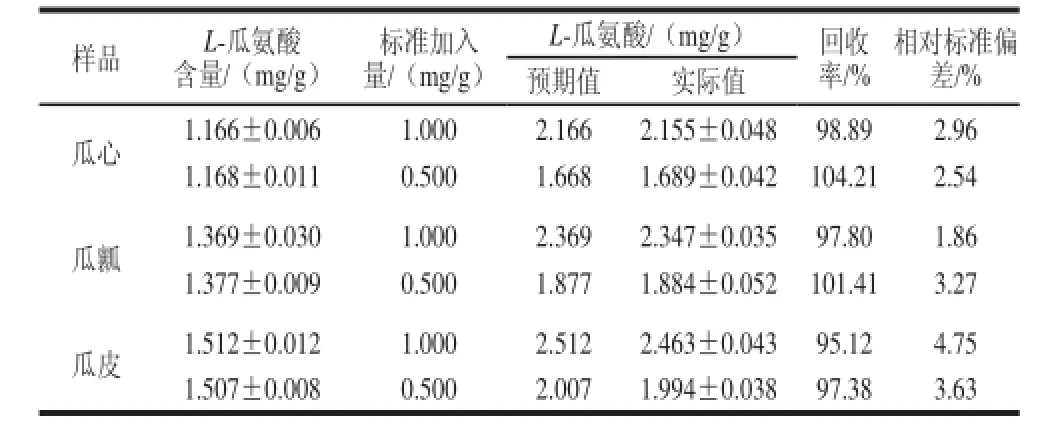
表6 加标回收实验结果(n=3)Table 6 Results of recovery tests (n =3)
2.6 实际样品分析
采用本实验建立的HPLC方法对实际样品进行测试。由表7可见,新疆主要种植的籽瓜品种果实中L-瓜氨酸平均含量在0.656~2.563 mg/g。不同品种间瓜氨酸含量差异明显,其中SW6平均含量最高,达到2.563 mg/g,其次是SW1,含量为2.374 mg/g,含量最低的是SW3,只有0.656 mg/g。同品种的籽瓜种植在不同产区L-瓜氨酸含量存在差异,见SW1和SW2,SW4和SW5,存在差异的原因可能与气候、土壤、人工管理等因素有关,有待进一步研究。对于同一个籽瓜而言,不同部位的L-瓜氨酸含量有所不同,SW1和SW2中L-瓜氨酸含量:瓜皮>瓜瓤>瓜心;SW3、SW5、SW6和SW7中L-瓜氨酸含量:瓜心>瓜瓤>瓜皮;而SW4则是瓜瓤>瓜心>瓜皮。
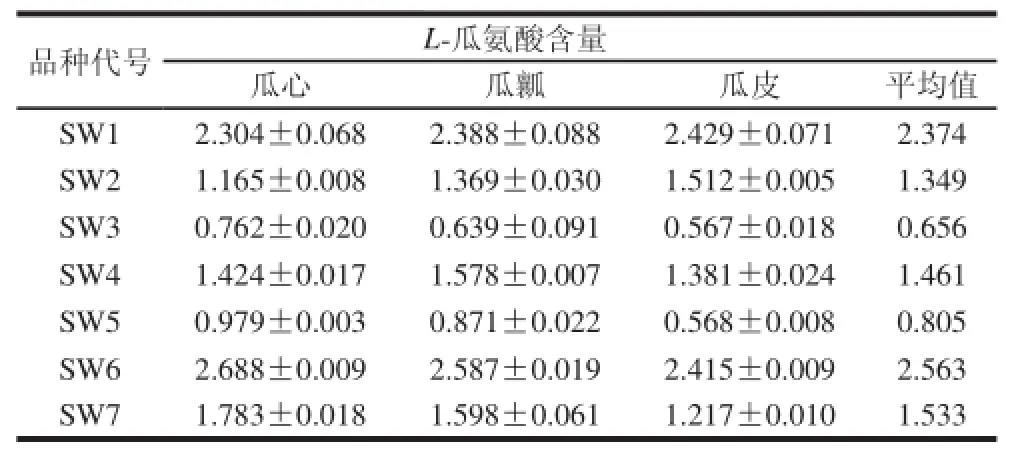
表7 不同籽瓜品种果实不同部位L-瓜氨酸含量(n=3)Tabllee 77 L-Citrulline contents in different parts of seedling watermelon from different varieties (n = 3) mg/g
3 结 论
本研究表明,籽瓜中含有丰富的L-瓜氨酸,LC-MSMS法可对籽瓜中的L-瓜氨酸进行准确定性,HPLC法可以快速、灵敏检测籽瓜中L-瓜氨酸的含量。本方法前处理步骤简单、无需衍生、重复性好、回收率符合要求。通过对实际样品的检测,可知新疆主要种植的籽瓜品种果实中L-瓜氨酸平均含量在0.656~2.563mg/g,不同品种籽瓜中L-瓜氨酸含量存在差异,同一个籽瓜不同部位L-瓜氨酸含量有所不同,相同品种的籽瓜种植的地区不同也会影响L-瓜氨酸含量,存在含量差异的因素需要进一步研究。本实验为籽瓜副产物的充分利用提供参考依据。
[1] WADA M. Uber citrulline, eine neue aminosaure im pressaft der wassermelone, citrullus vulgaris schrad[J]. Biochemische Zeitchrift, 1930, 224: 420-429.
[2] 刘娟, 路欣欣, 孟慧. 瓜氨酸的药理作用及生产方法的研究进展[J].药学实践杂志, 2011, 29(3): 173-175.
[3] 丁威, 李爱平, 张征林, 等. L-瓜氨酸和L-高瓜氨酸的制备[J]. 化工时刊, 2006, 20(2): 16-17.
[4] 曹瑜, 李加友, 焦庆才. 酶法转化制备L-瓜氨酸[J]. 精细化工, 2005, 22(10): 759-761.
[5] 程志强, 刘文革, 邓云, 等. 西瓜果实中L-瓜氨酸的提取与测定[J].果树学报, 2010, 27(4): 650-654.
[6] 刘文, 陈文秋, 潘健, 等. 天花粉中瓜氨酸与γ-氨基丁酸的含量测定[J].中国药业, 2012, 21(4): 26-28.
[7] 沈淑英, 管正洁, 冯容保. 瓜氨酸酶法生产的研究[J]. 工业微生物, 1981(4): 11-14.
[8] 刘青青, 金传山, 王振华, 等. 不同品种天花粉样品中瓜氨酸的含量测定[J]. 安徽中医学院学报, 2012, 31(4): 75-77.
[9] 钱骅, 焦洋, 赵伯涛, 等. 栝楼根中L-瓜氨酸的提取和含量测定[J]. 食品工业科技, 2010, 31(7): 287-289.
[10] ARCHIBALD R M. Determination of citrulline and allantoin and demonstration of citrulline in blood plasma[J]. Journal of Biological Chemistry, 1944, 156: 121-142.
[11] DAVIS A R, FI SH W, LEVI A, et al. L-citrulline levels in watermelon cultivars from three locations[J]. Cucurbit Genetics Cooperative Report, 2010, 33: 36-39.
[12] 李加友, 曹瑜, 刘茜, 等. 酶法测定人尿中L-瓜氨酸含量[J]. 分析化学, 2006, 34(3): 379-381.
[13] 梁新红, 孙俊良, 曾洁. 分光光度法测定葡萄酒中瓜氨酸含量[J]. 食品科学, 2010, 31(14): 234-237.
[14] 周慧, 郝宁, 严明, 等. 柱前衍生化HPLC法测定发酵液中L-瓜氨酸和L-鸟氨酸含量[J]. 南京工业大学学报: 自然科学版, 2009, 31(2): 77-80.
[15] JAYAPRAKASHA G K, CHIDAMBARA MURTHY K N, PATIL B S. Rapid HPLC-UV method for quantification of L-citrulline in watermelon and its potential role on smooth muscle relaxation markers[J]. Food Chemistry, 2011, 127(1): 240-248.
[16] MAO H M, CHEN B G, WANG W M, et al. Simultaneous analysis of citrulline and arginine in serum and tissue[J]. Microchemical Journal, 2011, 97(2): 291-295.
[17] RIMANDO A M, PERKINS-VEAZIE P M. Determination of citrulline in watermelon rind[J]. Journal of Chromatography A, 2005, 1078(1): 196-200.
[18] WANG H Y, HU P, JIANG J. Rapid determination of underivatized arginine, ornithine, citrulline and symmetric/asymmetric dimethylarginine in human plasma by LC-MS[J]. Chromatographia, 2010, 71(9/10): 933-939.
[19] SHIN S, FUNG S M, MOHAN S, et al. Simultaneous bioanalysis of l-arginine, l-citrulline, and dimethylarginines by LC-MS/MS[J]. Journal of Chromatography B, 2011, 879(7): 467-474.
[20] 武冬梅, 李冀新, 赵志永, 等. 新疆籽瓜主栽品种营养成分分析比较[J].食品研究与开发, 2010, 31(8): 177-179.
Identification and Quantitation of L-Citrulline in Seeding Watermelon by Liquid Chromatography-Tandem Mass Spectrometry and Rapid High Performance Liquid Chromatography
XI Dong-hua1, LI Wei-xia1, GAO Jing2, ATAWULLA•Tiemur3, LI Ling1, WU Bin3,*
(1. College of Chemistry and Chemical Engineering, Xinjiang University, Ürümqi 830046, China; 2. Center for Physics and Chemistry Analysis, Xinjiang University, Ürümqi 830046, China; 3. Institute of Agro-Products Storage and Processing, Xinjiang Academy of Agricultural Sciences, Ürümqi 830091, China)
In this work, certification of L-citrulline in seeding watermelon extract by liquid chromatography-tandem mass spectrometry (LC-MS-MS), and rapid determination of underivatized L-citrulline in seeding watermelon by high performance liquid chromatography (HPLC) were established. Single factor and orthogonal experiments were used to optimize the extraction conditions. LC-MS-MS analysis was carried out using Acuity C18(50 mm × 2.1 mm, 1.7 μm) as the stationary phase and a mixture of 10% acetonitrile and 90% methanol-water (50:50, V/V) as the mobile phase at a fl ow rate of 0.2 mL/min with a column temperature of 40 ℃. The electrospray ionization (ESI) source was applied and operated in a positive ion mode. The diagnostic product ions of L-citrulline were m/z 176.09/158.9 and m/z 176.09/112.9. Moreover, the ion pair of m/z 176.09/158.9 was used for quantification. HPLC separation was performed suing Platisil ODS C18(250 mm × 4.6 mm, 5 μm) as the stationary phase and 0.03 mmol/L phosphoric acid as the mobile phase at a fl ow rate of 0.7 mL/min with a column temperature of 30 ℃, and the detection wavelength was set at 202 nm. The results showed that a good linear relationship was obtained for L-citrulline in the concentration range of 0.5–100 μg/mL with R2= 0.999 9. Average recoveries varied from 95.12% to 104.21% with RSD of 1.86%–4.75% (n = 3). The content of L-citrulline in seeding watermelon was determined to be 0.656–2.563 mg/g.
seeding watermelon; L-citrulline; non-derivatization; liquid chromatography coupled to tandem mass spectrometry (LC-MS-MS); high performance liquid chromatography (HPLC)
O657.72
A
1002-6630(2014)24-0271-06
10.7506/spkx1002-6630-201424052
2014-03-21
新疆维吾尔自治区级公益性科研院所基本科研业务费专项(KY2013045;KY2014038)
席冬华(1990—),女,硕士研究生,研究方向为天然产物的分析。E-mail:553764469@qq.com
*通信作者:吴斌(1973—),男,副研究员,博士,研究方向为农产品贮藏与加工。E-mail:xjuwubin0320@sina.com

