5种葡萄球菌肠毒素基因MPCR-DHPLC检测方法的建立
陈 彬,郑 晶,王 颖,黄晓蓉,林 杰,彭华毅,邵碧英,*
(1.福建出入境检验检疫局,福建 福州 350001;2.福建省检验检疫技术研究重点实验室,福建 福州 350001;3.福建农林大学食品科学学院,福建 福州 350002)
5种葡萄球菌肠毒素基因MPCR-DHPLC检测方法的建立
陈 彬1,2,郑 晶1,2,王 颖1,3,黄晓蓉1,2,林 杰1,2,彭华毅1,2,邵碧英1,2,*
(1.福建出入境检验检疫局,福建 福州 350001;2.福建省检验检疫技术研究重点实验室,福建 福州 350001;3.福建农林大学食品科学学院,福建 福州 350002)
设计合成5 种葡萄球菌肠毒素基因(SEA、SEB、SEC、SED、SEE)的特异性引物,对聚合酶链式反应(polymerase chain reaction,PCR)的反应体系进行优化后,建立5 种葡萄球菌肠毒素基因的多重PCR结合变性高效液相色谱(multiplex PCR-denaturing high performance liquid chromatography,MPCR-DHPLC)检测方法,并进行MPCR-DHPLC检测特异性及灵敏度的测定,5重PCR-DHPLC检测灵敏度可达到100 CFU/mL。MPCR-DHPLC方法应用于食品中金黄色葡萄球菌肠毒素的检测,具有快速、准确、高通量等优点。
金黄色葡萄球菌;肠毒素;多重聚合酶链式反应;变性高效液相色谱
金黄色葡萄球菌(Staphylococcus aureus,SA),是引起细菌性食物中毒的重要病原菌之一[1],其中引起中毒的致病因子是葡萄球菌肠毒素(staphylococcal enterotoxins,SEs)。根据其血清学特性,SEs可分为5 种分别是SEA、SEB、SEC、SED、SEE。目前检测SES的方法按照检测原理不同,分为动物实验、免疫血清学方法、聚合酶链反应(polymerase chain reaction,PCR)技术、生物传感器等[2-4]。其中PCR技术具有快速、灵敏等特点,已广泛应用于致病菌的检测,多重PCR(multiplex PCR,MPCR)是对PCR技术的改进而建立起来的一种体外扩增技术,具有扩增效率高、经济简便等特点,在临床诊断上具有独特的优势和极高的应用价值[5-7],也特别适合食品中致病微生物的快速测定[8-10],在葡萄球菌肠毒素检测上已有一些报道[11-13]。但多采用凝胶电泳法检测PCR产物,步骤繁琐,易造成污染。变性高效液相色谱(denaturing high performance liquid chromatography,DHPLC)是新进发展的新技术,由PCR扩增的产物经DHPLC技术进行快速检测,该技术已在致病微生物检测上得到应用[14-19],但在葡萄球菌肠毒素检测上未见报道。本实验选取金黄色葡萄球菌5 种肠毒素基因,拟建立5 种肠毒素基因的MPCR-DHPLC检测方法,分析食品中金黄色葡萄球菌肠毒素基因型分布情况,并用于食品中金黄色葡萄球菌肠毒素快速、高通量检测。
1 材料与方法
1.1 菌株
标准菌株5 株,分别是产SEA的金黄色葡萄球菌(ICQQ22024)、产SEC的金黄色葡萄球菌(ICQQ22028)、产SED的金黄色葡萄球菌(ICQQ22003) 中国检验检疫科学研究院;产SEB的金黄色葡萄球菌(F0137)和产SEE的金黄色葡萄球菌(T43)由本实验室保存;大肠埃希氏菌(ATCC 25922)、肠炎沙门氏菌(ATCC 13076) 上海汉尼公司。
1.2 试剂与仪器
2×Taq PCR Master Mix、dNTP、DNA MarkerⅠ、细菌基因组DNA提取试剂盒、多重PCR扩增试剂盒北京天根生化科技有限公司;三乙基铵乙酸盐缓冲溶液(three ethyl ammonium acetate buffer solution,TEAA)、DNA标样 北京市表观生物技术有限公司。
Tgradient 96梯度PCR仪 德国Biometra公司;PTC 220 PCR仪 美国Bio-Rad公司;WAVE4500变性高效液相色谱仪 美国Transgenomic公司;Biophotometer核酸蛋白仪 德国Eppendorf公司。
1.3 方法
1.3.1 引物
根据基因序列数据库(GenBank)上查找5 种葡萄球菌肠毒素(SEA、SEB、SEC、SED、SEE)基因和特异基因femA的序列,并在美国生物技术信息中心(National Center for Biotechnology Information,NCBI)上进行序列比对后筛选各自的特异性扩增片段,利用Primer 5.0软件设计引物,委托上海生工公司合成以下引物(表1)。引物用TE溶液(pH 8.0)稀释至浓度为10 μmol/L,-20 ℃保存备用。

表1 实验引物Table 1 The primer pairs used for experiments
1.3.2 细菌DNA的提取
各取5 株金黄色葡萄球菌标准菌株冻干粉,分别溶解于7.5%氯化钠肉汤中,于(36 ±1)℃培养18~24 h,将培养物划线接种到Baird-Parker平板,(36±1) ℃培养18~24 h。挑取平板上典型单菌落接种到5 mL 脑心浸液肉汤(brain heart infusion broth,BHI)培养液中,在台式恒温振荡器(36±1)℃振荡培养12 h。取50株非金黄色葡萄球菌的甘油保存液100 øL,接种于4 mL营养肉汤,(36±1) ℃培养18~24 h。各取1 mL菌悬液,按照细菌基因组提取试剂盒说明书提取DNA,经1∶10稀释后,于核酸蛋白仪上测定浓度和纯度,并用(Tris+EDTA,TE)溶液(pH 8.0)稀释至50 ng/øL,-20 ℃保存备用。
1.3.3 5 种葡萄球菌肠毒素基因多重PCR反应体系的确立
检测5 种葡萄球菌肠毒素基因中的2 种和3 种各有10个组合,4 种的有5 个组合,2、3、4重和5重PCR反应总体积均为20 øL,6重PCR反应总体积均为30 øL。
1.3.3.1 2重PCR反应体系
10×Multi HotSart Buffer 2 μL,Super Pure dNTP 1.6 μL,Multi HotSart DNA Polymerase 0.4 μL,相应的DNA模板各1 μL(50 ng),各引物和ddH2O的用量如表2所示。

表2 2重PCR反应体系中引物和ddH O的用量Table 2 The amounts of ddH O and primers used in duplex PCR reaction system
1.3.3.2 3重和4重PCR反应体系

表3 3重PCR反应体系中引物和ddH O的用量Table 3 The amounts of ddH O and primers used in triplex PCRreaction system

表4 4重PCR反应体系中引物和ddH2OO的用量Table 4 The amounts of ddH2OO and primers used in quadruplex PCR reaction system
10×Multi HotSart Buffer 3 μL,Super Pure dNTP 2.4 μL,Multi HotSart DNA Polymerase 0.6 μL,相应的DNA模板各1 μL(50 ng),各引物和ddH2O的用量如表3、4所示。
1.3.3.3 5重PCR反应体系
10×Multi HotSart Buffer 4 μL,Super Pure dNTP 3.2 μL,Multi HotSart DNA Polymerase 0.8 μL,相应的DNA模板各1 μL (50ng),SEA-F、SEA-R各0.5 μL,SEB-F、SEB-R各0.8 μL,SEC-F、SEC-R各0.5 μL,SED-F、SED-R各1.0 μL,SEE-F、SEE-R各0.5 μL,ddH2O 0.4 μL。
1.3.3.4 6重PCR反应体系
10×Multi HotSart Buffer 4 øL,Super Pure dNTP 3.2,Multi HotSart DNA Polymerase 0.8 øL,相应的DNA模板各1 øL(50 ng),SEA-F、SEA-R各0.5 øL,SEB-F、SEB-R各0.8 øL,SEC-F、SEC-R各0.5 øL,SED-F、SED-R各1.0 øL,SEE-F、SEE-R各0.5 øL,femA-F、femA-R各0.5 øL,ddH2O 9.4 øL。PCR反应条件:95 ℃预变性15 min;94 ℃变性30 s,55 ℃退火90 s,72 ℃延伸1 min,40 个循环;72 ℃延伸10 min。
反应结束后,取PCR产物经琼脂糖凝胶电泳检测,以确定各引物所加的比例是否合适。
1.3.4 MPCR-DHPLC方法的建立
取上述PCR产物进行DHPLC检测,上样量5 μL,洗脱液由缓冲液A(0.1 mmol/L的TEAA)和缓冲液B(0.1 mmol/L的TEAA,含25%乙腈)组成,以0.9 mL/min的流速在50 ℃条件下自动洗脱DNA分子,运行时间为20 min,用峰对应的碱基对大小来判断PCR产物是否正确。
1.3.5 MPCR-DHPLC检测特异性的测定
为了验证该方法的特异性,以金黄色葡萄球菌标准菌株的DNA作为阳性对照,以ddH2O作为空白对照,并以50株非金黄色葡萄球菌的细菌的DNA作为阴性对照,进行MPCR扩增并用DHPLC观察结果。
1.3.6 MPCR-DHPLC检测灵敏度的测定
5 种金黄色葡萄球菌标准菌株制成菌悬液后分别1∶10系列稀释,选择合适的稀释度进行菌落计数,同时按1.3.2节中方法提取DNA模板,并按照1.3.3节的反应条件进行MPCR扩增。反应结束后,取5 øL MPCR产物进行DHPLC检测。
1.3.7 MPCR-DHPLC方法的应用
将建立的MPCR-DHPLC检测方法用于本实验室近年来从食品样品中分离的80 株金黄色葡萄球菌的检测。吸取甘油保存的金黄色葡萄球菌菌液50 øL于BHI培养,(36±1)℃摇床培养12 h。吸取1 mL菌悬液,12 000 r/min离心2 min,弃上清液。若沉淀太少,再取1 mL菌悬液进行离心操作。用试剂盒法提取DNA,进行MPCR-DHPLC检测。
2 结果与分析
2.1 5 种葡萄球菌肠毒素基因多重PCR反应体系的建立

图1 PCR产物的电泳结果Fig.1 Electrophoresis of duplex and triplex PCR products

图2 4、5、6 重PCR产物的电泳结果Fig.2 Electrophoresis of quadruplex, quintuplex and sextuplex PCR products

图3 MPCR-琼脂糖凝胶电泳验证结果Fig.3 Agarose electrophoresis showing the validity of MPCR
实验建立的多重PCR反应体系均能很好地扩增出相应的肠毒素基因。选用多重PCR扩增试剂盒进行MPCR扩增,5 种肠毒素及femA基因的2~6 重PCR产物的琼脂糖凝胶电泳结果如图1、2所示,各产物对应的条带清晰,且无杂带产生,表明经过多层优化,确立的引物比例合适,互不干扰,为DHPLC检测做好基础。为了观察6对引物同时扩增的效果,实验采用5 种葡萄球菌肠毒素产毒株的DNA
模板进行扩增,从1、2重逐级扩增到6重,琼脂糖凝胶法观察的结果如图3所示,MPCR产物中仅扩增到与在PCR反应体系中加入的模板DNA相对应的条带,没有任何杂带的出现,表明MPCR反应体系具有很好的特异性。
2.2 MPCR-DHPLC方法的建立
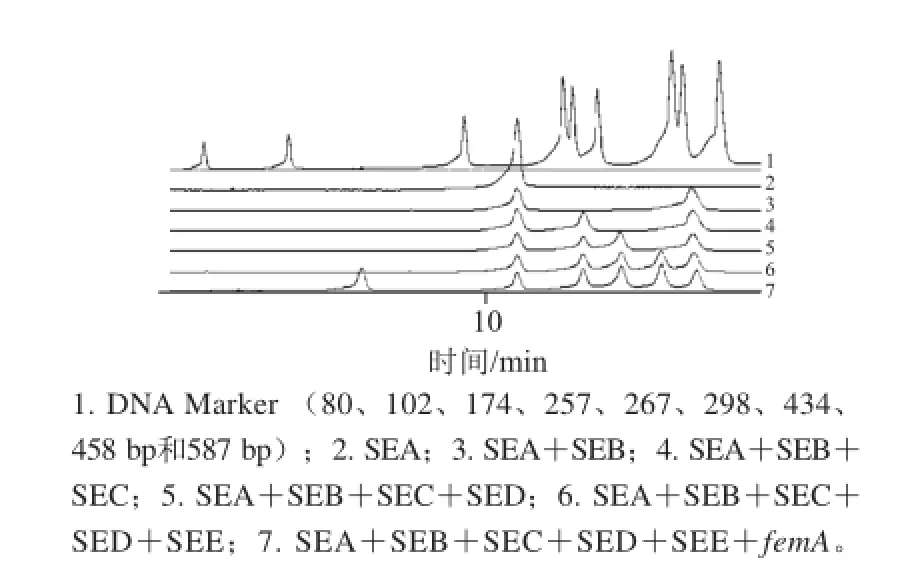
图4 MPCR-DHPLC验证结果Fig.4 Verification of MPCR-DHPLC
DHPLC观察的结果如图4所示,5 种葡萄肠毒素及femA基因相对应的阳性峰出现位置与预期吻合,各峰分离清晰,无杂峰产生,表明建立的MPCR-DHPLC检测方法是可行的。
2.3 MPCR-DHPLC方法的特异性
用建立的MPCR-DHPLC法检测本实验室保存的50 株非金黄色葡萄球菌的标准株和分离株的特异性检测,测定的结果只有金黄色葡萄球菌标准菌株出现预期峰,而非目标菌株均未出现任何峰。以大肠埃希氏菌、沙门氏菌测定结果为例如图5所示,只有金黄色葡萄球菌标准菌株扩增出了相应的目的条带,而大肠埃希氏菌、沙门氏菌菌株以及ddH2O均没有出现任何条带。测定结果表明建立的MPCR-DHPLC方法的特异性很好。

图5 5对引物特异性实验DHPLC观察结果Fig.5 Specificity of MPCR-DHPLC
2.4 MPCR-DHPLC方法的灵敏度

图6 MPCR-DHPLC灵敏度测定结果Fig.6 Sensitivity of MPCR-DHPLC
MPCR-DHPLC检测灵敏度的测定结果如图6所示,随着菌含量的逐渐减少,DHPLC检测结果显示的特异峰面积越来越小。SEA最低能检测到53 CFU/mL,SEB能检测到36 CFU/mL,SEC能检测到45 CFU/mL,SED能检测到32 CFU/mL,SEE能检测到41 CFU/mL。结果显示,MPCR-DHPLC方法的灵敏度可达到100 CFU/mL。
2.5 MPCR-DHPLC检测方法的实际应用
将建立的MPCR-DHPLC方法用于本实验室近几年从食品样品中分离的金黄色葡萄球菌的检测,共检测了80 株金黄色葡萄球菌。检测结果显示,80 株金黄色葡萄球菌中有47 株携带肠毒素基因,其中33 株菌只携带一种肠毒素基因,13 株菌携带两种肠毒素基因,1 株菌携带一种肠毒素基因。同时携带多种肠毒素基因的部分样品采用MPCR-DHPLC方法的检测结果见图7。

图7 MPCR-DHPLC方法检测食品样品中分离金葡菌菌株的结果Fig.7 Results of MPCR-DHPLC detection of S. aureus strains isolated from food samples
3 讨 论
对于多重PCR反应体系的建立,反应条件的优化非常重要,否则可能导致出现假阳性、假阴性,拖带、涂抹带或非特异性条带等结果。引物浓度比例、退火温度等都影响多重PCR的成败[20]。本实验不仅对各引物的浓度进行了优化,也对热启动DNA聚合酶和dNTP的用量进行了优化,经过多方面的优化,最后确定了2~6 重PCR反应体系中各引物和试剂的用量。最终确定了2~6 重PCR反应体系的引物的量。有研究[21]表明,多重PCR反应体系中扩增片段的大小和所用引物浓度几乎呈正相关,即片段大的,引物浓度高。而实验多次优化确定的引物浓度结果同这条规律并非完全符合,因此建立一个新的MPCR反应体系就要进行实际的优化过程。
作为高效快速的分子生物学手段,利用多重PCR体系对细菌目的基因进行检测和分型已获得普遍认可。在葡萄球菌肠毒素检测上不仅快速、灵敏,而且不受葡萄球菌毒素抗体制备和毒素基因表达的限制[22-25],弥补传统免疫学检测方法的不足,但PCR或MPCR产物均采用凝胶电泳的方法,目前尚未见将DHPLC方法应用于葡萄球菌肠毒素检测及分型的报道。本实验多重PCR体系是在单一PCR的基础上,通过合理设计引物,优化PCR反应体系,使得在同一反应管内可同时扩增多个目的基因,既节省试剂,又提高检测效率。PCR扩增的产物经DHPLC技术进行快速检测,可同时对金黄色葡萄球菌的5种葡萄球菌肠毒素进行检测和分型。
传统的检测方法采用细菌分离培养方法,对金黄色葡萄球菌的检测需要3~6 d,对检出的金黄色葡萄球菌是否产肠毒素,耗时更长。本实验建立的MPCR-DHPLC检测方法,从取样、增菌、DNA提取到出具结果,只需要2 d时间,检测灵敏度可达到100 CFU/mL,应用于食品中金黄色葡萄球菌肠毒素的检测,具有快速、准确、高通量的优点。而且,本实验采用DHPLC方法代替琼脂糖凝胶电泳,不仅可以省掉点样、电泳、染色和观察等较为繁琐的步骤,还可以避免电泳易受到污染的情况。只需将PCR反应管放入自动进样器,设定好程序,便能自动完成数百个样品的检测。因此,将建立的MPCR-DHPLC方法应用于食品中金黄色葡萄球菌肠毒素的检测,不仅能大大缩短检测周期,达到高通量检测的目的,对预防和诊断由肠毒素引起的食物中毒具有很高的应用价值。虽然目前对携带这些肠毒素基因型的葡萄球菌的毒性作用尚不明确,但是通过对食品污染监测发现携带肠毒素基因的金葡菌时可及时进行预警,另外在由肠毒素引起的食物中毒调查和溯源中有很好的应用价值。
[1] NIKOLAY S, DMITRIY V S. Analysis of multiple staphylococcal enterotoxin genes by an oligonucleotide microarray assay[J]. Journal of Clinical Microbiology, 2004, 42(5): 2134-2143.
[2] 向阳. 食品中金黄色葡萄球菌及其肠毒素的检测方法[J]. 中国食品学报, 2002, 2(2): 57-61.
[3] 李琳, 黄金海, 赵耘, 等. 葡萄球菌肠毒素基因分型PCR检测技术的研究[J]. 食品科学, 2008, 29(7): 340-344.
[4] 刘鹏翀, 黄金海, 刘莉, 等. 葡萄球菌肠毒素DAS-ELISA检测方法的建立及应用[J]. 食品科学, 2012, 33(8): 195-198.
[5] BEATRICLE B, LAURENT P. Updated multiplex polymerase chain reaction for detection of 16S rRNA methylases: high prevalence among NDM-1 producers[J]. Diagnostic Microbiology and Infectious Disease, 2011, 74(4): 442-445.
[6] LAURENT P, TIMOTHY R W. Multiplex PCR for detection of acquired carbapenemase genes[J]. Diagnostic Microbiology and Infectious Disease, 2011, 70(1): 119-123.
[7] ROBIN B L, ANDERSSON L M. Seasonal variations of 15 respiratory agents illustrated by the application of a multiplex polymerase chain reaction assay[J]. Scandinacian Journal of Infectious Diseases, 2012, 44(1): 9-17.
[8] 安利伟, 陈蕊. 多重PCR技术在检测食源性病原微生物中的应用[J].亚太传统医药, 2010, 6(8): 172-173.
[9] 张小贤, 张家敏, 黄卫平, 等. 应用多重PCR法快速检测伤寒沙门菌的研究[J]. 中国卫生检验杂志, 2010, 20(5): 1074-1076.
[10] 张健, 邓志爱, 刘巧宜, 等. 两种方法检测冻肉中的小肠结肠炎耶尔森氏菌[J]. 中国卫生检验杂志, 2010, 20(3): 628-629; 632.
[11] 刘景武, 张伟. FTA滤膜用于PCR检测肉中的金黄色葡萄球菌[J]. 生物工程学报, 2005, 21(6): 1009-1013.
[12] 徐晓可, 吴清平, 张菊梅, 等. 食品中金黄色葡萄球菌多重PCR检测方法的研究[J]. 食品与生物技术学报, 2011, 30(1): 84-89.
[13] 王丽, 王冰, 黎桂莲, 等. 金黄色葡萄球菌肠毒素快速分型体系的建立及应用[J]. 国际检验医学杂志, 2012, 33(2): 154-156; 159.
[14] HURTLE W, SHOEMAKER D, HENCHAL E, et a1. Denaturing HPLC for identifying bacteria[J]. Biotechniques, 2002, 33(2): 386-391.
[15] FRANCIOSA G, POURSHABAN M, LUCA A, et a1. Identification of type A, B, E and F botulinum neurotoxin genes and of botulinum neurotoxigenic clostridia by denaturing high-performance liquid chromatography[J]. Applied and Environmental Microbiology, 2004, 70(3): 4170-4176.
[16] 杨春华, 曹际娟, 钟毅, 等. 乳及乳制品中肺炎克雷伯氏菌PCR-DHPLC检测新技术的建立[J]. 微生物学通报, 2010, 47(12): 1805-1810.
[17] 许龙岩, 刘静宇, 袁慕云, 等. MPCR-DHPLC检测大肠杆菌O157的研究[J]. 中国卫生检验杂志, 2010, 20(5): 1057-1059.
[18] 曹际娟, 王耀, 王顺之, 等. PCR-DHPLC技术快速检测食品中英诺克李斯特氏菌[J]. 生物技术通报, 2009, 32(2): 235-238.
[19] 陆连寿, 张秀英, 郑明. 变性高效液相色谱检测技术在微生物领域的应用[J]. 中国兽药杂志, 2009, 43(9): 40-44.
[20] 刘志杰, 李如举, 曾智勇, 等. 多重PCR反应的影响因素及其优化[J].黑龙江畜牧兽医, 2011, 54(13): 26-28.
[21] 谢芝勋, 谢志勤, 庞耀珊, 等. 应用三重聚合酶链反应同时检测鉴别鸡3 种病毒性呼吸道传染病的研究[J]. 中国兽医科技, 2001, 31(1): 11-14.
[22] OMOE K, ISHIKAWA M, SHIMODA Y, et a1. Detection of seg she, and seigenes in Staphylococcus aureus isolates and determination of the enterotoxin productivities of S. aureus isolates Harboring seg she, or seigenes[J]. Journal of Clinical Microbiology, 2002, 40(3): 857-862.
[23] 邱阳, 王刚, 卢行安. PCR技术检测食品中金黄色葡萄球菌肠毒素B基因[J]. 中国微生态学杂志, 2004, 16(2): 115-116.
[24] 梁毅珊. 金黄色葡萄球菌肠毒素及其检测方法的研究进展[J]. 中国热带医学, 2008, 8(9): 1658-1659.
[25] 张严峻, 张俊彦, 梅玲玲, 等. 金黄色葡萄球菌肠毒素基因型分析[J].中国卫生检验杂志, 2010, 20(6): 1417-1418.
Development of a Multiplex PCR-DHPLC Detection Method for Five Staphylococcal Enterotoxin Genes
CHEN Bin1,2, ZHENG Jing1,2, WANG Ying1,3, HUANG Xiao-rong1,2, LIN Jie1,2, PENG Hua-yi1,2, SHAO Bi-ying1,2,*
(1. Fujian Entry-Exit Inspection and Quarantine Bureau, Fuzhou 350001, China; 2. Fujian Provincial Key Laboratory of Inspection and Quarantine Technology Research, Fuzhou 350001, China; 3. College of Food Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
Primer pairs specific for the five staphylococcal enterotoxin genes SEA, SEB, SEC, SED, and SEE were designed and synthesized. Using multiplex polymerase chain reaction coupled with denaturing high performance liquid chromatograph (MPCR-DHPLC), a detection method for these five staphylococcal enterotoxin genes were established after the polymerase chain reaction (PCR) reaction conditions were optimized. The sensitivity and specificity of the detection method were then determined. The results showed that the quintuplex PCR-DHPLC method could detect specifically staphylococcal enterotoxin genes with detection limit of 100 CFU/mL. The MPCR-DHPLC method is useful for the rapid, accurate and high-throughput detection of staphylococcal enterotoxins in food samples.
Staphylococcus aureus; enterotoxin; MPCR; DHPLC
Q93.332
A
1002-6630(2014)24-0243-06
10.7506/spkx1002-6630-201424047
2014-06-30
福建省科技厅自然科学基金项目(2012J01062);福建局科技项目(FK2012-25)
陈彬(1969—),女,高级工程师,学士,研究方向为食品微生物检验。E-mail:chenbin0123@aliyun.com
*通信作者:邵碧英(1973—),女,研究员,博士,研究方向为食品微生物检验。E-mail:byshao@sohu.com

