肉鸡屠宰场多重耐药沙门氏菌Ⅰ类整合子与磺胺类耐药基因(sul1、sul2和sul3)的检测
赖海梅,刘书亮,2,*,邹立扣,韩新锋,周 康,2,朱冬梅,彭 珍,李建龙
(1.四川农业大学食品学院,四川 雅安 625014;2.四川省农产品加工及贮藏工程重点实验室,四川 雅安 625014;3.四川农业大学 都江堰校区微生物学实验室,四川 都江堰 611830)
肉鸡屠宰场多重耐药沙门氏菌Ⅰ类整合子与磺胺类耐药基因(sul1、sul2和sul3)的检测
赖海梅1,刘书亮1,2,*,邹立扣3,韩新锋1,周 康1,2,朱冬梅1,彭 珍1,李建龙1
(1.四川农业大学食品学院,四川 雅安 625014;2.四川省农产品加工及贮藏工程重点实验室,四川 雅安 625014;3.四川农业大学 都江堰校区微生物学实验室,四川 都江堰 611830)
目的:了解肉鸡屠宰场多重耐药沙门氏菌Ⅰ类整合子及磺胺类耐药基因携带情况。方法:采用纸片扩散法对肉鸡屠宰场84 株沙门氏菌分离株进行10 种抗生素敏感性实验;应用聚合酶链式反应(polymerase chain reaction,PCR)方法检测多重耐药沙门氏菌sul1、sul2、sul3和int1基因。结果:84 株沙门氏菌对氨苄西林和萘啶酸耐药率高达100%,对环丙沙星、四环素、甲氧苄啶/磺胺甲噁唑、大观霉素、氟苯尼考、庆大霉素耐药率分别为39.29%、35.71%、35.71%、35.71%、22.62%、14.29%。38 株沙门氏菌对3 种及以上抗生素耐药,属于多重耐药菌株。38 株多重耐药菌株中,有20 株携带Ⅰ类整合子。30 株对甲氧苄啶/磺胺甲噁唑耐药的菌株中,均能 检测到sul1或sul2或sul3基因,与表型耐药100%符合,其检出率分别为40%、100%、63.3%。结论:肉鸡屠宰场中沙门氏菌耐药现象已不容乐观,沙门氏菌多重耐药性与Ⅰ类整合子的携带之间关系密切,且Ⅰ类整合子在磺胺类耐药菌株的产生中起到重要作用。
沙门氏菌;Ⅰ类整合子;多重耐药性;磺胺类耐药基因
沙门氏菌是重要的人兽共患病病原菌,也是一种危害严重的食源性致病菌,可通过食物链感染人,受污染的动物性食品是其重要来源[1-3]。近年来,随着抗生素在食品动物养殖上的广泛应用,沙门氏菌对常规抗生素产生耐药性甚至多重耐药性,不仅增加了畜禽疾病控制的难度,而且可通过食品污染威胁人类健康,这已引起人们普遍关注[4]。Ⅰ类整合子作为可移动的DNA片段,能够捕获外源耐药基因并将耐药基因水平传播,对细菌的耐药性传播有非常重要的意义[5-6]。沙门氏菌对磺胺类广泛耐药与磺胺类耐药基因sul1、sul2和sul3基因有关。sul1基因常与其他耐药基因整合到Ⅰ类整合子上,sul2基因常位于非接合性质粒或可移动多重耐药质粒上,sul3是新发现的磺胺类耐药基因[7-9]。Ⅰ类整合子与沙门氏菌广泛耐药有关[3,10]。所以应用PCR方法对Ⅰ类整合子和磺胺类耐药基因(sul1、sul2和sul3)进行检测,可从分子水平反映Ⅰ类整合子与磺胺类广泛耐药的关系。本实验对肉鸡屠宰场分离的沙门氏菌耐药性进行调查,并应用聚合酶链式反应(polymerase chain reaction,PCR)方法对其Ⅰ类整合子与磺胺类耐药基因(sul1、sul2和sul3)进行检测,旨在分析磺胺类耐药基因分布及Ⅰ类整合子在磺胺类耐药基因传播中的作用,为耐药性安全评价提供数据参考。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 分离菌株
2012年11月—2013年6月从某肉鸡屠宰场分离鉴定的84 株沙门氏菌(粪样51 株,屠宰场生产环节肉鸡胴体表面19 株,分割鸡肉产品14 株),来源于284 份样品(粪样83 份、屠宰场生产环节肉鸡胴体表面样151 份、分割鸡肉产品50 份)按照从一份阳性样品中获得一株沙门氏菌的原则保存菌株,由四川农业大学食品学院四川省农产品加工及贮藏工程重点实验室保存。
1.1.2 参考菌株
肠炎沙门氏菌CICC21482,大肠杆菌ATCC25922,2株沙门氏菌int1可变区基因盒阳性菌株,携带bla(oxA-30/aadA1)和drfA1/orfC基因盒,由四川农业大学食品学院四川省农产品加工及贮藏工程重点实验室提供。
1.1.3 培养基
M-H琼脂、营养琼脂、营养肉汤 青岛高科园海博生物技术有限公司。
1.1.4 试剂
DNA Marker DL2000、琼脂糖、2×PCR mix等均购于宝生物工程(大连)有限公司。
1.1.5 药敏纸片
青霉素类:氨苄西林(ampicillin,AMP,10 μg/片)、阿莫西林/克拉维酸(amoxicillinclavulanic aicd,AMC,20/10 μg/片);头孢类:头孢曲松(ceftriaxone,CRO,30 μg/片);氨基糖苷类:庆大霉素(gentamycin,GEN,10 μg/片)、大观霉素(spectinomycin,SPE,100 μg/片);四环素类:四环素(tetracycline,TET,30 μg/片);氯霉素类:氟苯尼考(fluorine benzene,FLO,75 μg/片);磺胺类:甲氧苄啶/磺胺甲噁唑(trimethoprim-sulfamethoxazole,SXT,1.25/23.75 μg/片);喹诺酮类:萘啶酸(nalidixic,NAL,30 μg/片)、环丙沙星(ciprofloxacin,CIP,5 μg/片)。以上试剂均购自赛默飞世尔生物化学(北京)有限公司。
1.1.6 仪器与设备
DHP-9162恒温培养箱 上海一恒科技有限公司;BSC-1300ⅡA2型生物安全柜 苏州安泰空气技术有限公司;SORVALL离心机 美国科俊仪器有限公司;Milli-Q超纯水系统 美国Millipore 公司;C1000 Thermal Cycler PCR仪、PowerPac Basic电泳仪、水平电泳槽、凝胶成像系统 美国Bio-Rad公司。
1.2 方法
1.2.1 药敏实验
药物敏感性实验按照WHO推荐的纸片扩散法[11]和美国临床实验室标准化协会(CLSI2010)手册[12]进行10 种抗菌药敏感性实验,以大肠杆菌为质控菌株,结果参考CLSI对药敏结果进行判定。
1.2.2 Ⅰ类整合子和磺胺类耐药基因的PCR检测
根据药敏实验结果判断耐药表型,以三重及以上耐药的菌株和甲氧苄啶/磺胺异噁唑产生耐药性的菌株作为实验菌株。
1.2.2.1 模板的制备
采用热裂解法[13-14]提取沙门氏菌DNA。取1.5 mL培养18~24 h的沙门氏菌培养液,12 000 r/min离心2 min,沉淀用1 mL灭菌超纯水反复洗2 次,12 000 r/min离心2 min,沉淀加100 μL 1× TE(pH 8.0)溶液重悬细胞,100 ℃水浴10 min,再置于冰水浴5 min,12 000 r/min离心2 min,上清液即为PCR模板,-20 ℃保存备用。
1.2.2.2 引物设计
根据GenBank和文献设计sul1[15]、sul2[15]、sul3[16]和int1[17]基因的引物见表1,由宝生物工程(大连)有限公司合成。

表1 PCR扩增用引物Table 1 Primers for PCR amplification
1.2.2.3 PCR反应
PCR扩增体系为:25 μL反应体系中加12.5 μL 2×PCR mix(0.25 μL 5 U/μL Taq酶,3 μL 25 mmol/L MgCl2,5 μL 10×PCR Reaction Buffer,4 μL 2.5 mmol/L dNTP),1 μL(10 μmol/L)上游和下游引物,1 μL模板DNA,加灭菌超纯水至25 μL。PCR反应参数为:95 ℃预变性5 min,95 ℃变性45 s,(int1 70℃、可变区 55 ℃、sul1 65 ℃、sul2 70 ℃、sul3 60 ℃)退火50 s,72 ℃延伸50 s,35 个循环,72 ℃延伸10 min。
1.2.2.4 扩增产物检测
PCR产物用1%琼脂糖凝胶(0.5×TBE)电泳,琼脂糖凝胶含Gold-View DNA染料(5 øL/100 mL),缓冲液为0.5×TBE,以100 V恒压电泳50 min后用凝胶成像系统照相。
1.2.2.5 序列测定
随机选取沙门氏菌菌株PCR产物送上海英俊生物技术有限公司克隆测序。
2 结果与分析
2.1 肉鸡屠宰场沙门氏菌耐药性
采用纸片扩散法检测了84 株沙门氏菌分离株对10 种抗菌药的敏感性。结果表明 84 株沙门氏菌对氨苄西林和萘啶酸100%耐药,对环丙沙星、四环素、甲氧苄啶/磺胺甲噁唑、大观霉素、氟苯尼考、庆大霉素耐药率较高,耐药率分别为39.29%、35.71%、35.71%、35.71%、22.62%、14.29%;对阿莫西林/克拉维酸和头孢曲松耐药率较低,耐药率分别为7.14%和1.59%(图1)。所有沙门氏菌均对2 种及以上抗生素耐药,38 株沙门氏菌对3 种及以上抗生素耐药,表现为多重耐药,多重耐药率为45.24%(图2)。51 株鸡粪源沙门氏菌对氟苯尼考和阿莫西林/克拉维酸的 耐药性与整体差异较大,耐药率分别为41.18%和25.49%。19 株屠宰环节鸡肉胴体表面源沙门氏菌对10 种抗菌药的耐药率与整体无明显差异。14 株分割鸡肉产品源沙门氏菌对氨苄西林、萘啶酸、阿莫西林/克拉维酸和头孢曲松耐药率与整体无明显差异,对四环素、甲氧苄啶/磺胺甲噁唑、 氟苯尼考、环丙沙星的耐药率相差较大,耐药率分别为21.43%、7.14%、7.14%和7.14%,对大观霉素和庆大霉素100%不耐药。
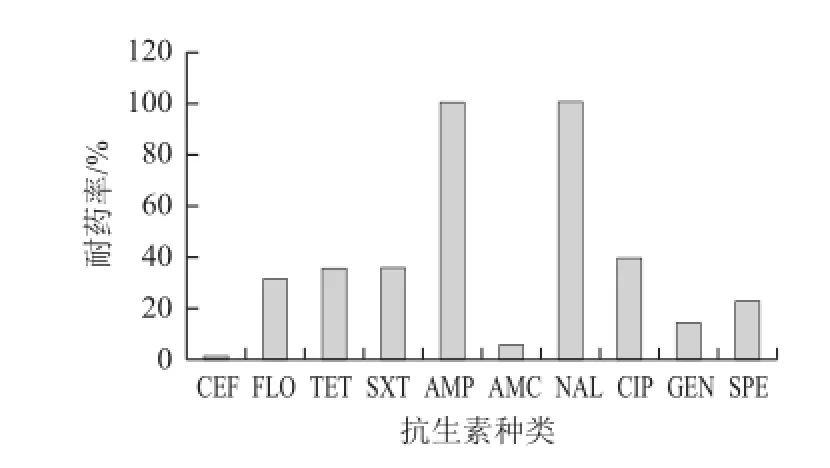
图1 肉鸡屠宰场沙门氏菌对10 种抗生素的耐药率Fig.1 Resistance rate of Salmonella from broiler slaughterhouse to 10 antibiotics

图2 肉鸡屠宰场沙门氏菌的多重耐药情况Fig.2 Distribution of multiple drug resistant Salmonella from broiler slaughterhouse
2.2 肉鸡屠宰场多重耐药沙门氏菌Ⅰ类整合子扩增结果
38 株多重耐药沙门氏菌有20 株int1阳性菌株,检出率为52.6%,Ⅰ类整合子可变区基因盒检测,扩增结果为阴性(图3、4)。5 株对3种抗生素耐药沙门氏菌有1 株阳性菌株,33 株至少对4 种抗生素耐药的沙门氏菌有19 株阳性菌株。26 株鸡粪样中多重耐药沙门氏菌有18 株int1阳性菌株,检出率为69.23%,屠宰加工胴体表面样和分割鸡肉产品样多重耐药沙门氏菌int1阳性检出率均较整体偏低,检出率分别为22.22%(2/9)和0%(0/3)。
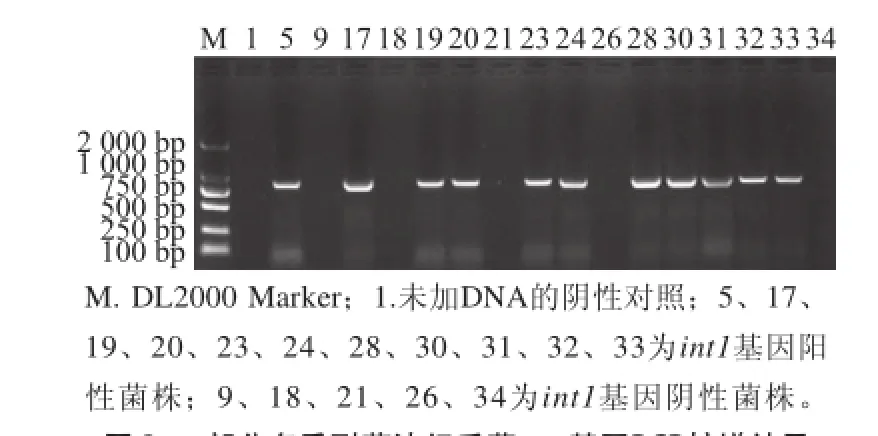
图3 部 分多重耐药沙门氏菌iinntt11基因PCR扩增结果Fig.3 PCR amplification of int1 gene from some multi-drug resista n t Salmonella isolates

图4 部分多重耐药沙门氏菌iinntt11可变区基因盒PCR扩增结果Fig.4 PCR amplification of gene cassette from some multi-drug resistant Salmonella isolates
2.3 肉鸡屠宰场多重耐药沙门氏菌磺胺类耐药基因扩增结果

表2 30 株磺胺类耐药沙门氏菌耐药谱、Ⅰ类整合子和磺胺类耐药基因Table 2 Antimicrobial resistance profile and integron-1 and sulfonamide resistant genes from 30 sulfonamide resistantSalmonneellllaa isolaatteess
选择30 株对甲氧苄啶/磺胺甲噁唑耐药的多重耐药沙门氏菌(表2),通过PCR扩增sul1、sul2和sul3基因。30 株耐药菌均能扩增出437 bp或285 bp或443 bp的条带,序列测定表明,所测条带与NCBI上公布的基因序列同源性在97%以上,本实验扩增产物为沙门氏菌磺胺类耐药基因(图5~7)。PCR结果与表型耐药100%一致,其中以sul2基因检出率最高(100%,30/30),其次是sul3基因,检出率为63.3%(19/30),sul1基因检出率最低,为40%(12/30),10 株菌同时携带sul1、sul2和sul3三种基因,2 株菌同时携带sul1和sul2两种基因,9 株菌同时携带sul2和sul3两种基因(表3)。51 株鸡粪样中沙门氏菌中有23株对甲氧苄啶/磺胺甲噁唑耐药,23 株沙门氏菌均能扩增出sul1或sul2或sul3基因,其中sul1、sul2和sul3基因的检出率分别为43.48%、100%和60.8 7%。19株屠宰加工胴体表面样中有1 株对甲氧苄啶/磺胺甲噁唑耐药,检测到sul2基因和sul3基因,未检测到sul1基因。14 株分割鸡肉产品样中有6 株对甲氧苄啶/磺胺甲噁唑耐药,6 株沙门氏菌均能扩增出sul1或sul2或sul3基因,sul1、sul2和sul3基因的检出率分别为33.33%、100%和66.67%。肉鸡屠宰场沙门氏菌不同环节磺胺类耐药基因sul1、sul2和sul3基因检出率差异不大。
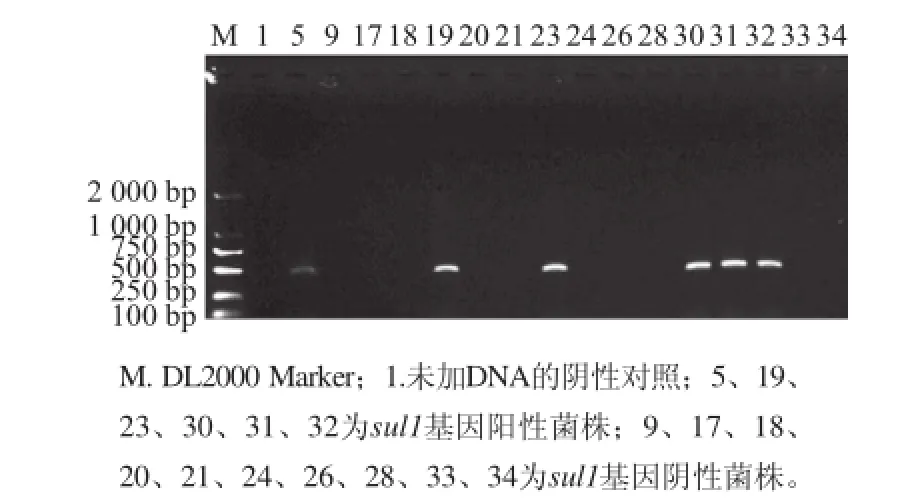
图5 部分多重耐药沙门氏菌sul1sul1基因PCR扩增结果Fig.5 PCR amplification of sul1sul1 gene from some multi-drug resistant Salmonella isolates

图6 部分多重耐药沙门氏菌sul2sul2基因PCR扩增结果Fig.6 PCR amplification of sul2 gene from some multi-drug resistant Salmonella isolat es
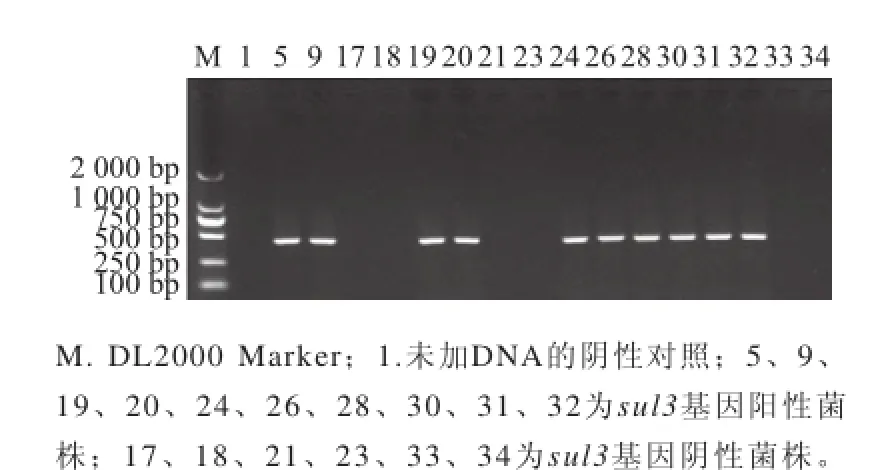
图7 部分多重耐药沙门氏菌ssuull33基因PCR扩增结果Fig.7 PCR amplification of ssuull33 gene from some multi-drug resistant Salmonella isolates

表3 多重耐药沙门氏菌磺胺类耐药基因分布与Ⅰ类整合子的关系Table 3 Distribution of sulfonamide resistant genes in multidrug resistaannccee Salmonneellllaa isolates and relation to integron-1
3 讨 论
3.1 沙门氏菌对抗菌药的耐药性
本实验84 株肉鸡屠宰场沙门氏菌对氨苄西林、萘啶酸、环丙沙星、四环素、甲氧苄啶/磺胺甲噁唑、大观霉素耐药率均较高,耐3 种及3 种以上抗生素占45.24%,对6 种抗生素耐药的菌株占11.90%,对7 种抗生素耐药的菌株占14.29%,表明该肉鸡屠宰场沙门氏菌耐药性不容乐观,肉鸡产品可能成为耐药沙门氏菌传播的重要载体。这与Zhang等[18]的研究结果相同,他对肉鸡屠宰加工生产链沙门氏菌耐药性分析认为鸡肉产品是多重耐药沙门氏菌的重要载体。鸡肉产品污染了耐药沙门氏菌,耐药菌可将耐药基因传递给人体益生菌,危害人类健康。因此,该肉鸡屠宰场应采取HACCP管理体系,控制肉鸡屠宰场沙门氏菌耐药菌株的产生及危害。
本研究中84 株沙门氏菌对氨苄西林和萘啶酸的耐药性最强,这可能与肉鸡养殖过程中相应抗生素的使用有关。朱恒文[19]对肉鸡屠宰加工生产链中沙门氏菌污染与溯源及耐药性分析,结果发现沙门氏菌对强力霉素、链霉素和四环素的耐药性最强,认为可能与肉鸡养殖过程中相应抗生素的大量使用有关。张玮等[5]对健康猪直肠粪便中沙门氏菌及姚大伟[20]、杨保伟[21]等对食源性沙门氏菌耐药性研究均表明养殖场中存在抗生素滥用现象。此外,头孢曲松是目前治疗沙门氏菌感染的有效药物,而本研究中沙门氏菌对头孢曲松已表现出较低的耐药性,说明养殖过程中可能存在持续使用该类抗生素现象,导致沙门氏菌对这些抗生素逐渐产生耐药性,这应引起重视。
3.2 沙门氏菌Ⅰ类整合子及磺胺类耐药基因
整合子作为可移动的DNA片段,为细菌耐药性传播提供了新的研究方向。本实验中多重耐药沙门氏菌Ⅰ类整合子检出率较文献报道低,进一步对其基因盒检测却全为阴性,推测其可能原因是Ⅰ类整合子在长期进化过程中将耐药基因转移到基因组上。这与张玮等[5]研究结果相同,张玮等[5]对健康猪直肠粪便中Ⅰ类整合子的研究表明20 株多重耐药沙门氏菌中,有19 株携带Ⅰ类整合子,对其基因盒进行扩增,结果只有一株扩增到基因盒(1/19),分析其可能原因是Ⅰ类整合子或转座子在长期进化过程中将耐药基因由质粒或转座子转移到基因组上。
磺胺类药物价格低,抗菌谱广,药效显著,在动物疾病防治中发挥了巨大的作用,与此同时,沙门氏菌对其产生了广泛的耐药性[11,22]。本研究中84 株沙门氏菌中有30 株对甲氧苄啶/磺胺甲噁唑耐药,占35.71%,这与邹明等[23]的报道基本一致。30 株磺胺耐药菌株均能扩增出sul1或sul2或sul3基因,但sul2基因是主要的磺胺类耐药基因,这与Antunes[3]、董洪燕[8]、廖成水[24]等研究表明sul1基因是主要的磺胺类耐药基因存在差异。这可能是由于不同地区沙门氏菌种类不同,使得耐药基因的携带情况也不同。本实验中同时携带有int1基因和磺胺类耐药基因sul的情况较为普遍,30 株对甲氧苄啶/磺胺异噁唑耐药的沙门氏菌有17 株菌int1阳性,其中,52.9%的沙门氏菌int1与sul1基因同时存在,100%的int1与sul2基因同时存在,且有4 株int1阳性菌仅携带sul2基因,70.6%的int1与sul3基因同时存在。对于sul1基因研究的比较清楚,大量研究表明[3,10,25-26],sul1基因常与qacEΔ1基因位于Ⅰ类整合子3′CS保守区。对于sul2基因的位置需要进一步确认,可能位于其他可移动元件上。Rådström等[27]研究表明sul2基因位于各种IncQ质粒和其他非结合耐药质粒。Enne等[28]研究表明sul2基因位于小的非结合质粒或大的可转移多重耐药质粒。Yau等[29]研究表明sul2基因与strA和strB有关,位于一个小的可移动、非结合的多重复制质粒上。对于sul3基因可能与qacH和mef(B)代替qacEΔ1/sul1基因位于Ⅰ类整合子3′CS保守区。Antunes等[30]研究表明sul3基因与Ⅰ类整合子3′CS qacH基因有关。因此,本实验结果表明Ⅰ类整合子与磺胺类耐药基因的传播有关,在磺胺类耐药菌株的产生中起到重要作用。
[1] 王晓泉. 不同来源多重耐药性沙门氏菌分离株的耐药机制和脉冲场电泳分析[D]. 扬州: 扬州大学, 2007.
[2] 董睿. 鸡蛋源沙门氏菌的分离鉴定及其耐药基因和毒力基因的检测[D]. 杨凌: 西北农林科技大学, 2012.
[3] ANTUNES P, MACHADO J, SOUSA J C, et al. Dissemination of sulfonamide resistance genes (sul1, sul2 and sul3) in portuguese Salmonella enterica strains and relation with integrons[J]. Americ an Society for Microbiology, 2005, 49(2): 836-839
[4] GUERRA B, SOTO S M, ARGUELLES J M, et al. Multidrug resistance is mediated by large plasmids carrying a class 1 integron inthe emergent Salmonella enterica serotype [4, 5, 12:i:-][J]. Antimicrob Agents Chemother, 2001, 45(4): 1305-1308.
[5] 张玮, 李郁, 姚健, 等. 健康猪直肠粪便中沙门菌1类整合子与耐药基因的检测[J]. 中国微生态学杂志, 2010, 22(7): 594-598.
[6] 李郁, 焦新安, 魏建中, 等. 屠宰生猪多重耐药沙门菌1类整合子与耐药基因的检测[J]. 中国人兽共患病学报, 2008, 24(4): 327-330.
[7] HUR J, KIM J H, PA RK J H, et al. Molecular and virulence characteristics of multi-drug resistant Salmonella enteritidis strains isolated from poultry[J]. The Veterinary Journal, 2011, 189(3): 306-311.
[8] 董洪燕, 缪晓斌, 李鑫, 等. 鸡白痢沙门菌分离株的耐药性及磺胺类耐药机制研究[J]. 中国家禽, 2010, 32(9): 29-33.
[9] SANDVANG D, AARESTRUP F M, JENSEN L B. Characterization of integrons and antibiotic resistance genes in Danish multiresistant Salmonella enteric Typhimurium DT104[J]. FEMS Microbiology Letters, 1998, 160: 37-41.
[10] ENNE V I, LIVERMORE D M, STEPHENS P, et al. Persistence of sulfonamide resistance in the UK despite national perscribing restriction[J]. Lancet, 2001, 357: 1325-1328.
[11] PERRENTEN V, BOERLIN P. A new sulfonamide resistance gene (sul3) in Escherichia coli is widespread in the pig population of Switzerlan[J]. Antimicrob Agents Chemother, 2003, 47: 1169-1172.
[12] 卫生部医政司. 全国临床检验操作规程[M]. 3版. 南京: 东南大学出版社, 2006: 890-923.
[13] CLSI. M100-S19 Performance standards for antimicrobial susceptibility testing[S]. Wayne, PA: Clinical and Laboratory Standards Institute, 2010.
[14] 黄金林, 焦新安, 文其乙, 等. 应用聚合酶链反应快速检测沙门氏菌[J].扬州大学学报, 2002, 23(3): 5-7.
[15] 邵碧英, 陈彬, 汤敏英, 等. 沙门氏菌DNA提取及PCR反应条件的优化[J]. 食品科学, 2007, 28(7): 331-334.
[16] CHEN S, ZHAO S, WHITE D G, et al. Characterization of multipleantimicrobial-resistant Salmonella serovars isolated from retail meats[J]. Applied and Environmental Microbiology, 2004, 70(1): 1-7.
[17] KERRN M B, KLEMMENSEN T, FRIMODT-M±LLER N, et al. Susceptibility of Danish Escherichia coli strains isolated from urinary tract infections and bacteraemia, and distribution of sul genes conferring sulphonamide resistance[J]. Journal of Antimicrobial Chemotherapy, 2002, 50: 513-516.
[18] ZHANG A Y, WANG H N, TIAN G B, et al. Phenotypic and genotypic characterization of antimicrobial resistance in faecal bacteria from 30 Giant pandas[J]. International Journal of Antimicrobial Agents, 2009, 33(5): 456-460.
[19] 朱恒文. 肉鸡屠宰加工生产链中沙门氏菌的污染与溯源及耐药性分析[D]. 合肥: 安徽农业大学, 2012.
[20] 姚大伟, 江芸, 徐幸莲, 等. 生鲜猪肉中沙门氏菌的分离、鉴定及耐药性检测[J]. 食品科学, 2012, 33(24): 210-214.
[21] 杨保伟, 盛敏, 席美丽, 等. 食源性沙门氏菌耐药性检测及相关质粒[J].微生物学报, 2008, 48(8): 1006-1012.
[22] 周万溶, 王红宁, 张安云, 等. 猪和野生动物源大肠杆菌及沙门氏菌中磺胺类药物耐药基因的检测[J]. 中国兽医科学, 2007, 37(4): 287-290.
[23] 邹明, 魏蕊蕊, 张纯萍, 等. 鸡源沙门氏菌的血清型、耐药性和耐药机制调查[J]. 农业生物技术学报, 2013, 21(7): 855-862.
[24] 廖成水, 程相朝, 张春杰, 等. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J]. 中国兽医科学, 2011, 41(7): 751-755.
[25] HAMMERUMA M, SANDVANG D, ANDERSEN S R, et al. Detection of sul1, sul2 and sul3 in sulphonamide resistant Escherichia coli isolates obtained from healthy humans, pork and pigs in Denmark[J]. International Journal of Food Microbiology, 2006, 106(2): 235-237.
[26] GUERRA B, JUNKER E, HELMUTH R. Incidence of the recently described sulfonamide resistance gene sul3 among German Salmonella enteric strains isolated from livestock and food[J]. Antimicrobial Agents and Chemotherapy, 2004, 48(7): 2712-2715.
[27] RÅDSTRÖM P, SWEDBERG G. RSF1010 and a conjugative plasmid contain sulⅡ, one of two known genes for plasmid-borne sulfonamide resistance dihydropteroate synthase[J]. Antimicrobial Agents and Chemotherapy,1988, 32(11): 1684-1692.
[28] ENNE V I, LIVERMORE D M, STEPHENS P, et al. Persistence of sulphonamide resistance in Escherichia coli in the UK despite national prescribing restriction[J]. The Lancet, 2001, 357: 1325-1328.
[29] YAU S, LIU X, DJORDJEVIC S P, et al. REF1010-like plasmids in Australian Salmonella enteric serovar Typhimurium and origin of their sul2-strA-strB antibiotic resistance gene cluster[J]. Microbial Drug Resistance, 2010, 16(4): 249-252.
[30] ANTUNES P, MACHADO J, PEIXE L. Dissemination of sul3-containing elements linked to class 1 integrons with an unusual 3’conserved sequence region among Salmonella isolates[J]. Antimicrobial Agents and Chemotherapy, 2007, 51(4): 1545-1548.
Detection of Integton-1 and Sulphonamide Resistant Genes of Multi-Drug Resistant Salmonella Species Isolated from Broiler S laughterhouse
LAI Hai-mei1, LIU Shu-liang1,2,*, ZOU Li-kou3, HAN Xin-feng1, ZHOU Kang1,2, ZHU Dong-mei1, PENG Zhen1, LI Jian-long1
(1. College of Food Science, Sichuan Agricultural University, Ya’an 625014, China; 2. Key Laboratory of Agricultural Products Processing and Preservation Engineering of Sichuan Province, Ya’an 625014, China; 3. Laboratory of Microbiolog y, Dujiangyan Campus, Sichuan Agricultural University, Dujiangyan 611830, China)
Objective: To characterize multi-drug resistant Salmonella isolates carrying integeon-1 and sulfonamides-resistant genes from broiler slaughterhouse. Methods: The susceptibility of 84 Salmonella isolates from broiler slaughterhouse to 10 varieties of antibiotics was evaluated by K-B disc method. In addition, PCR was used to detect the presence of the int1, sul1, sul2 and sul3 genes of multi-drug resistance in Salmonella isolates. Results: The resistant rates of these 84 Salmonella isolates were 100% to ampicilin and nalidixic acid, and 39.29%, 35.71%, 35.71%, 35.71%, 22.62% and 14.29% to ciprofl oxacin, tetracycline, b enzyl methyl oxygen/sulfamethoxazole, spectinomycin, fl uorine benzene nicol and gentamicin, respectively. It was found that 38 of these isolates exhibited resistance to at least three antibiotics as multi-drug resistant strains. Among the 38 multi-drug resistant Salmonella strains, 20 carried integron-1. Sulfonamide resistant genes such as sul1 or sul2 or sul3 genes were detected in 30 sulfonamides resistant Salmonella isolates, suggesting 100% consistency between the results of drug sensitivity tests and PCR. The detection rates of the sulfonamides resistant genes sul1, sul2 and sul3 genes by PCR were 40%, 100% and 63.3%, respectively. Conclusion: These results implied that the antimicrobial resistance of Salmonella isolates from broiler slaughterhouse is not optimistic. A close correlation exists between the multi-drug resistance and the carrier condition of the integron-1, which may play a critical role in the sulphonamide resistance in Salmonella isolates.
Salmonella; integron-1; multi-drug resistance; sulfonamide-resistant genes
TS201.6
A
1002-6630(2014)24-0178-06
10.7506/spkx1002-6630-201424034
2014-01-21
公益性行业(农业)科研专项(200903055)
赖海梅(1988—),女,硕士研究生,研究方向为食品微生物。E-mail:764113722@qq.com
*通信作者:刘书亮(1968—),男,教授,博士,研究方向为食品微生物与发酵工程。E-mail:lsliang999@163.com

