高产α-葡萄糖苷酶黑曲霉的微波选育及发酵条件优化
易菊阳,梁钰婷,陆 兵,吴 昊,黄桂华,陈桂光,梁智群*
(广西大学生命科学与技术学院,亚热带农业资源保护与利用国家重点实验室,广西 南宁 53000 4)
高产α-葡萄糖苷酶黑曲霉的微波选育及发酵条件优化
易菊阳,梁钰婷,陆 兵,吴 昊,黄桂华,陈桂光,梁智群*
(广西大学生命科学与技术学院,亚热带农业资源保护与利用国家重点实验室,广西 南宁 53000 4)
采用微波诱变技术对黑曲霉J2进行选育,得到1株α-葡萄糖苷酶活力较高的突变菌株ANY-4,酶活力达到305 U/mL,比 出发菌株提高了38.6%,且稳定性良好。通过单因素和正交试验得到最适培养条件为:玉米淀 粉80 g/L、玉米浆干粉40 g/L、初始pH 4.5、装液量50 mL/500 mL、接种量3%、培养温度36 ℃、摇床转速240 r/min、培养时间40 h。在最优培养条 件下进行发 酵,α-葡萄糖苷酶活力达到427 U/mL,比优化前提高了40%。
α-葡萄糖苷酶;微波诱变;黑曲霉;发酵条件优化
α-葡萄糖苷酶(α-D-glucoside glucohydrolase)又称α-葡萄糖苷转移酶,不仅能切割多糖非还原端的α-葡萄糖苷键产生α-D-葡萄糖[1],还能将低聚糖中的α-1,4-糖 苷键切开并在分子内转化成α-1,6-糖苷键[2],从而生成异麦芽糖、潘糖、异麦芽三糖等功能性糖。α-葡萄糖苷酶种类多样,广泛存在于动物、植物和微生物中,其中黑曲霉和米曲霉产酶较高[3-4]。
α-葡萄糖苷酶是生产低聚异麦芽糖的关键酶[5],而低聚异麦芽糖具有优越的理化特性和生理功能,如调节肠道有益菌群和增殖双岐杆菌[6-7]、抑制大肠杆菌[8]、提高免疫力[9],因而被广泛用于食品、医药、保健及饲料等行业。但目前国内缺少大量廉价的酶源供应,生产低聚异麦芽糖所用的α-葡萄糖苷酶不得不依赖进口,多为日本天野酶制剂公司提供[10],且价格昂贵约40万元/吨[11]。国外学者在α-葡萄糖苷酶高产菌种的选育、酶的分离纯化、酶学性质及固定化等[12-13]方面做了大量的研究工作,但国内鲜有α-葡萄糖苷酶商品化的相关报道。
从以往的文献报道来看,α-葡萄糖苷酶高产菌种的选育方式主要集中在传统的紫外诱变、氯化锂诱变、Co60诱变、离子注入诱变、化学诱变及以上多种方法的联合诱变方面[14-17],采用微波诱变技术选育α-葡萄糖苷酶高产菌株的相关报道较少。微波诱变所需设备简单、方法易行、操作安全、诱变效果较好[18-20]。本实验采用微波诱变技术,对α-葡萄糖苷酶产生菌黑曲霉J2进行诱变选育,通过优化发酵条件,以期获得酶活力大幅提高的突变菌株。
1 材料与方法
1.1 菌种、试剂与培养基
黑曲霉(Aspergillus niger)J2由本实验室成员野外筛选所得。
高温α-淀粉酶、高温β-淀粉酶 广西南宁东恒华道生物;玉米淀粉 山东西王集体淀粉厂;玉米浆干粉山东康源生物科技有限公司;葡萄糖、麦芽糖、台盼蓝美国Sigma公司;其他试剂为国产分析纯。
平板培养基:可溶性淀粉20 g/L、葡萄糖5 g/L、氯化钠35 g/L、琼脂20 g/L、台盼蓝0.2 g/L、麸皮浸汁3%(体积分数),自然pH值,121 ℃灭菌20 min。
麸皮孢子培养基:麸皮4 g、蒸馏水2 mL,250 mL三角瓶,121 ℃灭菌20 min。
初筛培养基:麸皮30 g/L(沸水熬煮30 min,4 层纱布过滤去渣)、麦芽糖200 g/L,pH 4.5,115 ℃灭菌30 min。
复筛培养基:麸皮30 g/L(沸水熬煮30 min,4层纱布过滤去渣)、玉米淀粉45 g/L,pH 4.5,115 ℃灭菌30 min。
发酵培养基:玉米淀粉45 g/L、玉米浆干粉30 g/L,pH值自然,115 ℃灭菌30 min。
1.2 仪器与设备
G80F23CN1P-G5(SO)微波炉 格兰仕微波炉电器有限公司;UV-1601紫外分光光度计 日本Shimadzu公司;HH-4 数显恒温水浴锅 国华电器有限公司;SPX-250生化培养箱 上海跃进医疗仪器厂。
1.3 方法
1.3.1 孢子悬液的制备
接2环孢子于麸皮培养基中,37 ℃培养2 d,翻曲后再培养1 d,获得孢子。再往长满孢子的三角瓶里加入适量无菌生理盐水,用无菌玻璃棒搅拌均匀。将搅拌后的混合物转移到过滤装置中,用2层纱布过滤,收集粗滤液。然后将粗滤液转移到摇床中,用玻璃珠振荡打散孢子。再用4层纱布细滤孢子液,调 整孢子浓 度至106个/mL,得孢子悬液。
1.3.2 微波诱变实验
分别将5 mL(浓度106个/mL)孢子悬液置于洁净的无菌试管中,套上试管帽。将试管斜置于装满冰水混合物的1 L烧杯内,移置微波炉中,分别在功率为160、320、480、640、800 W下进行诱变实验,每隔1 min(间隔时间由预实验确定)换冰1 次,以消除热效应对孢子的致死作用,按此方法确定辐射功率对致死率和突变率的影响。确定诱变功率后,设置辐照时间梯度1、2、3、4、5、6、7、8、9 min,考察诱变时间对致死率和突变率的影响。每次实验需将辐照后的孢子悬液置于4 ℃的冰箱避光冷藏2 h,然后再涂布平板恒温培养。
1.3.3 菌株筛选
初筛:将微波辐照后的孢子悬液分别进行10-1、10-2、10-3、10-4梯度稀释,用稀释后的悬液涂布平板,于37 ℃培养2 d,计算致死率。按高通量筛 选模型[21]对突变情况作出评价,并计算突变率。

式中:对照组不经微波辐照,实验组经微波辐照,突变菌株包括正突变菌株和负突变菌株;正突变菌株指实验组中相对于对照组酶活力提高的菌株;负突变菌株是实验组中相对于对照组酶活力降低的菌株。
摇瓶复筛:分别将初筛得到的正突变菌进行活化和孢子培养,并制备106个/mL的孢子悬液,再分别吸取2 mL接种于装液量为80 mL/500 mL复筛培养基中,于37 ℃、200 r/min培养36 h后,抽滤收集菌丝,用菌丝进行转苷反应,检测并计算酶活力。
1.3.4 突变菌株遗传稳定性评价
将复筛得到的突变菌株连续传代8 次,检测并计算酶活力,考察其遗传稳定性。
1.3.5 α-葡萄糖苷酶发酵条件优化单因素试验
1.3.5.1 碳源对酶活力的影响
以体积分数3%的麸皮浸汁为氮源,分别考察添加量为60 g/L的葡萄糖、乳糖、D-果糖、麦芽糖、木糖、蔗糖、小麦淀粉、木薯淀粉、玉米淀粉、可溶性淀粉等10 种碳源对酶活力的影响。其 中,小麦淀粉、木薯淀粉、玉米淀粉、可溶性淀粉在使用前需用高温α-淀粉酶和高温β-淀粉酶进行水解,装液量为80 mL/500 mL。确定最佳碳源后,按添加量20、30、40、50、60、70、80、90、100 g/L进行优化,接种量2%,每一梯度做3组平行,考察其对酶活力的影响。
1.3.5.2 氮源对酶活力的影响
以45 g/L的玉米淀粉为碳源,分别考察了添加量为30 g/L的氯化铵、硫酸铵、磷酸二氢铵、大豆蛋白胨、胰蛋白胨、牛肉膏、酵母膏、玉米浆干粉等8 种氮源对酶活力的影响。并对最佳氮源按添加量10、20、30、40、50、60、70、80 g/L进行优化。其装液量为80 mL/500 mL接种量为2%,每一梯度做3 组平行,考察其对酶活力的影响。
1.3.5.3 初始pH值对酶活力的影响
取500 mL三角瓶分别装入80 mL发酵培养基,用5 mol/L的NaOH溶液或盐酸溶液调节培养基初始pH值,建立pH 3.0、3.5、4.0、4.5、5.0、5.5、6.0的梯度,每个梯度3 组平行,灭菌后加入1.6 mL种子液,考察其对酶活力的影响。
1.3.5.4 装液量对酶活力的影响
取500 mL三角瓶分别装入15、30、50、80、100、120、140、160、180 mL发酵培养基,每组3 个平行样,灭菌后分别接入2%的种子液,考察其对酶活力的影响。1.3.5.5 接种量对酶活力的影响
取500 mL三角瓶分别装入80 mL发酵培养基。灭菌后按1%、2%、3%、4%、5%、6%、7%、8%、9%接入种子液,每组3 个平行样,考察其对酶活力的影响。
1.3.5.6 培养温度对酶活力的影响
取500 mL三角瓶分别装入80 mL发酵培养基,灭菌后加入1.6 mL种子液,分别考察温度28、30、32、34、37、40、42 ℃对酶活力的影响,每组3 组平行样。
1.3.5.7 摇床转速对酶活力的影响
取500 mL三角瓶若干,分别装入80 mL发酵培养基,灭菌后加入1.6 mL种子液,分别考察转速140、160、180、200、220、240 r/min对酶活力的影响,每组3组平行样。
1.3.5.8 培养时 间对酶活力的影响
取500 mL三角瓶分别装入80 mL发酵培养基,灭菌后加入1.6 mL种子液,每8 h取样检测1 次,考察培养时间对酶活力的影响。
1.3.6 α-葡萄糖苷酶发酵条件优化正交试验
通过单因素试验可发现,在较大范围内,接种量、玉米淀粉与玉米浆干粉添加量对酶活力影响较小;当摇床达到一定转速后,酶活力上升平缓。而初始pH值、装液量、培养温度和培养时间对酶活力的影响都呈现出波峰状,这表明酶活力对这些因素敏感,需严格控制。选择初始pH值、装液量、培养温度和培养时间进行正交优化,能为后续的上罐放大实验提供一定参考。基于此,进行四因素三水平正交试验设计。
2 结果与分析
2.1 微波辐照功率对黑曲霉J2的诱变效果
将黑曲霉J2孢子悬液按微波辐照方法,分别置于不同功率下进行诱变实验,其致死率和正突变率见图1。孢子辐照致死率随微波功率的递增呈现上升的趋势。随着辐照功率的不断增大,正突变率先增大后减小,当处理功率为640 W时,正突变率达到最大值80%,随后正突变率降低。因此,后续辐照实验选择640 W进行处理。

图1 微波辐照功率对致死率和突变率的影响Fig.1 Effect of microwave power on the death rate and mutation rate of spores
2.2 微波辐照时间对黑曲霉J2的诱变效果
将黑曲霉J2孢子悬浮液置于功率为640 W的微波炉中进行辐照,不同处理时间下致死率和突变率的情况见图2。

图2 微波辐照时间对致死率和突变率的影响Fig.2 Effect of microwave irradiation time on the death rate and mutation rate of spores
由图2可知,在640 W辐照条件下,孢子致死率随着辐照时间的延长呈上升趋势,在0~2 min致死幅度较小,2~6 min致死幅度明显加大,6~9 min致死幅度降低但总体致死率很高。辐照6 min时致死率达到了87%,辐照9 min时致死率高达98%。孢子正突变率随辐照时间的增加,呈现先增长后降低的趋势。辐照5 min时正突变率达到了84%,辐照6 min时正突变率达到了最大值89%。因此,选择6 min为最佳微波辐照时间。
2.3 突变菌株遗传稳定性比较
通过对5 872 株菌进行初筛,并对56 株菌进行复筛得到4 株酶活力相对较高的突变菌株,编号命名为ANY-1、ANY-2、ANY-3和ANY-4。将该4株突变菌株与原菌J2对照进行遗传稳定性实验。其结果见图3。
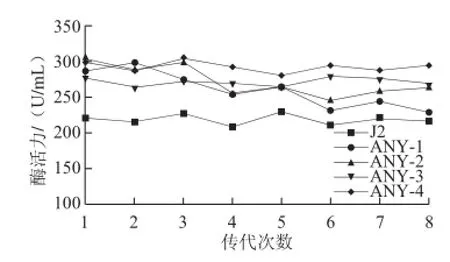
图3 突变菌株遗传稳定性Fig.3 Genetic stabili ty of the mutant strains
由图3可知,4 株突变菌株的总体酶活力高于出发菌株J2,但ANY-1和ANY-2在传代的过程中酶活力波动较大且呈下降趋势,ANY-3和ANY-4传代过程中酶活力相对稳定。相比较而言ANY-4总体酶活力集中在300 U/mL,显然高于ANY-3的酶活力,且表现出良好的稳定性。因此,ANY-4即为最终筛选所得的目的菌株。
2.4 发酵条件优化结果
2.4.1 碳源对酶活力的影响

图4 碳源种类(A)及玉米淀粉添加量(B)对酶活力的影响Fig.4 Effects of carbon sources (A) and corn starch concentration ( B) on α-glucosidase activity
由图4A可知,不同碳源对ANY-4产α-葡萄糖苷酶酶活力影响明显。以麦芽糖、木薯淀粉、玉米淀粉和可溶性淀粉为碳源时,ANY-4酶活力较高,其中以玉米淀粉作为碳源时酶活力达到最高值305 U/mL。由图4B可知,ANY-4酶活力随着玉米淀粉添加量的增加先上升再趋于平稳最后呈现下降趋势,其中添加量在40~90 g/L时酶活力相对较高,当添加量大于90 g/L时酶活力出现降低趋势。因此,应选玉米淀粉作为最佳碳源,其最佳添加量为80 g/L。
2.4.2 氮源对酶活力的影响
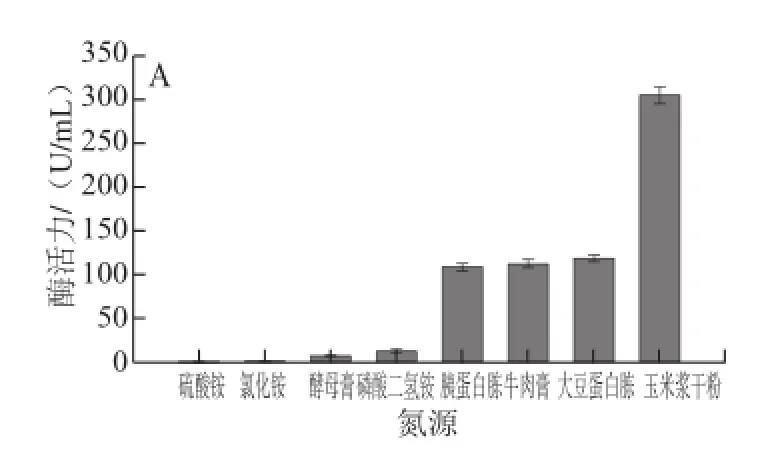

图5 氮源种类(A)及玉米浆干粉添加量(B)对酶活力的影响Fig.5 Effects of nitrogen sources (A) and corn steep liquor concentration (B) on α-glucosidase activity
由图5A可知,不同氮源对ANY-4产α-葡萄糖苷酶酶活力影响较大。在所考察的多种氮源中,玉米浆干粉对ANY-4产酶有明显的促进作用,其酶活力可达到308 U/mL。以氯化铵、硫酸铵、磷酸二氢铵、酵母膏等为氮源,ANY-4酶活力很低。由图5B可知,酶活力随玉米浆干粉添加量的增加先升高后降低,添加量在40~60 g/L时酶活力相对较高且趋于平稳,最高酶活力达到了348 U/mL。因此,选用添加量为40 g/L的玉米浆干粉作为最佳氮源。
2.4.3 初始pH值对酶活力的影响

图6 初始pH值对酶活力的影响Fig.6 Effect of initial pH on α-glucosidase activity
由图6可知,不同初始pH值对ANY-4产α-葡萄糖苷酶酶活力影响明显。随着初始pH值不断加大,酶活力先增加后降低,当pH值在4~5范围内表现出较高酶活,其中最高酶活力达到了363 U/mL。当pH>5时,酶活力大幅度降低。因此,pH 4.5为ANY-4菌株最适pH值。
2.4.4 装液量对酶活力的影响
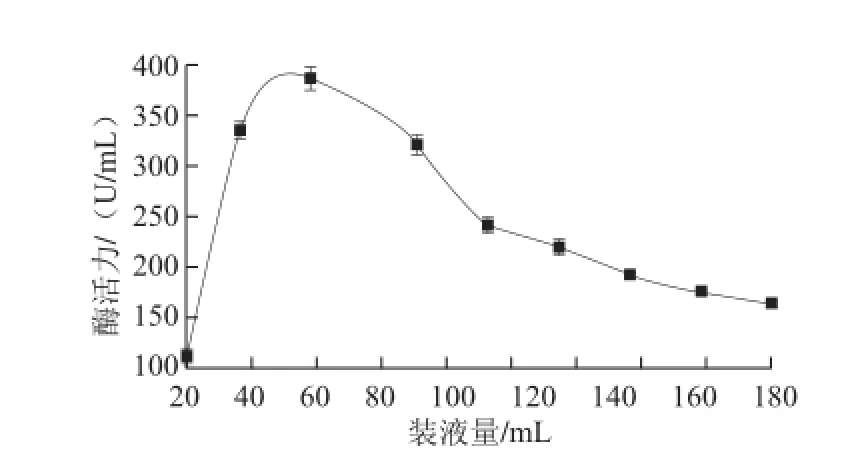
图7 装液量对酶活力的影响Fig.7 Effect of fermentation medium volume on α-glucosidase activity
由图7可知,装液量过小或过大都不利于产酶,最佳装液量为50 mL/500 mL。装液量过小,培养基养料相对不足,难以满足菌生长所需;装液量过大,阻碍了发酵过程中的通气和溶氧,致使菌体生长缓慢、产酶过低。
2.4.5 接种量对酶活力的影响
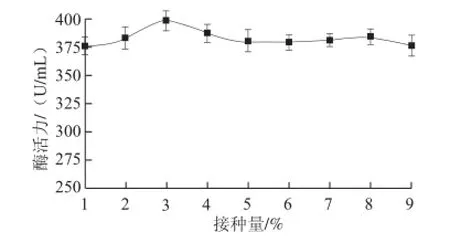
图8 接种量对酶活力的影响Fig.8 Effect of inoculum volume on α-glucosidase activity
由图8可知,接种量从1%到9%对酶活力的影响总体不大,当接种量为3%时有最大酶活力398 U/mL。因此,确定3%为摇瓶发酵最佳接种量。
2.4.6 发酵温度对酶活力的影响
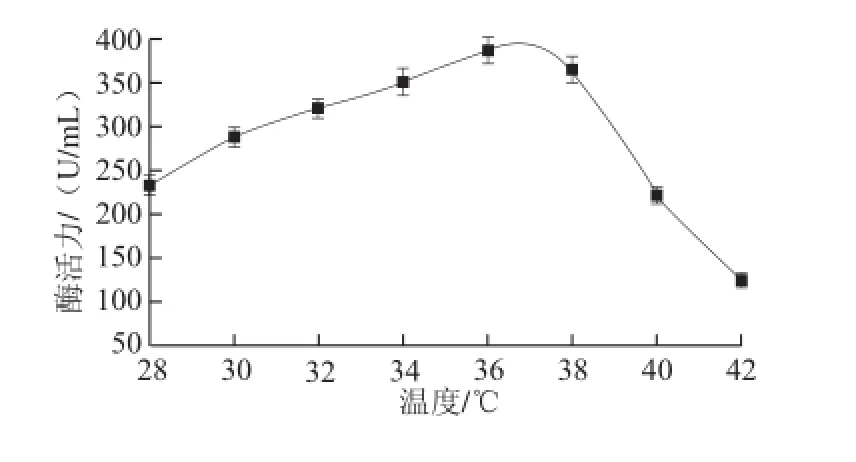
图9 发酵温度对酶活力的影响Fig.9 Effect of fermentation temperature on α-glucosidase activity
由图9可知,随着发酵温度不断升高,酶活力先升高后降低,在36 ℃时酶活力达到最大值387 U/mL。发酵温度从28 ℃提高到36 ℃的过程中,酶活力上升幅度明显。当发酵温度高于38 ℃后,酶活力迅速降低,42 ℃酶活力低至123 U/mL。因此,最佳发酵温度为36 ℃。
2.4.7 摇床转速对酶活力的影响
由图10可知,随着摇床转速的提高,酶活力呈现上升的趋势,当转速提高到240 r/min时酶活力达到392 U/mL。由于实验室摇床转速的限制,无法获知更高转速条件下酶活力的变化趋势,基于黑曲霉为好氧菌的特性,因此做出以下推断:当摇床转速继续增大时,酶活力还会相应提高,但任何一个发酵体系其溶氧量是有限的,因此当摇床转速提高到其饱和溶氧量后酶活力不再上升,达到最大值。
2.4.8 培养时间对酶活力的影响
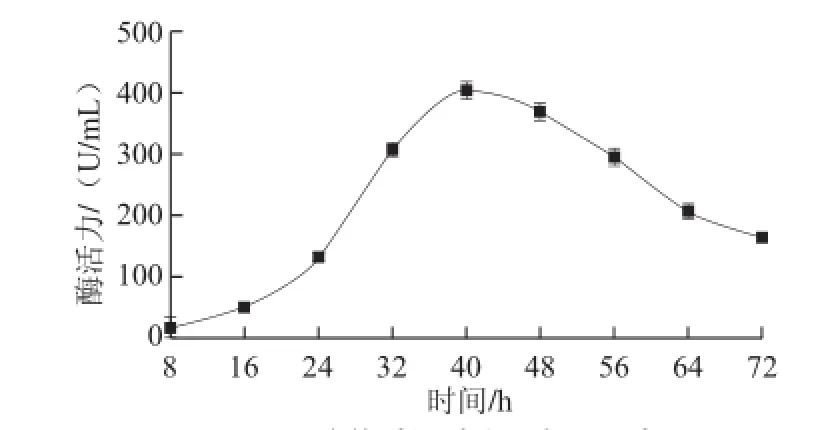
图11 培养时间对酶活力的影响Fig.11 Effect of cultivation time on α-glucosidase activity
由图11可知,随着培养时间的增加,酶活力先上升后下降,在培养40 h左右出现最大酶活力。
2.5 正交优化试验结果
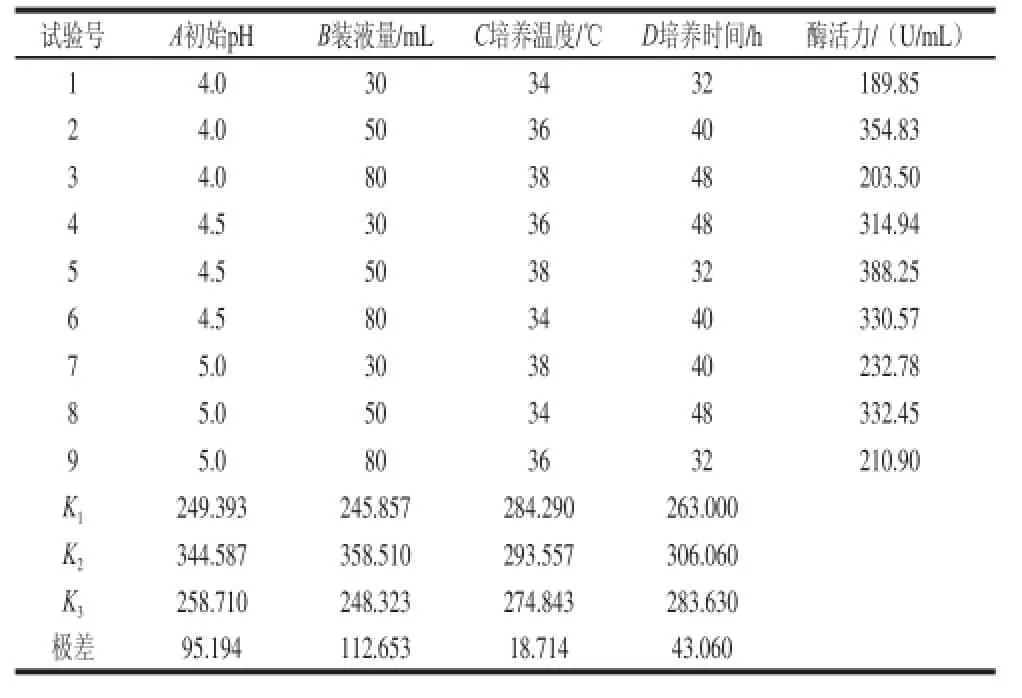
表1 正交试验设计与结果Table 1 Results and range analysis of orthogonal array design experiments for optimizing fermentation conditions of ANY-4

表2 正交试验结果方差分析Table 2 Variance analysis of orthogonal array design experiments for optimizing fermentation conditions of ANY-4
由表1极差分析结果可知,影响发酵产α-葡萄糖苷酶的因素依次为:装液量>初始pH值>培养时间>发酵温度。优选组合为A2B2C2D2,在此条件下进行发酵,酶活力可达到427 U/mL。由表2方差分析结果可知,初始pH值和装液量对酶活力的影响显著,培养时间和温度影响不显著。菌株ANY-4产α-葡萄糖苷酶最适条件为:玉米淀粉80 g/L、玉米浆干粉40 g/L、初始pH 4.5、接种量3%、装液量50 mL/500 mL、36 ℃、240 r/min、培养40 h。
3 讨论与结论
微波是一种穿透力极强的电磁波,能使水分子、核苷酸等极性分子高速旋转。在2 450 MHz频率下,微波能使水分子在1 s内180°来回转动24.5×108次,由于分之间的强烈摩擦,使得细胞内DNA分子的氢键和碱基受损,从而导致遗传变异。微波诱变育种在很多领域已经取得一定成效。潘丽霞等[22]利用微波诱变成功选育出1株利用木糖产油酵母,其产油能力是原始菌株的2.56 倍。王勇等[23]采用微波诱变技术对啤酒酵母出发菌株SY-9进行处理,得到1 株适量低产SO2的新菌株。朱莉娜等[24]采用微波诱变技术对啤酒酵母进行诱变,得到1株适量低产高级醇啤酒酵母新菌株。梅林等[25]对枯草芽孢杆菌菌株进行微波诱变处理,得到1 株稳定性良好菌株,凝乳酶活力达到516.12 U/g,比出发菌株提高了29%。马勇等[26]通过微波诱变成功选育出1 株产油酵母菌。徐伟等[27]利用微波辐照诱变成功选育了1 株高产橙色素且性状稳定的红曲霉菌。因此,利用微波诱变对α-葡萄糖苷酶高产菌株进行选育具有可行性。
本实验采用微波诱变技术对黑曲霉J2进行诱变。通过初筛、复筛及稳定性实验,从而获得了一株名为ANY-4,酶活力较高且遗传稳定的优良菌株。其 酶活力达到了305 U/mL,相对出发菌株220 U/mL的酶活力提高了38.6%。后经单因素试验和正交优化试验,酶活力进一步提高到427 U/mL,相对优化前提高了40%,优化效果明显。因此,微波诱变能有效选育出高产α-葡萄糖苷酶的黑曲霉菌株。
[1] CHIBA S. Molecular mechanism in alpha-glucosidase and glucoamylse[J]. Bioscience Biotechnology and Biochemistry, 1997, 61(8): 1233-1239.
[2] 黄金莲, 黄秀娟, 钟振声. α-转移葡萄糖苷酶的转苷作用机理探究[J]. 食品工业科技, 2012, 33(7): 108-111.
[3] KATO N, MURAKOSHI Y, KATO M, et al. Isomaltose formed by alpha-glucosidases tiggers amylase induction in Aspergillus nidulans[J]. Current Genetics, 2002, 42(1): 43-50.
[4] GOFFIN D, WATHELET B, BLECKER C, et al. Comparisom of the glucooligosaccharide profiles produced from maltose by two different transglucosidase from Apergillus niger[J]. Biotechnologie, Agronomie, Société et Environnement, 2010, 14(4): 607-616.
[5] KURIKI T, YANASE M, HIROKI T, et al. A new way of producing isomalto-oli gosacchar ide syrup by using the transglycosylation reaction of neopullulanase[J]. Applied and Environmental Microbiology, 1994, 59(4): 953-959.
[6] 付萍, 冉陆, 赵熙, 等. 不同剂量异麦芽低聚糖调节人体肠道菌群的试验研究[J]. 中国微生态学杂志, 1999, 11(4): 198-199.
[7] 于立梅, 白卫东, 冯卫华, 等. 富含低聚异麦芽糖的酥心糖研制及其对肠道菌群增值研究[J]. 现代食品科技, 2012, 28(10): 1340-1344.
[8] 王少光, 张晓峰, 韩萍, 等. 低聚异麦芽糖对小鼠肠道菌群及其代谢产物的影响[J]. 河南工业大学学报, 2012, 33(5): 75-78.
[9] 冯敏山, 李素芬, 李蕴玉, 等. 微生物态制剂和异麦芽低聚糖对产蛋鸡产蛋性能和免疫力的影响[J]. 中国饲料, 2007(20): 6-10.
[10] 童星, 唐秋嵩, 吴玉飞, 等. 黑曲霉α-葡萄糖苷酶基因的克隆及其在毕赤酵母中的表达[J]. 微生物学报, 2009, 49(2): 262-268.
[11] 孙永红. 臭曲霉产α-转移葡萄糖苷酶液体发酵条件及酶学性质研究[D].上海: 华东师范大学, 2010.
[12] MUSLIN E H, KANIKULA A M, CLARK S E M, et al. Overexpression, purification, and characterization of a barley α-glucosidase secreted by Pichia pastoris[J]. Potein Expression and Purification, 2000, 18(1): 20-26.
[13] MENDIS M, MENDOZA B R, SIMESK S. Covalent Immobilization of transglucosidase onto polymer beads for production of isomaltooligosaccharides[J]. Catalysis Letters, 2012, 142(9): 1107-1113.
[14] 陈桂光, 管立忠, 李玮, 等. α-葡萄糖苷酶高产菌株诱变育种的研究[J].现代食品科技, 2007, 23(7): 19-21.
[15] 林永贤, 曹伟锋, 计立杰, 等. α-葡萄糖苷酶菌株的选育及其产酶条件的研究[J]. 发酵科技通讯, 2008, 37(2): 10-13.
[16] 陈桂光, 李玮, 齐辉连, 等. 黑曲霉低聚异麦芽糖高产菌株的诱变选育[J]. 食品工业科技, 2011, 32(8): 185-187.
[17] 吴孔阳, 齐宗献, 黄桂华, 等. 一株产α-葡萄糖苷酶菌株的鉴定和选育[J]. 食品研究与开发, 2012, 33(12): 145-149.
[18] 覃拥灵, 李涛, 梁智群, 等. 微波诱变选育酯酶高产菌株[J]. 河池学院学报, 2006, 26(5): 54-56.
[19] 姚笛, 王艳丹, 杨健, 等. 微波诱变法筛选木聚糖酶高产球毛壳霉菌株[J]. 中国生物制品学杂志, 2012, 25(3): 375-377.
[20] 邵淑娟, 李铁柱, 李倬林, 等. 产凝乳酶黑曲霉JG的微波诱变育种研究[J]. 中国酿造, 2010, 29(7): 47-50.
[21] CHEN Guiguang, LI Wei, ZHANG Yunkai, et al. A high-throughput method for screening of Aspergillus niger mutants with high transglycosylation activity by detecting non-fermentable reducing sugar[J]. World Journal of Microbiology and Biotechnology, 2010, 27(6): 1519-1523.
[22] 潘丽霞, 杨登峰, 黄世勇, 等. 利用木糖产油酵母的微波诱变育种[J].中国酿造, 2009, 28(3): 42-64.
[23] 王勇, 程殿林, 尹明浩, 等. 微波诱变选育适量低产SO2啤酒酵母菌株[J]. 酿酒科技, 2009(11): 31-34.
[24] 朱莉娜, 程殿林, 尹明浩, 等. 微波诱变选育低产高级醇啤酒酵母菌株[J]. 青岛大学学报, 2011, 26(2): 79-84.
[25] 梅林, 陈芳, 阚睿, 等. 枯草芽孢杆菌凝乳酶高产菌株的微波诱变[J].食品与发酵工业, 2012, 38(10): 120-122.
[26] 马勇, 陈秀莉, 张应龙, 等. 一株产油酵母菌的微波诱变选育[J]. 广东农业科学, 2013(6): 118-123.
[27] 徐伟, 范志诚, 刘艳华. 微波辐照诱变选育高产橙色素红曲霉菌[J].食品科学, 2010, 31(23): 224-227.
Microwave Breeding of Aspergillus niger with High α-Glu cosidase Activity and Optimization of Its Fermentation Conditions
YI Ju-yang, LIANG Yu-ting, LU Bing, WU Hao, HUANG Gui-hua, CHEN Gui-guang, LIANG Zhi-qun*
(State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources, College of Life Science and Technology, Guangxi University, Nanning 530004, China)
α-Glucosidase is the key enzyme involved in the production of isomaltoligosaccharides which are widely applied in the food, medicine, health care and feed industries. A mutant Aspergillus strain named ANY-4, with high α-glucosidase activity and good genetic stability, was obtained from Aspergillus niger J2 via micro wave-induced mutation. Its enzymatic activity was 305 U/mL, which was 38.6 % higher than that of Aspergillus niger J2. To produce α-glucosidase with a high yield, single factor experiments and orthogonal array design methods were performed to determine the optimal fermentation conditions as follows: corn starch 80 g/L, corn steep liquor powde r 40 g/L, initial pH 4.5, fermentation medium volume 50 mL in 500 mL flasks, i noculum quantity 3% (V/V), 36 ℃, 240 r/min and fermentation for 40 h. Under these conditions, the α-glucosidase activity was 427 U/mL, which was increased by 40% as compared to that obtained before optimization.
α-glucosidase; microwave mutagenesis; Aspergillus niger; optimization
Q815
A
1002-6630(2014)15-0145-06
10.7506/spkx1002-6630-201415030
2013-10-10
国家高技术研究发展计划(863计划)项目(2006AA10Z339);国家自然科学基金地区科学基金项目(20362001)
易菊阳(1987—),男,硕士研究生,研究方向为微生物工程。E-mail:jyyi2011@163.com
*通信作者:梁智群(1959—),男,教授,博士,研究方向为食品微生物。E-mail:zqliang@gxu.edu.cn

