海水养殖环境中拟除虫菊酯类农药降解菌的分离鉴定及降解特性研究*
孙爱丽 刘菁华 史西志 张蓉蓉 肖婷婷 李德祥 陈 炯 唐道军
(宁波大学海洋学院 应用海洋生物技术教育部重点实验室 宁波 315211)
拟除虫菊酯类农药是一类高效广谱农药,经常用于渔业生产上杀灭寄生虫和敌害生物,但由于没有指导性用量及养殖用户缺乏科学理论知识,在清塘时使用违禁、不规范、盲目大量使用药物的现象普遍存在,导致近海海域水环境和沉积物中农药残留污染(王帅等,2013)。目前,越来越多的研究表明,该类农药对人类等非靶标生物产生相当大的威胁,具有内分泌干扰、免疫和神经毒性等多种潜在毒性,对鱼、贝和甲壳类等水生生物毒性较大,尤其是存在于沉积物中的农药降解速度较慢。且该类农药属亲脂性农药,易被水生生物富集,对水体生态系统、水产品质量和人类健康产生严重影响(Almakkawyet al,1999;于蓉蓉等,2009;魏华等,2010)。因此,为实现绿色健康养殖和保障人类健康,以生物修复为理论基础的农药残留降解技术,由于具有降解速度快、降解过程为自然过程的强化,不会导致二次污染和污染物的转移,可使环境中的污染物减少到最小程度等优点(Liet al,2007;Honget al,2010),已引起了越来越广泛的关注,成为当前的一个研究热点。
目前,国内外已有不少学者对环境中拟除虫菊酯类农药残留的微生物降解进行了研究报道,Rangaswamy等(1992)研究发现土壤中的某些细菌对氯氰菊酯和氰戊菊酯农药具有降解作用;虞云龙等(1999)从农药厂的废水中分离得到一株光谱农药降解菌,对氰戊菊酯、溴氰菊酯、甲基对硫磷和对硫磷等具有降解功效;Grant等(2002)从使用拟除虫菊酯类农药的土壤中分离得到拟除虫菊酯类农药降解菌,并对其生长限制因子进行了研究;Chen等(2012)研究表明,蜡状芽孢杆菌Bacillus cereusZH-3和金色链霉菌Steptomyces aureusHP-S-01组成的复合菌群可充分利用氯氰菊酯,降解较彻底。对于拟除虫菊酯类农药降解产物的研究也有少量报道,Stratton等(1982)报道分离的降解菌降解产物通常比农药本体的毒性更小,但是 CYP恰恰相反,其本体相对无毒,降解产物中有2—5种毒性更强;Lin等(2011)报道分离的菌株——链霉菌Streptomycessp.HY-S-01可通过水解酶的作用降解CYP,产生间苯氧基苯甲酸和二氯菊酸。总体来看,国内外对拟除虫菊酯类农药降解菌的研究主要集中在菌株的筛选、分离、鉴定及其降解特性方面,对近海水环境及沉积物中拟除虫菊酯类农药降解菌的筛选、降解机制等尚未有系统研究。本论文通过筛选、分离获得一株能高效降解拟除虫菊酯类农药的海洋降解菌HS-10,采用生理生化和16S rDNA的序列比对方法对其进行初步鉴定,并分别研究了 pH、温度和不同农药浓度对菌株HS-10降解特性的影响,进一步通过发光细菌和核磁共振(NMR)对菌株降解产物的毒性变化和成分进行了研究。本研究可为建立有效地去除海水养殖环境中拟除虫菊酯类农药残留的微生物修复技术,保护近海环境、治理养殖环境农药残留污染和保障食品安全提供理论和技术支持。
1 材料与方法
1.1 仪器与试剂
联苯菊酯(BIF)、氟氯氰菊酯(CYF)、氯氰菊酯(CYP)、氰戊菊酯(FEN)和溴氰菊酯(DEL)购自 Dr.Ehrenstorfer GmbH(Augsburg,德国)。
营养培养基:蛋白胨5.0g,磷酸高铁0.01g,酵母膏1.0g,过滤海水1000mL,pH 7.6—7.8。
富集培养液:在营养培养基中加入 CYP、DEL乳液,使CYP、DEL终浓度分别为100mg/L。
仪器:GC-2010型气相色谱仪(日本岛津),Microtox Model 500毒性检测仪(美国 SDI),核磁共振仪(Bruker NA 400,德国)。
1.2 拟除虫菊酯类农药降解菌的分离、筛选
将500mL海水过滤、富集后的样品加入到100mL含有CYP、DEL各100mg/L的灭菌富集培养液中,于28°C、180r/min摇床培养 7d后,按 10%接种量转移到含2种拟除虫菊酯类农药各100mg/L的富集培养液中,继续培养 7d,重复上述步骤连续富集培养 3次,取0.1mL培养液进行平板划线分离、纯化,直到筛选得到单个菌落,将其接种到试管斜面培养基上,于4°C低温保存。
将分离得到的各个菌株制成菌悬液,以相同接种量(OD600= 0.2)加入到100mL富集培养液中,做3个平行试验,28°C摇床中180r/min培养7d后,测定拟除虫菊酯类农药的残留量,以不接菌的培养液为对照,采用式(1)计算农药的降解率。

式中,W0为空白对照中农药的含量;Wt为接菌的培养液中农药的残留量。
1.3 菌种鉴定
利用常规方法进行革兰氏染色观察,根据常用细菌鉴定手册对菌株进行生理生化试验(Bridgeet al,1993),通过扫描电子显微镜观察菌株 HS-10的细胞形态。取对数生长期的新鲜菌液,3000r/min离心收集菌体,提取基因组 DNA作为扩增模版;采用细菌通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1541R(5′-ACGGCTACCTTGTTACGACT-3′)(孙苏燕等,2009)进行PCR扩增;PCR反应条件:94°C预变性2min;循环扩增 35 次:94°C 30s,60°C 30s,72°C 1min;72°C延伸 10min。PCR产物经琼脂糖凝胶电泳回收后,双向测序,通过BLAST进行同源性比较。
1.4 拟除虫菊酯类农药的检测
1.4.1 样品前处理 准确量取菌液 1.0mL,加入0.4g氯化钠、4.0mL正己烷/丙酮(1 :1,V/V)混合液,涡旋1min,3000r/min离心10min,取上清液;然后加入2.0mL正己烷/丙酮(1 :1,V/V),重新提取1次;将获得的上清液加入 0.4g无水硫酸钠,涡旋混匀,3000r/min离心5min,取3.0mL上清液,40°C氮气吹干后,加入1.0mL异辛烷/丙酮(9 :1,V/V)溶解,0.22 μm滤膜过滤后,GC-ECD分析,实验做3个平行。
1.4.2 色谱条件 SPB-5石英弹性毛细管柱(30m×0.25mm×0.25μm);ECD 检测器;色谱柱温 150°C(5min),40°C /min;240°C(10min),5°C/min;260°C(3min);检测器温度 320°C,进样口温度 280°C,进样量为1.0μL,柱流量1.0mL/min;分流比为1 :30;载气为N2(99.999%),采用外标法计量。
1.5 降解条件的优化
培养温度:培养温度分别为 20°C、28°C 和 35°C,液体培养基(CYP和DEL浓度为100mg/L)初始pH为7.6,摇床转速 180r/min,在此培养条件下,测定菌株HS-10在7d后的降解率。
初始 pH:液体培养基(CYP和 DEL的浓度为100mg/L)的初始pH分别为4.0、5.0、6.0、7.0和8.0,恒定温度28°C,摇床转速180r/min,测定菌株HS-10在7d后的降解率。
不同初始浓度:液体培养基中CYP和DEL初始浓度分别为100、200、400、600、800mg/L,分别接入处于对数生长期的菌液,在温度28°C、pH 7.0、摇床转速180r/min条件下培养,测定菌株HS-10在7d后的降解率。
每个处理设置3个平行。
1.6 菌株降解产物分析
将菌株HS-10接种于含100mg/L CYP或DEL的液体培养基中,于28°C、180r/min摇床培养7d后,按“1.4.1 样品前处理”步骤提取降解产物后,溶于1.0mL氘代丙酮(CD3COCD3)中,以四甲基硅烷作为内标,经NMR分析。
1.7 菌株降解产物毒性分析
将菌株HS-10接种于含100mg/L CYP或DEL的灭菌液体培养基中,于 28°C、180r/min摇床培养 7d后,取2.0mL菌液3000r/min,离心10min,取上清液通过Microtox Model 500 Toxicity Analyzer System进行毒性分析,以不接菌的培养液为对照,做3个平行实验,采用式(2)计算发光抑制率。
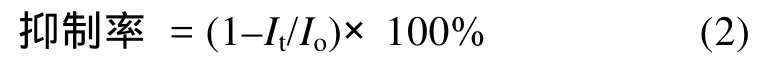
式中,Io为初始发光强度;It为样品发光强度。
2 结果
2.1 拟除虫菊酯类农药降解菌株 HS-10的分离、筛选及特性分析
经分离、筛选获得1株具有高效CYP和DEL降解能力的菌株,命名为 HS-10。生物学特性为:革兰氏染色阴性(图1),为杆菌(图2),精氨酸双水解试验、赖氨酸脱羧酶试验、柠檬酸盐试验、鸟氨酸脱羧试验、尿素酶试验阳性,V-P反应、H2S反应、明胶液化实验阴性,可以利用蔗糖。在固体培养基上,菌落圆形、凸起,边缘完整,呈灰白色,半透明。

图1 菌株HS-10的革兰氏染色显微镜图片Fig.1 Microscopic image of strain HS-10 after Gram-staining

图2 菌株HS-10的扫描电镜图Fig.2 Scanning electron microscopic photography of strain HS-10
为进一步鉴定HS-10,在生理生化分析的基础上,以16S rDNA(邓先余等,2009)通用引物27F和1541R进行PCR扩增(孙苏燕等,2009),提交GenBank数据库中注册得到序列号为JX087926。经BLAST同源性比对发现,该菌株的16S rDNA与假交替单胞菌相似度最高,进一步结合形态学和生理生化特征可初步鉴定该菌株为假交替单胞菌(Pseudoalteromonassp.)。
2.2 菌株HS-10降解条件的优化
2.2.1 温度对菌株 HS-10生长及降解效率的影响温度作为微生物生长及代谢的重要因子,在适宜的温度范围内,微生物通常表现出较快的生长和代谢速率,因此,试验首先设定不同培养温度,考察菌株HS-10的生长速率和降解性能。由图3可以看出,在20°C和28°C培养条件下,菌株HS-10在富集培养基中前4天生物量增长较快,后达到稳定期,继续培养,其生物量则出现降低趋势;进一步通过图4的降解曲线可以看出,菌株HS-10对CYP和DEL的降解主要集中在对数生长期(1—4d),这是因为该时期菌株对碳源的需求量较大,因此对CYP和DEL的降解更快;而随着培养基中的碳源和氮源逐渐减少及菌株代谢产物的积累,导致菌体的生长受到抑制,对 CYP和DEL的降解效率随之减少。同时,结果表明,当培养温度为 35°C时,由于高温影响菌株的生长,其生长相对较缓慢,同时,CYP和DEL的降解效率有所下降,表明高温对菌株的降解效率有较大影响。其中,28°C培养时菌株 HS-10的生长及降解效率明显优于其它温度,对 CYP和 DEL的降解率分别为 62.1%和88.5%。由此可知,菌株HS-10降解CYP和DEL的最佳温度为28°C。

图3 不同温度下菌株HS-10的生长曲线Fig.3 The growth curves of strain HS-10 at different temperature

图4 温度对CYP和DEL降解率的影响Fig.4 The effect of temperature on CYP and DEL degradation rate a.20°C;b.28°C;c.35°C
2.2.2 培养液初始 pH对菌株 HS-10生长及降解效率的影响 菌株HS-10在不同初始pH的液体培养基中的生长及降解效率见图5、图6。从图中可以看出,菌株HS-10对pH的耐受性较为宽泛,在4.0—8.0范围内可良好生长,且对CYP和DEL的降解率均高于50%。与酸性培养条件相比,菌株HS-10在pH 7.0和pH 8.0时具有更大的生物量,对CYP和DEL具有更大的降解效率,尤其当pH 7.0时,对CYP和DEL的降解率分别为75.6%和90.9%。由此可知,菌株HS-10在碱性条件下能更好地生长,表现出更大的降解活性,其降解CYP和DEL的最佳pH为7.0。

图5 初始pH对菌株HS-10生长的影响Fig.5 The effect of initial pH on growth of strain HS-10

图6 初始pH对CYP和DEL降解效率的影响Fig.6 The effect of initial pH on CYP and DEL degradation rate
2.2.3 不同初始浓度CYP和DEL的降解效率 将菌液以10%的接种量在无菌条件下转入100mL初始浓度分别为 100、200、400、600、800mg/L的 CYP和DEL培养液中,在180r/min、28°C、pH 7.0条件下分别养 7d后,测定 CYP和 DEL的降解率。由图7可知,CYP和DEL初始浓度的变化对菌株的降解性能有一定的影响,随着初始浓度的增加,HS-10对CYP和DEL的降解率呈下降趋势,但当CYP和DEL初始浓度低于 200mg/L时,菌株 HS-10对 CYP和DEL仍保持相对较高的降解率,分别为 47.5%和65.2%。同时研究发现,初始浓度在100—400mg/L范围内时,菌株HS-10对CYP和DEL的绝对降解量随其初始浓度的增加而增大,但是随着初始浓度的进一步增加,HS-10对CYP和DEL的绝对降解量呈下降趋势,表明较高的初始浓度可能对菌株的生长和降解性能产生抑制,当初始浓度高于 400mg/L时,CYP和DEL的降解率和降解量显著降低。

图7 菌株HS-10对不同初始浓度CYP和DEL的降解率和降解量Fig.7 Biodegradation rate and quantity of CYP and DEL at different initial concentrations by strain HS-10
2.3 菌株HS-10降解产物分析
将有毒有害污染物通过微生物降解转化为无毒无害的物质,是污染物生物修复的核心。研究表明,拟除虫菊酯类农药的微生物降解途径主要包括氧化、还原、水解等过程,代谢比较复杂,降解产物种类较多,性质各异(Talluret al,2008),因此,为充分评价菌株HS-10降解产物的毒性,本研究采用发光细菌和NMR的方法对CYP和DEL降解产物的特性进行了分析。
当发光细菌接触有毒有害物质时,可影响其正常的新陈代谢,从而使它的发光强度受到抑制,利用发光细菌的发光强度受抑制的程度与物质的毒性大小呈正相关的特性,可实现对农药及其降解产物的毒性效应评价。结果表明(表1),浓度为 100mg/L的CYP和 DEL溶液(发光抑制率分别为90.3%±6.1%),降解后产物对发光细菌的抑制大大降低(发光抑制率36.9%±3.4%),表明CYP和DEL经菌株HS-10降解后,其毒性显著降低。

表1 CYP和DEL降解前后发光抑制率(n=3)Tab.1 The light inhibition ratio of CYP and DEL before and after degradation(n=3)
进一步采用核磁共振对CYP和DEL降解前后的产物进行研究,如图8所示,经HS-10处理的农药样品,其核磁共振图谱发生了明显变化,谱峰显著减小,尤其是化学位移δ= 3.70处的谱峰消失,表明CYP和DEL被菌株HS-10降解,其降解过程主要为分子中酯键的断裂。

图8 CYP、DEL及其降解产物的1H NMR波谱Fig.8 1H NMR spectrums of CYP,DEL and their degradation products
3 讨论
拟除虫菊酯类农药作为人工合成的一类杀虫剂,由于具有高效、广谱、对温血动物等非靶标生物毒性相对较低等特点,近年来使用量稳步上升,导致流失到环境中的农药残留总量增加(张松柏等,2009;刘丽等,2013)。通常,自然条件下农药的降解方式主要有生物降解、光化学降解和化学降解等(李玲玉等,2010),然而,目前使用的拟除虫菊酯类农药有些具有较强的光、热稳定性,且大多数农药残留进入水体沉积物中,由于沉积物环境具有避光、缺氧等特点,农药往往更加不易降解、持久性增强(Liuet al,2005),因此,微生物降解是海水养殖环境中农药污染修复的有效方式。
大多数研究表明,获得的降解菌株通常仅针对一种或少数几种拟除虫菊酯类农药,并对高浓度农药表现较低的耐受性,尤其是生物降解的实质是酶促反应,单一微生物在降解农药时通常不具备生物降解所需的全部酶系,不能完全矿化农药残留,往往会产生有毒的代谢产物,对菌体的生长及降解性能产生影响(李青云等,2009;廖敏等,2009)。为此,本实验采用发光细菌方法对菌株 HS-10降解产物的毒性情况进行了研究,并结合GC-ECD和NMR方法对HS-10的降解特性进行了分析,结果表明其降解产物毒性大大降低,未发现有毒代谢中间产物产生。同时,实验结果显示,菌株HS-10对CYP、DEL、BIF、CYF和FEN 5种拟除虫菊酯类农药混合物(其浓度分别为100mg/L)具有较高的降解效率,其降解率分别为53.8%、72.1%、57.7%、50.4%和 66.6%,表明菌株HS-10对多种拟除虫菊酯类农药具有较高的降解能力,表现出较好的应用开发前景。
于蓉蓉,颜景鹏,张建伟等,2009.拟除虫菊酯类农药对典型冷——温血动物毒性作用研究进展.环境与健康杂志,9:842—845
王 帅,李忠海,付湘晋等,2013.鱼塘养殖水中 5种拟除虫菊酯类农药的测定.食品与机械,3:83—85
邓先余,高 健,谭树华等,2009.一株甲胺磷高效降解菌——巴氏葡萄球菌(Staphylococcus pasteuri)的筛选及其分子鉴定.海洋与湖沼,40(5):551—556
刘 丽,肖 维,黄华伟等,2013.气象色谱法测定渔业水体中6种拟除虫菊酯类药物的残留量.中国渔业质量与标准,3(2):57—64
孙苏燕,张德民,钱丽君等,2009.三疣梭子蟹养殖塘表层底泥异养细菌群落比较研究.水产学报,34(5):820—828
李青云,顾宝群,刘幽燕等,2009.氯氰菊酯降解菌GF31的分离鉴定及其降解特性.微生物学通报,36(9):1334—1339
李玲玉,刘 艳,颜冬云等,2010.拟除虫菊酯类农药的降解与代谢研究进展.环境科学与技术,33(4):65—71
张松柏,张德咏,刘 勇等,2009.一株菊酯类农药降解菌的分离鉴定及其降解酶基因的克隆.微生物学报,49:1520—1526
虞云龙,盛国英,傅家谟,1999.农药降解酶的固定化及其降解特性.应用与环境生物学报,5:166—169
廖 敏,张海军,马爱丽等,2009.两株拟除虫菊酯类农药高效降解菌混合降解性能研究.农药学学报,11(4):472—479
魏 华,吴 楠,沈 竑等,2010.溴氰菊酯对克氏原螯虾的氧化胁迫效应.水产学报,34:733—739
Almakkawy H K,Madbouly M D,1999.Persistence and accumulation of some organic insecticides in Nile water and fish.Resource Conservation and Recycling,27(1/2):105—115
Bridge P D,Williams M A J,Prior Cet al,1993.Morphological,biochemical and molecular characteristics ofMetarhizium anisopliaeandM.flavoviride.Journal of General Microbiology,139:1163—1169
Chen S,Luo J,Hu Met al,2012.Enhancement of cypermethrin degradation by a coculture ofBacillus cereusZH-3 andStreptomyces aureusHP-S-01.Bioresource Technology,110:97—104
Grant R J,Daniell T J,Betts W B,2002.Isolation and identification of synthetic pyrethroid-degrading bacteria.Journal of Applied Microbiology,92:534—540
Hong Y F,Zhou J,Hong Qet al,2010.Characterization of a fenpropathrin-degrading strain and construction of a genetically engineered microorganism for simultaneous degradation of methyl parathion and fenpropathrin.Journal of Environmental Management,91:2295—2300
Li H,Zhang Y,Kravehenko Iet al,2007.Dynamic changes in microbial activity and community structure during biodegradation of petroleum compounds:A laboratory experiment.Journal of Environmental Science,19:1003—1013
Lin Q S,Chen S H,Hu M Yet al,2011.Biodegradation of cypermethrin by a newly isolated actinomycetes HS-S-01 from wastewater sludge. International Journal of Environmental Science and Technology,8(1):45—56
Liu W P,Gan J Y,Sehlenk Det al,2005.Enantioselectivity in environmental safety of current chiral insecticides.Proceeding of the National Academy of sciences,102(3):701—706
Rangaswamy V,Venkateswarlu K,1992.Degradation of selected insecticides [monocrotophos,quinalphos,cypermethrin and fenvalerate] by bacteria isolated from soil.Bulletin of Environmental Contamination and Toxicology,49(6):797—804
Stratton G W,Corke C T,1982.Toxicity of the insecticide permethrin and some degradation products towards algae and cyanobacteria.Environmental Pollution Series A,Ecological and Biologica,29(1):71—80
Tallur P N,Megadi V B,Ninnekar H Z,2008.Biodegradation of cypermethrin byMicrococcussp.Strain CPN1.Biodegradation,19:77—82

