H1受体阻滞剂在特发性肺间质纤维化所致呼吸衰竭中的应用探讨
张凯
H1受体阻滞剂在特发性肺间质纤维化所致呼吸衰竭中的应用探讨
张凯①
目的:观察H1受体阻滞剂治疗特发性肺间质纤维化所致的呼吸衰竭患者的疗效。方法:总结本院2011年1月-2012年5月60例弥漫性肺间质纤维化合并Ⅰ型呼吸衰竭患者,按照随机数字表法分为对照组和观察组30例,对照组予以抗感染,改善通气,平喘等治疗;观察组在上述治疗的基础上予以H1受体阻滞剂(非那根片)治疗,对比观察两组患者呼吸频率,心率、动脉血气分析、肺功能变化情况。结果:观察组在应用H1受体阻滞剂后呼吸频率、心率、SpO2、动脉血气分析、DLCO%pre(一氧化碳弥散量占预计值百分比)、患者自我喘息症状缓解程度改善方面均明显优于对照组,比较差异有统计学意义(P<0.05)。结论:H1受体阻滞剂能缓解呼吸衰竭所引起的症状,减少氧耗,改善血气水平。
特发性肺间质纤维化; 呼吸衰竭; H1受体拮抗剂; 非那根
特发性肺间质纤维化是一种发病机制不清,由多种原因引起的肺间质的炎症性疾病,病变主要累及肺间质,也可累及肺泡上皮细胞及肺血管[1]。由于起病隐匿,进行性加重,至发现到医院治疗时以多有肺部不可能改变,常常合并因换气障碍为主的呼吸衰竭。此病病死率较高,因此早期发现、确诊、治疗对患者的预后意义十分重要。H1受体阻滞剂是一类能竞争性拮抗组胺与特异性H1受体结合而发挥作用的药物,从1937年第1个抗组胺药物开发至今,已有约50余种药物在临床上使用。第1代H1受体阻滞剂包括苯海拉明、氯苯那敏、异丙嗪等,受体特异性差,中枢神经活动性较强,可引致明显的镇静和抗胆碱作用,所以被称为镇静性抗组胺药物。第2代抗组胺药包括特非那根、阿司咪唑、氯雷他定、西替利嗪等,受体选择性高,无镇静作用,中枢反应较少,故称为非镇静抗组胺药物。经过近几年的临床试验和药理学研究发现,H1受体阻滞剂除具有上述作用外,还表现出较强的抗炎和免疫调节活性。本文通过应用非那根对患者进行干预,通过症状、血气和呼吸功能观察,从而探讨H1受体阻滞剂在肺间质纤维化所致呼吸衰竭中的治疗作用。
1 资料与方法
1.1 一般资料 选取本院2011年1月-2012年5月收治的60例因弥漫性肺间质纤维化合并呼吸衰竭患者。所有患者弥漫性肺间质纤维化符合2004年呼吸疾病诊断治疗指南:双肺有吸气性Velcro杂音,病程>3个月,支气管肺泡灌液或支气管火箭等检查,排除其他肺部疾病,胸部HRCT检查显示有微量的磨玻璃影,晚期有蜂窝肺,双肺发生网状病变,肺部有气体交换障碍或通气功能障碍。血气分析结果提示患者合并呼吸衰竭,PaO2<7.89 kPa(60 mm Hg),伴有或不伴有PCO2>6.77 kPa(50 mm Hg)。60例患者,男34例,女26例,年龄52~84岁,平均(65±7.84)岁,病程3~18年,平均(9±5.27)年。排除标准:(1)意识障碍不合作;(2)无力排痰或气道内大量分泌物需气管插管吸引者。将60例患者按照随机数字表法分为对照组和观察组各30例。对照组中男18例,女12例;年龄(64.00±5.32)岁,病程(8.00±6.02)年。观察组中男16例,女14例;年龄(66.00±6.72)岁,病程(9.00±3.12)年。两组患者在年龄、性别、病程等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 研究方法
1.2.1 选择试验对象 两组患者给予抗感染、改善通气、平喘等常规治疗。对照组不使用任何抗H1受体阻滞剂。
1.2.2 干预处理 观察组使用非那根片12.5 mg,口服,2次/d,观察2周。
1.2.3 观察试验数据 记录两组年龄、性别、身高、体重和治疗后1周呼吸频率、心率、动脉氧分压,血氧饱和度,肺一氧化碳弥散量在预测值百分比(DLCO%pre)、自我喘息症状程度变化(采取1~12分制衡量喘息缓解程度,1~3表示无明显缓解,4~6表示轻度缓解,7~9表示中度缓解,10~12表示明显缓解)。观察用药过程中病情加重,发生意外,药物不良反应等。总缓解率=中度缓解率+明显缓解率。
1.3 统计学处理 采用SPSS 19.0软件对所得数据进行统计分析,计量资料用(±s)表示,比较采用t检验,计数资料采用 χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后DLCO%pre比较 治疗2个月后,观察组61%~100%所占病例数明显高于对照组,两组比较差异有统计学意义(P<0.05),见表1。
2.2 两组治疗后症状缓解情况比较 治疗2个月后,观察组的自我喘息症状总缓解率76.67%明显高于对照组的50.00%,比较差异有统计学意义(P<0.05),见表2。
2.3 治疗前后两组患者呼吸频率、心率、血气分析、血氧饱和度的比较 对照组治疗前后呼吸频率、心率、血气分析、血氧饱和度变化比较差异均无统计学意义(P>0.05)。观察组治疗前后呼吸频率、心率、血气分析、血氧饱和度变化比较差异均有统计学意义(P<0.05)。观察组治疗后呼吸频率、心率、血气分析、血氧饱和度变化与对照组治疗后比较差异均有统计学意义(P<0.05)。见表3。
3 讨论
特发性肺间质纤维化是指原因不明并以普通型间质性肺炎为特征性病理改变的一种慢性炎症性间质肺疾病,主要表现为弥漫性肺泡炎,肺泡结构紊乱,最终导致肺纤维化。最新研究表明,在英国特发性肺间质纤维化的发生率为4~6个/10万,而在美国这一数据变为6~8个10万。大约60%的患者超过60岁,平均发病年龄为66岁,确诊后的中位生存时间约为3年[2]。因此,特发性肺间质纤维化成为一个重要的公共卫生问题,早期的诊断尤为重要。目前诊断特发性肺间质纤维化的主要指标有:(1)患者排除已知间质性肺疾病的病因。如某些药物和毒性作用,环境污染级结缔组织疾病所引起的肺间质纤维化。(2)异常的肺功能表现,如限制性通气功能障碍和气体交换障碍。(3)胸部影像学提示双下肺及胸膜下伴有少许磨玻璃样变化、网状改变或蜂窝肺。(4)经支气管镜肺活检或支气管肺泡灌洗检查结果对其他疾病的无诊断依据[3]。次要诊断标准有:(1)患者年龄>50岁。(2)患者病程≥3个月。(3)无确切病因的进行性加重呼吸困难。(4)患者双肺可闻及吸气性Velcro啰音。符合上述主要指标的4条及次要指标的3条以上可考虑特发性肺间质纤维化[3]。

表1 两组治疗前后DLCO%pre各区间病例数比较 例

表2 两组治疗后自我喘息症状缓解情况比较 例(%)
表3 两组治疗前后呼吸频率、心率、血气分析、血氧饱和度的比较(±s)
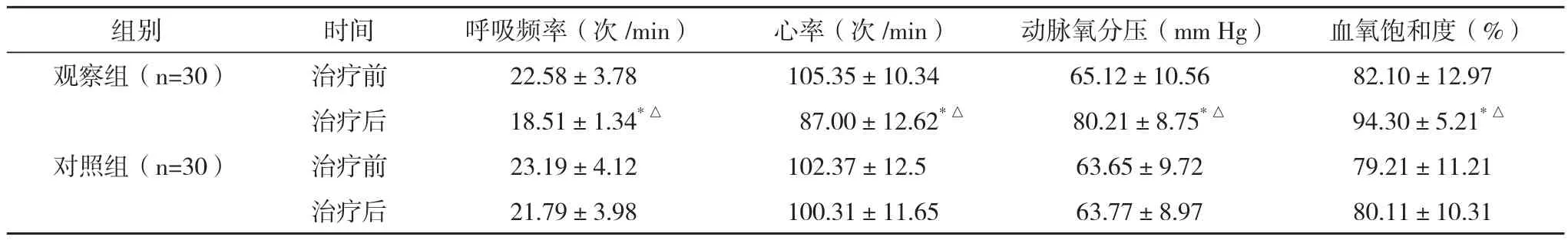
表3 两组治疗前后呼吸频率、心率、血气分析、血氧饱和度的比较(±s)
*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
组别 时间 呼吸频率(次/min) 心率(次/min) 动脉氧分压(mm Hg) 血氧饱和度(%)观察组(n=30) 治疗前 22.58±3.78 105.35±10.34 65.12±10.56 82.10±12.97治疗后 18.51±1.34*△ 87.00±12.62*△ 80.21±8.75*△ 94.30±5.21*△对照组(n=30) 治疗前 23.19±4.12 102.37±12.5 63.65±9.72 79.21±11.21治疗后 21.79±3.98 100.31±11.65 63.77±8.97 80.11±10.31
该病主要以肺间质成纤维细胞增生,胶原蛋白沉积等改变,最终导致以肺通气功能及换气功能下降的混合性障碍,发病机制复杂,发病过程伴多种细胞成分、细胞因子的参与,如白细胞、巨噬细胞、淋巴细胞、肿瘤坏死因子-α、白介素、各种细胞活素、组胺、蛋白酶、氧化剂等[4]。Benbarek等[5]报道高浓度组胺能激发多形核白细胞表达活性氧簇,从而产生致炎作用。由多种细胞因子参与的对肺间质、肺泡、肺小血管、末梢气道的损伤,在炎症损伤和修复过程中所导致的纤维化。故有效抑制多种炎性细胞因子释放,减轻炎症反应程度,减少参与炎性反应的因子,对抑制损伤后纤维增生达到治疗的目的[6]。H1受体阻滞剂能抑制多行核白细胞的趋化性,有研究发现H1受体阻滞剂能能抑制白细胞在血管内皮细胞上的滚动以及在炎症部位的侵润,减少活性氧的产生,从而达到抗炎作用,并能抑制血管的舒张。此外还有研究发现H1受体阻滞剂能减少巨噬细胞移行抑制因子,抑制巨噬细胞炎症蛋白和嗜酸细胞活化趋化因子的产生[7]。还能明显抑制巨噬细胞移行抑制因子诱导的IL-8的生存,故具有抗炎作用[8]。肿瘤坏死因子-α是导致纤维化的重要炎性细胞因子,有单核巨噬细胞分泌,促进成纤维细胞的活化,增值和胶原沉积[9]。有研究发现H1受体阻滞剂能抑制肿瘤坏死因子-α的释放,达到抗炎,抗纤维化的作用。肿瘤坏死因子-α是导致纤维化的重要炎性细胞因子,有单核巨噬细胞分泌,促进成纤维细胞的活化,增值和胶原沉积。H1受体阻滞剂能够改善肺部炎性反应,减少炎性渗出,对肺间质纤维化导致的呼吸衰竭的治疗价值意义重大。
此类患者通常存在呼吸困难,通常会动用呼吸肌及辅助呼吸肌运动。肌肉剧烈及过度运动时,且往往伴有呼吸肌疲劳。同时因患者呼吸困难,精神过度紧张。患者因多种因素导致气道高反应性的存在,因此当精神紧张或焦虑时既可使情绪中枢所处的大脑边缘系统抑制下丘脑的神经分泌细胞,使脑垂体的促肾上腺激素(ACTH)分泌减少,因而肾上腺皮质激素分泌减少。又可通过影响情绪中枢和下丘脑前部从而促使迷走神经兴奋,释放乙酰胆碱增加。可导致喘息症状的发作及加重,而喘息发作是又可引起患者情绪进一步紧张及焦虑等症状,如此反复发作,恶性循环[10]。当应用安全范围剂量的非那根时,有着中枢镇静作用,能使患者情绪平静,缓解焦虑,解除烦躁,从而降低因种种负面情绪引起的气道通气改变,让呼吸肌得到休息,一定程度上恢复呼吸肌的机能储备。但根据笔者观察,如药物剂量控制欠佳,或患者存在着高二氧化碳血症,应用药物可能会出现过度镇静作用,而诱发二氧化碳潴留引发肺性脑病的可能。因此,在应用药物时需严格按照药物说明的剂量要求,从小剂量、低给药频率开始,边观察变加量。
此外,某些以炎症改变为主的肺间质纤维化,在早期去除致病因素或得到有效的治疗后,其病变可以缓解。Kroegel 等[6]在特发性肺间质纤维化急性期可能存在肺泡炎,因此抑制炎性反应有一定疗效。如果炎症持续存在,将导致肺结构破坏和纤维组织增生,最终导致不可逆的肺纤维化和蜂窝肺改变。故在本研究中患者的病情缓解的幅度上仅仅观察到部分患者有较显著的疗效。虽然,H1受体阻滞剂应用时间长,药物种类多,但对于“老药新用”上尚有新空间等待发现。
[1] Raghu G, Collard H, Egan J J, et al.An official ATS/ERS/JRS/ALAT statement:idiopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management[J].Am Jrespir Crit Care Med, 2011, 183 (2): 788-824.
[2] Navaratnam V, Fleming K M, West J, et al.The rising incidence of idiopathic pulmonary fibrosis in the UK[J].Thorax, 2011, 66(2):462-467.
[3] Bhalt N, Baran C P, Allen J, et al.Promising phaermacologic innovation in treating pulmonary fibrosis[J].Respiration, 2004, 71(6):656-657.
[4] Yamaki K, Thorlacius H, Xie X, et al.Charaacteristics of histamineinduced leukocyte rolling in the undisturbed microcirculation of the rat mesentery[J].Br J Pharmacol, 1998, 123(3): 390.
[5] Benbarek H, Mouithys-Mickalad A, Deby-Dupont G, et al.High con centrations of histamine stimulate equine polymprphonuclear neutrophils to produce reactive oxygen[J].Species Res, 1999, 48(11): 594.
[6] Kroegel C, Mock B, Hengst U, et al.Interferon-gamma-1b,therapeutic option in avanced idiopathic pulmonary fibrosis[J]. Respiration, 2004, 71(6): 656-657.
[7] Shimizu T, Nishihira J, Watanabe H, et al. Cetirizine, an H1-receptor antagonist inhibitory factor:its potenial anti-inflammatory action[J]. Clin Exp Allergy, 2004, 34(1): 103.
[8]谢建丰,陈伟,何振华.特发性肺纤维化治疗进展[J].中国现代医学杂志,2012,10(3):124-124.
[9]覃珍,陈超.H1受体阻滞剂应用的研究进展[J].陕西医学杂志,2005,4(5):473-474.
[10]崔嗣庚.精神因素诱发哮喘5例[J].中华医学写作杂志,2003,10(1):1760-1761.
The Disscussion of H1Recepter Blokers's Effect in Failure of Respiration Induced by Idiopathic Pulmonary Fibrosis
ZHANG K ai.// Medical Innovation of China,2014,11(03):025-027
Idiopathic pulmonary fibrosis; Failure of respiration; H1recepter blokers; Phenergan
10.3969/j.issn.1674-4985.2014.03.010
2013-08-29) (本文编辑:黄新珍)
①三峡大学附属仁和医院 湖北 宜昌 443000
张凯
【Adstract】 Objective:To investigate the effect of H1recepter blokers in failure of respiration induced by idiopathic pulmonary fibrosis(IPF).Method:Sixty patients with IPF were randomly divided into the control group and the observation group, with 30 patients in each group.Patients in the control group were given antibiotic, treatments on dysfunction of ventilation.Patients in the observation group were given H1recepter blocker(Phenergan),besides the same treatment of the control group.The clinical effects of the two groups were compared after 2 weeks after treatment.Result:The clinical symptoms and improvement in pulmonary diffusion of the observation group were better than those in the control group, such as breathing rate, heart rate,SpO2, arterial blood gas analysis, DLCO%pre, and the difference between the two groups were all statistically significant(P<0.05).Conclusion:The effect of H1recepter blocker on IPF can relieve the symptoms of respiratory failure caused by, reduce the oxygen consumption, and improve the blood gas levels.
First-author’s address:Renhe Affiliated Hospital of Three Gorges University,Yichang 443000,China

