双指数模型扩散加权成像对原发性骨肿瘤良恶性的鉴别诊断价值
石晓莹 SHI Xiaoying
任翠萍 REN Cuiping
程敬亮 CHENG Jingliang
李 莹 LI Ying
李贝贝 LI Beibei
双指数模型扩散加权成像对原发性骨肿瘤良恶性的鉴别诊断价值
石晓莹 SHI Xiaoying
任翠萍 REN Cuiping
程敬亮 CHENG Jingliang
李 莹 LI Ying
李贝贝 LI Beibei
目的探讨多b值双指数衰减模型的扩散加权成像(DWI)对原发性骨肿瘤良恶性的鉴别诊断价值。资料与方法对48例经手术病理证实的原发性骨肿瘤患者行多b值双指数衰减模型的DWI检查(b值取0、30、50、100、150、200、300、400、500、600、700、800 s/mm2),其中良性病变18例,恶性病变30例。以患者自身对侧正常骨髓作为对照,比较各组慢速表观扩散系数(Slow ADC)值、快速表观扩散系数(Fast ADC)值及快速成分所占比例(ffast)的差异。结果良性组Slow ADC值、Fast ADC值及ffast值分别为(1.51±0.62)×10-3mm2/s、(118.8±95.0)×10-3mm2/s、0.24±0.15;恶性组Slow ADC值、Fast ADC值及ffast值分别为(0.94±0.28)×10-3mm2/s、(88.9±78.8)×10-3mm2/s、0.35±0.21;对 照 组Slow ADC值、Fast ADC值及ffast值分别为(0.63±0.37)×10-3mm2/s、(87.3±84.1)×10-3mm2/s、0.33±0.16。3组间Slow ADC值两两比较差异均有统计学意义(P<0.05),Fast ADC值差异均无统计学意义(P>0.05)。良性组与恶性组ffast值差异有统计学意义(P<0.05),其他组间两两比较ffast值差异无统计学意义(P>0.05)。结论多b值双指数衰减模型DWI在原发性骨肿瘤的应用切实可行,不同Slow ADC值可以为原发性骨肿瘤良恶性的鉴别诊断提供依据。
骨肿瘤;磁共振成像,弥散;扩散加权成像;双指数模型;诊断,鉴别
扩散加权成像(DWI)对细胞密度、脂肪和骨髓细胞相对含量、水含量和骨髓灌注具有较高的敏感性,已越来越多地用于评估骨髓病变[1],鉴别骨肿瘤的良恶性对于制订适宜的治疗方案、恰当的手术方法以及预后评价尤为重要[2]。成人骨髓一般由脂肪组织构成,在T1WI和T2WI均呈高信号,压脂序列呈低信号。当髓腔被肿瘤浸润时,T1WI信号减低,短TI反转恢复序列及压脂序列信号增高。尽管常规MR序列可以从信号强度方面区分正常与病变的骨髓,但并不足以鉴别病变的良恶性[3]。Mubarak等[4]研究发现,良性椎体骨折患者表观扩散系数(ADC)值显著大于骨转移所致椎体骨折患者。尽管这种基于单指数信号衰减模型的DWI对于鉴别骨髓病变的良恶性具有一定的意义,但良、恶性病变的ADC值可能存在一部分重叠,从而导致误诊[2,5]。本研究拟探讨双指数衰减模型的DWI在鉴别诊断原发性骨肿瘤良恶性中的应用价值。
1 资料与方法
1.1 研究对象 2012-10~2013-08于郑州大学第一附属医院就诊的48例原发性骨肿瘤患者,其中男30例,女18例;年龄8~72岁,中位年龄31岁。所有病变经手术病理检查及影像学检查证实,并根据病变性质分为良性组18例和恶性组30例,其病变特征见表1,其中1例恶性骨软骨瘤患者软骨帽厚度为3 mm。所有患者以自身正常骨髓腔作为对照,均知情同意并签署知情同意书,所有患者扫描前未接受任何化疗或放疗。
1.2 仪器与方法 采用GE MR750 3.0T超导型MRI扫描仪,8通道心脏专用相控线圈,患者取仰卧位,脚先进。所有患者均行常规冠状位T1WI(TR 450 ms,TE 20 ms)、T2WI IDEAL序列(TR 3000 ms,TE 78 ms)。多b值双指数衰减模型DWI采用平面回波序列轴位成像(TR 3000 ms,TE为最小值),层厚5 mm,层间距1 mm,在全部方向上施加扩散梯度,b值取0、30、50、100、150、200、300、400、500、600、700、800 s/mm2,其中b值取30~200 s/mm2时激励次数(NEX)=2,b值取300~600 s/mm2时NEX=4,b值取700~800 s/mm2时NEX=6。于T2WI IDEAL脂像选取病变处进行定位,视野包含病变与对侧正常骨髓腔,扫描时间4 min 56 s。
1.3 图像分析 将原始图像数据传至AW 4.5工作站,应用MADC软件进行图像分析,结合常规T1WI、T2WI IDEAL序列及DWI图像,手工放置病变侧及正常对侧感兴趣区(ROI),同时注意选取病灶扩散受限最显著的最大层面,尽可能多地选择病变实质区,并尽量避开坏死、出血、囊变等区域。ROI大小由病灶扩散最明显区域的面积决定。对于同一病灶尽量选择大小相同的ROI多次测量慢速表观扩散系数(Slow ADC)、快速表观扩散系数(Fast ADC)及快速成分所占比例(ffast),同时测量对侧正常骨髓区域。为避免测量偏差,由2名有经验的骨肌影像诊断医师采用盲法对每个样本分别进行测量,取平均值作为测量结果。计算各组间ROI平均ADC值,分析水分子的扩散变化。
1.4 统计学方法 采用SPSS 17.0软件,良性组、恶性组及对照组间Slow ADC值比较采用非参数Kruskal-Wallis检验,3组间Fast ADC值及ffast值比较采用单因素方差分析,两两比较采用LSD法及Bonferroni法,P<0.05表示差异有统计学意义。

表1 48例原发性骨肿瘤患者的病变特征
2 结果
对照组、良性组(图1)及恶性组(图2)定量参数比较:对照组、良性组、恶性组间Slow ADC值差异有统计学意义(χ2=29.910, P<0.05),且良性组Slow ADC值高于恶性组,恶性组又高于对照组。单因素方差分析显示,3组间Fast ADC值(F=1.009, P>0.05)、ffast(F=2.239, P>0.05)差异无统计学意义,良性组Fast ADC值最高,ffast值最低,对照组与恶性组相差不大(表2)。进一步两两比较,3组间Slow ADC值、良性组与恶性组间ffast值差异有统计学意义(P<0.05),其余各参数3组间两两比较差异均无统计学意义(P>0.05)。
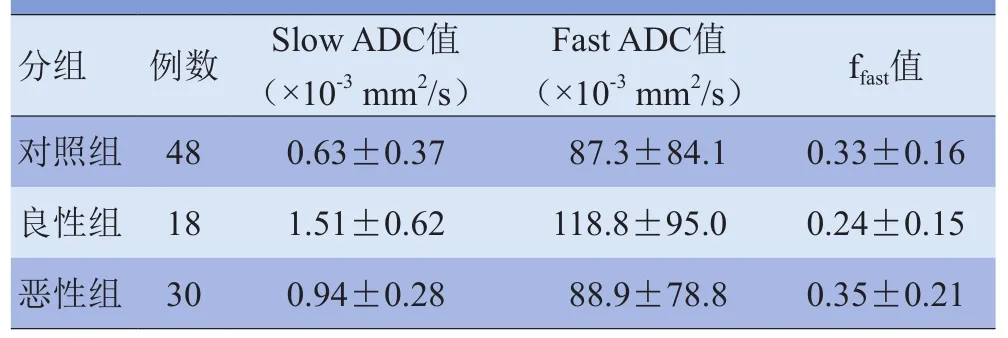
表2 正常髓腔、良性组与恶性组各定量参数比较
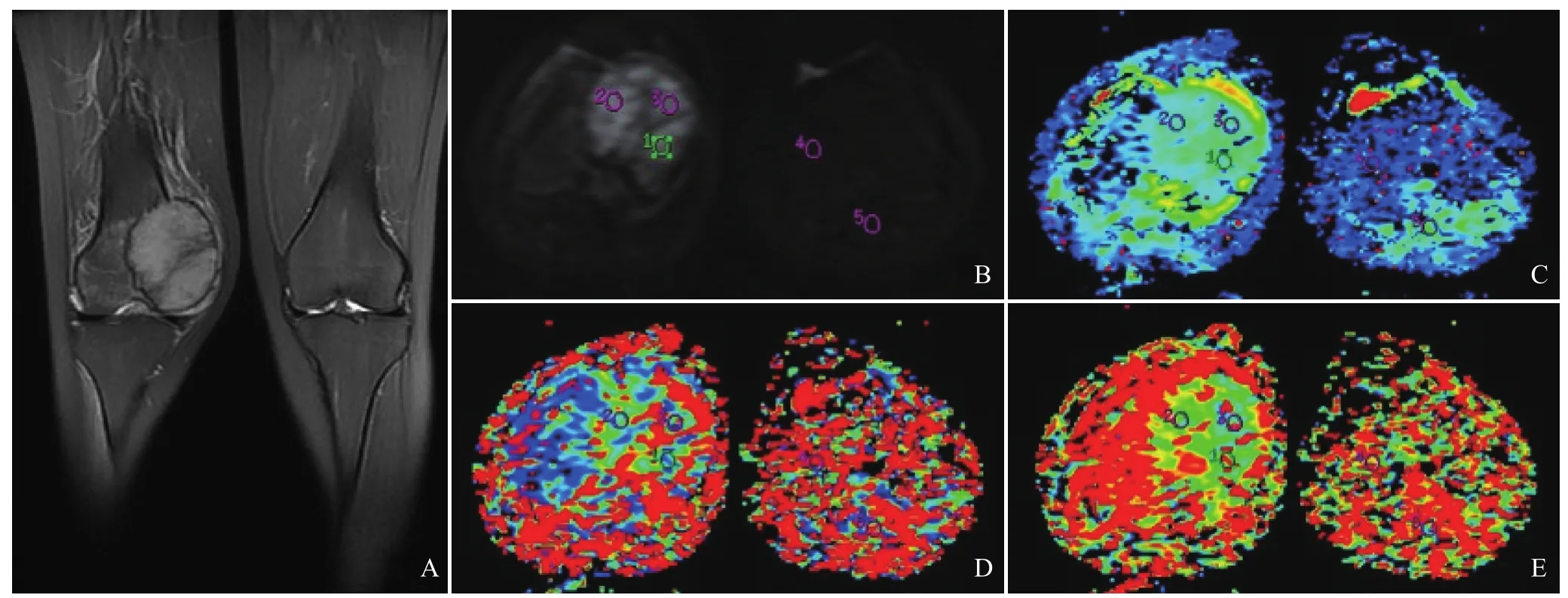
图1 女,18岁,右侧股骨远端骨巨细胞瘤。右侧股骨远端偏内侧膨隆,髓腔内可见团块状稍长T2信号(A),选取最佳b值DWI图手工放置病变区及对侧正常髓腔区ROI(B),于生成的Slow ADC(C)、Fast ADC(D)及ffast(E)伪彩图上记录相应的参数,多次测量病变,取均值作为最终取值可得病变区3个参数分别为1.31×10-3mm2/s、10.7×10-3mm2/s、0.24,对照区分别为0.36×10-3mm2/s、1.4×10-3mm2/s、0.40

图2 男,14岁,右侧胫骨近端骨肉瘤。右侧胫骨近端髓腔信号不均,可见斑片状混杂长T2信号,并向周围形成软组织肿块,局部骨皮质不连续(A);于DWI图上手工放置病变区及对侧正常髓腔区ROI(B);Slow ADC、Fast ADC及ffast伪彩图(C~E)测得病变区3个参数分别为0.99×10-3mm2/s、52.8×10-3mm2/s、0.14,对照区分别为0.48×10-3mm2/s、72.0×10-3mm2/s、0.13
3 讨论
源于活体组织扩散的ADC值反映了生物组织细胞内外的布朗运动,可以提供肿瘤微环境的信息[6],已经逐渐应用于肿瘤的定量分析,在骨肿瘤中的应用包括肿瘤良恶性的鉴别及化疗效果评价[5,7]。然而,DWI常规单指数模型忽略了组织微循环灌注对ADC值的影响,所得ADC值不能真实地反映组织扩散的生物学特征[8]。因此提出了DWI双指数衰减模型,通过不同的定量参数分别评价组织扩散系数及组织微循环灌注,其中Slow ADC值反映了生物组织真实水分子扩散,Fast ADC值及ffast值反映了组织快速移动成分,与微循环灌注相关。该模型应用低b值将组织扩散与血液灌注分离,使所测量的水分子扩散系数更准确,并可以对病变血流灌注进行分析[9]。目前该技术已经应用于定量肝纤维化[10]、评价慢性肾病[11]或鉴别诊断椎体良、恶性病变[12]等方面,但其在骨肿瘤中的应用尚未见报道。本研究将多b值DWI的双指数模型应用于原发性骨肿瘤,结果显示其在鉴别骨肿瘤病变良恶性中有一定的诊断价值。
Slow ADC为组织中纯水分子真实扩散系数,通过DWI双指数模型选取高b值(>200 s/mm2)去除灌注成分后计算而来[9]。本研究中良性组、恶性组、对照组间Slow ADC 值差异均有统计学意义(P<0.05),从大到小依次为:良性组、恶性组、对照组,其原因可能是由于正常骨髓ADC值很小[13],肿瘤浸润使正常骨髓细胞被肿瘤细胞取代,而肿瘤细胞代谢明显高于正常骨髓,肿瘤组织的微血管结构更加丰富,水分子扩散增加[12]。在原发恶性骨肿瘤中,由于肿瘤细胞大量增殖,细胞排列密集,细胞膜黏滞性增高,而骨髓腔空间固定,导致细胞外间隙明显变小,细胞膜通透性减低,使水分子扩散受限,Slow ADC值降低[1];而良性原发性骨肿瘤因细胞间隙较恶性病变稍宽而较正常组织略窄,由于炎症反应等的刺激,细胞外间隙微血管灌注增加,使细胞膜通透性明显增高,水分子扩散明显增加[12],引起Slow ADC 值升高,与Padhani等[1]的结论相似,代表扩散成分的Slow ADC值在正常红、黄骨髓与恶性病变的鉴别中具有重要意义。但由于本研究样本量较少,尚需增加病例进一步验证研究结果。
在低b值(<200 s/mm2)时,DWI双指数模型中组织微循环灌注成分对MR信号衰减较为敏感[9]。根据双指数理论,Fast ADC值与肿瘤组织微血管密度密切相关。本研究中各组Fast ADC值均显著大于对应的Slow ADC 值,可见低b值时Fast ADC 值对MR信号衰减敏感。Fast ADC值与低b值的数量及不同组合密切相关,b值越大,ADC值的可重复性越好[14]。张水兴等[15]研究发现,鼻咽癌组原发灶的Fast ADC 值明显高于炎性增生组,证实Fast ADC 值与组织微血管灌注的丰富程度相关。然而本研究中Fast ADC值在3组间差异均无统计学意义,其可能原因为:①骨髓腔ADC值受不同扩散权重与微灌注的影响,并与红、黄骨髓分布模式及水分子和脂肪细胞所占分数有关[16],而本研究中小b值较多,反映组织的微灌注成分所占比重较大,可能是由于某些肿瘤的微血管灌注较丰富,弥补了因细胞外间隙减小所引起的Fast ADC值减低,从而使某些肿瘤良恶性间及与正常骨髓间Fast ADC值存在一定的重叠。②骨髓ADC值与年龄呈负相关[17],本研究中年轻患者居多(中位年龄31岁),患者年龄跨度较大(8~72岁),可能是对相关ADC值的测定有一定的影响。③Ginat等[18]通过对颅骨良、恶性病变与细胞密度的研究发现,脊索瘤和低级别软骨肉瘤与常规恶性病变不同,其ADC值高于良性病变。本组病例中包含3例脊索瘤和2例软骨肉瘤患者,可能因此对样本整体ADC值产生一定的影响,其根本原因尚有待进一步探讨。
理论上灌注分数ffast应随着组织灌注成分的增加而增大,本研究中恶性组ffast值明显高于良性组,但同时良性组ffast值明显低于对照组,且恶性组与对照组间ffast值差异不大,这似乎与理论相矛盾。类似的矛盾结果在前列腺癌与增生性、炎性病变比较中也可以观察到[19]。张水兴等[15]研究认为该矛盾结果可能与ffast值对TR和TE等扫描参数的依赖有关,T2值的差异使ffast值被过高估计,但具体原因尚需进一步研究验证。
总之,多b值双指数衰减模型DWI的Slow ADC在原发性骨肿瘤良恶性的鉴别诊断中具有可行性,其参数的完全量化为鉴别诊断提供了更客观的方法。DWI双指数模型在骨肿瘤中的应用能将扩散和灌注用不同参数进行独立评估,且无需注入对比剂,将来可能在原发性骨肿瘤良恶性的鉴别及恶性的骨肿瘤放化疗疗效评价等方面具有重要作用。
[1] Padhani AR, van Ree K, Collins DJ, et al. Assessing the relation between bone marrow signal intensity and apparent diffusion coefficient in diffusion-weighted MRI. Am J Roentgenol, 2013, 200(1): 163-170.
[2] Pozzi G, Garcia PC, Stradiotti P, et al. Diffusion-weighted MR imaging in differentiation between osteoporotic and neoplastic vertebral fractures. Eur Spine J, 2012, 21(Suppl 1): S123-S127.
[3] Herneth AM, Friedrich K, Weidekamm C, et al. Diffusion weighted imaging of bone marrow pathologies. Eur J Radiol, 2005, 55(1): 74-83.
[4] Mubarak F, Akhtar W. Acute vertebral compression fracture: differentiation of malignant and benign causes by diffusion weighted magnetic resonance imaging. J Pak Med Assoc, 2011, 61(6): 555-558.
[5] Oka K, Yakushiji T, Sato H, et al. Ability of diffusion-weightedimaging for the differential diagnosis between chronic expanding hematomas and malignant soft tissue tumors. J Magn Reson Imaging, 2008, 28(5): 1195-1200.
[6] Nilsen LB, Fangberget A, Geier O, et al. Quantitative analysis of diffusion-weighted magnetic resonance imaging in malignant breast lesions using different b value combinations. Eur Radiol, 2013, 23(4): 1027-1033.
[7] Baunin C, Schmidt G, Baumstarck K, et al. Value of diffusionweighted images in differentiating mid-course responders to chemotherapy for osteosarcoma compared to the histological response: preliminary results. Skeletal Radiol, 2012, 41(9): 1141-1149.
[8] Le Bihan D, Breton E, Lallemand D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging. Radiology, 1988, 168(2): 497-505.
[9] Dyvorne HA, Galea N, Nevers T, et al. Diffusion-weighted imaging of the liver with multiple b values: effect of diffusion gradient polarity and breathing acquisition on image quality and intravoxel incoherent motion parameters--a pilot study. Radiology, 2013, 266(3): 920-929.
[10] Anderson SW, Barry B, Soto JA, et al. Quantifying hepatic fibrosis using a biexponential model of diffusion weighted imaging in ex vivo liver specimens. Magn Reson Imaging, 2012, 30(10): 1475-1482.
[11] 李琼, 张泉, 孙浩然, 等. 应用扩散加权成像双指数模型评价慢性肾脏病的初步研究. 临床放射学杂志, 2012, 31(7): 970-974.
[12] 韩瑞, 夏黎明, 孙子燕, 等. 双指数表观扩散系数鉴别诊断椎体良、恶性病变. 中国医学影像技术, 2012, 28(3): 566-569.
[13] 马玲, 孟悛非, 陈应明, 等. 表观扩散系数值在原发性恶性骨肿瘤诊断中的价值. 中华放射学杂志, 2004, 38(11): 9-14.
[14] 刘再毅, 陈鑫, 颜丽芬, 等. b值对肝脏磁共振扩散加权成像ADC值及其可重复性的影响. 中国医学影像学杂志, 2013, 21(5): 370-373.
[15] 张水兴, 贾乾君, 张忠平, 等. 基于体素内不相干运动的扩散加权成像对鼻咽癌与炎性增生性疾病的鉴别诊断. 中华放射学杂志, 2013, 47(7): 617-621.
[16] Biffar A, Dietrich O, Sourbron S, et al. Diffusion and perfusion imaging of bone marrow. Eur J Radiol, 2010, 76(3): 323-328.
[17] 徐贤, 马林, 安宁豫, 等. 健康成人骨髓全身磁共振扩散加权成像研究. 中国医学影像学杂志, 2013, 21(6): 401-405, 410.
[18] Ginat DT, Mangla R, Yeaney G, et al. Diffusion-weighted imaging for differentiating benign from malignant skull lesions and correlation with cell density. Am J Roentgenol, 2012, 198(6): W597-W601.
[19] Liu X, Peng W, Zhou L, et al. Biexponential apparent diffusion coeffcients values in the prostate: comparison among normal tissue, prostate cancer, benign prostatic hyperplasia and prostatitis. Korean J Radiol, 2013, 14(2): 222-232.
(责任编辑 张春辉)
Differentiation of Benign and Malignant Primary Bone Neoplasms Using Biexponential Model Diffusion-weighted Imaging
PurposeTo investigate the differential diagnosis of benign and malignant bone neoplasms using multiple b-values and biexponential attenuation model diffusionweighted imaging (DWI).Materials and MethodsForty-eight patients with pathology proven primary bone neoplasm underwent multiple b-values and biexponential attenuation model diffusion-weighted imaging (b values of 0, 30, 50, 100, 150, 200, 300, 400, 500, 600, 700, 800 s/mm2), including 18 benign tumors (benign group) and 30 malignant tumors (malignant group). Using contralateral normal bone marrow as control, the differences between Slow ADC values, Fast ADC values and the fraction of fast ADC (ffast) were compared.ResultsIn benign group, the Slow ADC, Fast ADC and ffastwere (1.51±0.62)×10-3mm2/s, (118.8±95.0)×10-3mm2/s and 0.24±0.15; in malignant group, the Slow ADC, Fast ADC and ffastwere (0.94±0.28)×10-3mm2/s, (88.9±78.8)×10-3mm2/s and 0.35±0.21. In control group, the Slow ADC, Fast ADC and ffastwere (0.63±0.37)× 10-3mm2/s, (87.3±84.1)×10-3mm2/s and 0.33±0.16. There was statistically signifcant difference between Slow ADC values (P<0.05). No statistical signifcance was detected for Fast ADC values. The ffastwas statistically different between benign and malignant groups (P>0.05).ConclusionIt is feasible to diagnose benign and malignant bone neoplasms using multiple b-values and biexponential attenuation model diffusion-weighted imaging. Different Slow ADC values provide valuable information in differential diagnosis.
Bone neoplasms; Diffusion magnetic resonance imaging; Diffusion weighted imaging; Double exponential model; Diagnosis, differential
郑州大学第一附属医院磁共振科 河南郑州 450052
任翠萍
Department of MR, the First Affliated Hospital of Zhengzhou University, Zhengzhou 450052, China
Address Correspondence to: REN Cuiping
E-mail: rcp810@sohu.com
R738.1;R730.42
2013-09-03
修回日期:2014-01-10
中国医学影像学杂志
2014年 第22卷 第3期:186-190
Chinese Journal of Medical Imaging
2014 Volume 22(3): 186-190
10.3969/j.issn.1005-5185.2014.03.007

