人附睾蛋白4和影像学检查对卵巢癌诊断的研究进展
周忠春 张艳利 姜 楠 杨 梅 郭顺林
人附睾蛋白4和影像学检查对卵巢癌诊断的研究进展
周忠春 张艳利 姜 楠 杨 梅 郭顺林
卵巢肿瘤;附睾蛋白4;超声检查;体层摄影术,X线计算机;磁共振成像;正电子发射断层显像术;综述
卵巢癌是死亡率最高的女性生殖系统肿瘤,其发病隐匿、进展迅速,70%~80%的卵巢癌患者发现时已为晚期,其5年生存率仅为20%~30%,而早期卵巢癌患者的生存率可达92%[1]。因此,提高卵巢癌的早期诊断、术前临床分期及良恶性鉴别能力有重要意义。目前临床最常用的卵巢癌血清肿瘤标志物是CA125,但50%的早期卵巢上皮性癌的CA125升高,20%的卵巢上皮性癌不表达CA125,且在其他妇科良性疾病、部分系统恶性肿瘤中CA125也可以阳性表达,从而限制了其临床应用[2]。人附睾蛋白4(human epididymis protein 4, HE4)是一种新的肿瘤标志物,其在癌旁组织、正常组织及良性肿瘤中含量极低,但在卵巢癌中含量较高,是卵巢癌早期诊断及良恶性鉴别诊断的重要指标。HE4和CA125的结构及诊断卵巢癌的特点见表1[3-5]。影像学检查在卵巢肿瘤临床分期和良恶性鉴别中具有重要作用,但其对卵巢癌早期诊断的特异度不高。本文对HE4和影像学检查对卵巢癌的诊断价值作一综述。
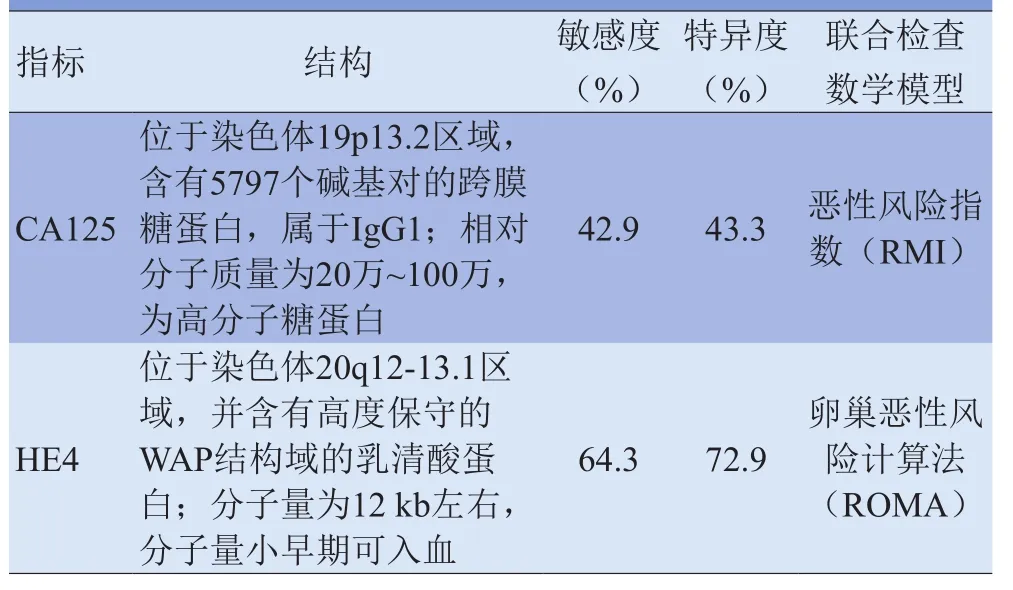
表1 HE4和CA125的结构及诊断卵巢癌的特点
1 HE4
1.1 HE4的结构、功能及其在组织中的表达 HE4基因是1991年由Kirchhoff等[6]在人附睾远端上皮细胞中发现的,一个酸性、小的单信号肽和半胱氨酸丰富的多肽为特点的小分子分泌蛋白,是乳清酸蛋白结构域家族中的一员,可能是一种与精子成熟有关的蛋白酶抑制剂。1999年Schummer等[7]分析了不同来源的卵巢癌及癌旁组织的基因表达水平,发现HE4基因与卵巢癌有关,HE4 mRNA在卵巢癌组织中高表达,但在癌旁组织中不表达。2003年Hellström等[2]通过酶联免疫吸附测定法对比检测HE4和CA125在绝经后妇女血清中的水平,提出HE4的敏感度优于CA125,可以作为诊断卵巢癌的肿瘤标志物。2005年Drapkin等[8]用免疫组化方法测定了HE4在不同类型卵巢癌中的表达水平,发现HE4在100%的卵巢子宫内膜样癌、93%的卵巢浆液性癌及50%的卵巢透明细胞癌中表达,而在卵巢黏液性癌及正常卵巢组织中不表达。Huhtinen等[9]研究发现,CA125在所有类型的子宫内膜异位症中均升高;而HE4在非卵巢性子宫内膜异位症中升高,在卵巢性子宫内膜异位症中下降,提示HE4联合CA125检测可以提高卵巢癌诊断及鉴别诊断的准确率。
1.2 HE4在卵巢癌早期诊断及鉴别诊断中的应用 Havrilesky等[3]通过检测不同分期卵巢癌患者血清中的HE4发现,HE4诊断早期卵巢癌(I、II期)的敏感度(64.3%)高于CA125(42.9%)。2008年Moore等[4]研究了HE4、CA125、可溶性间皮素相关蛋白、糖类抗原72-4等9种肿瘤标志物在67例侵袭性卵巢上皮性癌和166例卵巢良性疾病患者血清中的水平,发现在特异度同为95%的情况下,单一HE4诊断卵巢癌的敏感度最高(72.9%),高于CA125的43.3%;联合检测时,CA125和HE4的敏感度最高(76.4%),在此基础上再联合其他标志物检测不能提高诊断敏感度。2011年景晓刚等[10]分析CA125、HE4检测影像学检查(彩色多普勒超声、CT、MRI)在卵巢上皮性癌诊断中的价值,发现CA125和HE4联合诊断在卵巢癌中的阳性检出率(95.2%)较任一单一标志物的阳性检出率(CA125为76.2%、HE4为78.6%)高,并提出CA125、HE4联合影像学检查可以进一步提高卵巢癌诊断的敏感度和准确率。2009年Moore等[11]根据血清HE4、CA125测值及绝经状态提出了卵巢恶性风险计算法(the risk of ovarian malignancy algorithm, ROMA),计算卵巢的风险预测指数(PI)。未绝经女性PI=-12.0+2.38×LN(HE4)+0.0626×LN (CA125);绝经女性PI=-8.09+1.04×LN(HE4)+0.732×LN (CA125);风险预测概率=exp(PI)/[1+exp(PI)]。
未绝经女性患卵巢癌高风险的有效检测临界点为13.1%,<13.1%提示低风险;绝经女性患卵巢癌高风险的有效检测临界点为27.7%,<27.7%提示低风险。ROMA法将75.0%的绝经后良性肿瘤划入低风险组,将92.3%的卵巢上皮癌和交界性肿瘤划入高风险组,有助于卵巢癌的早发现、早诊治。HE4和ROMA法已被美国食品药品监督管理局批准用来评价卵巢癌[12]。2010年Moore等[5]研究表明,ROMA法优于基于超声、CA125及绝经状态的恶性风险指数,有望成为筛查高危患者的首选方法,但ROMA法对绝经前患者卵巢癌的风险预测有待进一步研究。
1.3 HE4在卵巢癌疗效评估、复发监测中的应用 HE4不仅有助于卵巢癌的早期诊断及良恶性鉴别,也是术前评估、疗效预测及判断有无复发的重要指标。Midulla等[13]研究HE4联合多层螺旋CT对晚期卵巢癌进展的诊断价值,发现严重腹膜种植、网膜增厚组HE4水平明显高于单个或多个小腹膜种植转移组(P<0.0001);淋巴结转移的广泛程度与HE4水平显著相关(P<0.0001),淋巴结转移越广泛,HE4水平越高。Angioli等[14]研究表明HE4对晚期卵巢癌患者理想肿瘤细胞减灭术术前评估优于CA125。Hynninen等[15]评估HE4监测晚期卵巢癌患者化疗疗效的价值,发现HE4水平与影像学表现及临床疗效反应一致,新辅助化疗组影像学检查联合HE4评估优于联合CA125。卵巢癌患者术后HE4水平较术前明显下降[16]。Anastasi等[17]研究发现,复发性卵巢癌患者血清HE4水平升高较CA125升高早5~8个月。
2 影像学方法在卵巢癌中的应用
目前,应用于卵巢癌的影像学方法主要有超声、CT、MRI、正电子发射计算机断层显像(PET/CT),在卵巢癌术前分期、疗效预测及复发监测等方面发挥着重要作用。不同影像学方法在卵巢肿瘤的应用中优势不同。
2.1 超声 卵巢癌早期诊断方法主要是超声和肿瘤标志物的测定,尤其是经阴道超声检查。卵巢癌的二维超声表现为外形不规则肿块,呈多房囊实性、分隔厚、多乳头,常伴腹腔积液。彩色多普勒血流显像示肿块内高速低阻的动脉血,分布于肿块实质如中央区、囊内乳头、分隔上,血管呈条状、树枝状,甚至团状分布,阻力指数多小于0.4。超声造影在揭示肿瘤的血流灌注信息方面更具优越性,是灰阶超声及彩色多普勒血流显像的补充。Wang等[18]研究卵巢肿瘤超声造影特点及其微血管密度,发现超声造影可以反映卵巢良恶性肿瘤的微血管密度;另外,超声造影引导穿刺可以有效地降低术前病理诊断的假阴性率。超声造影的敏感区域同时也可以作为术中冰冻病理取材的理想部位[19]。RMI对卵巢癌的临床诊断效能优于单一超声检查及CAl25[20]。Macuks等[21]研究显示HE4、CA125结合超声特点和绝经状态对卵巢肿瘤的鉴别有较高的准确率。
2.2 CT CT对卵巢肿瘤大体形态、病变范围、分期及良恶性的判定优于超声。一般来说,卵巢肿块大于4 cm,其内见大于3 mm的间隔、乳头状或结节状影,以及不同程度的实性成分,多提示恶性病变。邻近器官受累、盆壁受侵、腹膜、网膜病变、腹水、盆腔淋巴结肿大,更预示恶性。CT增强扫描有助于显示肿瘤的实质成分,但良性肿瘤亦可能有明显强化,不能单纯依据强化率来判断病灶的性质。此外,原发性肿瘤和转移性肿瘤的影像学表现无显著差异,所以在诊断卵巢癌时,无论有无原发性病灶,均应与转移性肿瘤相鉴别[22]。CT对术前分期和治疗方案的制订有重要意义[23]。MR和CT比超声对腹膜转移敏感,CT对盆腔淋巴结探测准确率为57%、MR为76%[24]。卵巢癌患者经标准治疗后临床症状缓解,然而53%的患者仍会出现肿瘤复发,其中铂类耐药的复发性卵巢癌患者采用非铂类单药全身化疗有效率低于20%,因此,局部控制患者的复发病灶尤其重要。CT、超声等影像学方法及三维治疗计划系统的出现,使放射性粒子组织间植入治疗肿瘤的创伤更小、定位更精确、并发症发生率更低。李常仑等[25]采用CT引导下125I放射性粒子组织间植入治疗复发性卵巢癌,发现其近期疗效好、并发症少。Manganaro等[26]研究显示血清HE4含量结合增强CT检查可以促进上皮性卵巢癌复发监控管理。
2.3 MRI MRI是目前妇科肿瘤诊断、分期及制订治疗方案依据。Medeiros等[27]系统性定量分析表明MRI区分良恶性卵巢肿瘤的敏感度、特异度分别为92%、85%。Anastasi等[28]报道了1例有家族乳腺癌和卵巢癌病史的盆腔肿块患者,发现盆腔MRI检查联合血清HE4和CA125水平可以为鉴别盆腔良恶性占位提供依据。功能MRI作为常规MRI的补充,可以为卵巢肿瘤的诊断提供生物学信息及功能参数。DWI是目前唯一一种无创性地反映分子扩散特征的成像方法。利用ADC值来量化水分子扩散运动的变化程度,在肿瘤疗效的判定、预测方面具有重要价值。Takeuchi等[29]报道当ADC值为1.15×10-3mm2/s时,诊断卵巢良恶性肿瘤的敏感度为74%,特异度为80%,阳性预测值为94%,阴性预测值为44%。当ADC值为1.0×10-3mm2/s时,诊断卵巢良恶性肿瘤的敏感度为46%,特异度为100%,阳性预测值为100%,阴性预测值为32%。良、恶性肿瘤ADC值存在交叉,可能原因是一些恶性肿瘤的液化坏死成分导致ADC值升高,一些良性肿瘤如纤维瘤限制了水分子的扩散导致ADC值降低。扩散加权背景抑制成像(diffusion weighed imaging with background suppression, DWIBS)是由日本学者开发的DWI新技术,其将DWI与脂肪抑制和快速成像技术相结合,获得不受呼吸限制的DWI影像,使DWI在全身检查中应用[30]。DWIBS经3D-MIP重建及黑白反转可得到类PET图像[31]。DWIBS突出病变区域的扩散加权对比,大大提高了病变组织,尤其是恶性肿瘤及转移瘤的检出率。动态增强MRI(DCE-MRI)在卵巢肿瘤的定性、鉴别及抗肿瘤血管生成干预治疗监测等方面受到越来越多的关注。已有研究证明肿瘤的强化程度与肿瘤的血管生成情况及其相关指标如微血管密度、血管内皮生长因子等相关[32]。国外研究者发现采用定量DCE-MRI可以较准确地提示恶性肿瘤,DCE-MRI在良恶性卵巢肿瘤中的含量差异有统计学意义[33]。目前应用于卵巢癌的MRI波谱分析检测的化学物质主要以胆碱峰、乳酸峰、脂质峰为主。
2.4 PET/CT PET/CT可以从肿瘤细胞代谢旺盛的角度早期发现病变,并与CT融合准确定位,提高卵巢癌转移和复发的早期检出率,特别是CA125阴性、常规影像不易发现的部位或不易定性的软组织影,如肝被膜下、腹膜、肠系膜等,有学者建议临床怀疑卵巢癌复发时,PET/CT应作为首选影像学检查方法[34]。尽管18F-FDG PET/CT对卵巢癌转移和复发的诊断有很大的优势,但仍存在一定的局限性。主要是因为炎性病变、肉芽肿等同样可以摄取18F-FDG,混淆炎症与肿瘤之间的鉴别;另外腹部肠道、盆腔膀胱中的本底值过高,不利于病灶的显示。一些新的代谢类显像剂正逐步应用于临床[35]。相信在不久的将来PET/CT会发挥越来越重要的作用。
3 展望
卵巢癌作为女性常见生殖系统肿瘤,其病死率高、危害大,早期诊断及准确分期对于提高肿瘤患者的生存率尤为重要。HE4分子量小,早期可分泌入血;在正常卵巢组织中不表达,而在卵巢癌中高表达;HE4的表达独立于CA125,单独检测优于CA125,且二者联合检测可以提高诊断能力;HE4水平在卵巢癌术后明显降低,可以作为卵巢癌病情监测和疗效观察的指标。然而,其在肿瘤分期诊断方面明显不足,而影像学检查技术在此方面优势明显,不仅可以准确地判断肿瘤的良恶性程度,而且可以确定肿瘤部位、有无邻近器官侵犯,为肿瘤患者的预后情况提供判断依据。目前关于HE4测值、ROMA值与卵巢癌影像学表现的相关性,以及联合HE4和影像学检查评价卵巢癌的研究较少,HE4在卵巢癌影像学诊断中的价值有待进一步探究。
[1] Li J, Dowdy S, Tipton T, et al. HE4 as a biomarker for ovarian and endometrial cancer management. Expert Rev Mol Diagn, 2009, 9(6): 555-566.
[2] Hellström I, Raycraft J, Hayden-Ledbetter M, et al. The HE4 (WFDC2) protein is a biomarker for ovarian carcinoma. Cancer Res, 2003, 63(13): 3695-3700.
[3] Havrilesky LJ, Whitehead CM, Rubatt JM, et al. Evaluation of biomarker panels for early stage ovarian cancer detection and monitoring for disease recurrence. Gynecol Oncol, 2008, 110(3): 374-382.
[4] Moore RG, Brown AK, Miller MC, et al. The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass. Gynecol Oncol, 2008, 108(2): 402-408.
[5] Moore RG, Jabre-Raughley M, Brown AK, et al. Comparison of a novel multiple marker assay vs the risk of malignancy index for the prediction of epithelial ovarian cancer in patients with a pelvic mass. Am J Obstet Gynecol, 2010, 203(3): 228.e1-228.e6.
[6] Kirchhoff C, Habben I, Ivell R, et al. A major human epididymisspecific cDNA encodes a protein with sequence homology to extracellular proteinase inhibitors. Biol Reprod, 1991, 45(2): 350-357.
[7] Schummer M, Ng WV, Bumgarner RE, et al. Comparative hybridization of an array of 21,500 ovarian cDNAs for the discovery of genes overexpressed in ovarian carcinomas. Gene, 1999, 238(2): 375-385.
[8] Drapkin R, von Horsten HH, Lin Y, et al. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas. Cancer Res, 2005, 65(6): 2162-2169.
[9] Huhtinen K, Suvitie P, Hiissa J, et al. Serum HE4 concentration differentiates malignant ovarian tumours from ovarian endometriotic cysts. Br J Cancer, 2009, 100(8): 1315-1319.
[10] 景晓刚, 王贵吉, 裴迎新, 等. 血清CA125、HE4检测联合影像学检查在卵巢上皮癌诊断中的临床价值. 第三军医大学学报, 2011(6): 644-645.
[11] Moore RG, McMeekin DS, Brown AK, et al. A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass. Gynecol Oncol, 2009, 112(1): 40-46.
[12] Simmons AR, Baggerly K, Bast RC. The emerging role of HE4 in the evaluation of epithelial ovarian and endometrial carcinomas. Oncology (Williston Park), 2013, 27(6): 548-556.
[13] Midulla C, Manganaro L, Longo F, et al. HE4 combined with MDCT imaging is a good marker in the evaluation of disease extension in advanced epithelial ovarian carcinoma. Tumour Biol, 2012, 33(5): 1291-1298.
[14] Angioli R, Plotti F, Capriglione S, et al. Can the preoperative HE4 level predict optimal cytoreduction in patients with advanced ovarian carcinoma? Gynecol Oncol, 2013, 128(3): 579-583.
[15] Hynninen J, Auranen A, Dean K, et al. Serum HE4 profle during primary chemotherapy of epithelial ovarian cancer. Int J Gynecol Cancer, 2011, 21(9): 1573-1578.
[16] 张春艳. 卵巢癌患者手术治疗前后血清CA125、Hcy和HE4检测的临床意义. 放射免疫学杂志, 2012(4): 406-408.
[17] Anastasi E, Marchei GG, Viggiani V, et al. HE4: a new potential early biomarker for the recurrence of ovarian cancer. Tumour Biol, 2010, 31(2): 113-119.
[18] Wang J, Lv F, Fei X, et al. Study on the characteristics of contrastenhanced ultrasound and its utility in assessing the microvessel density in ovarian tumors or tumor-like lesions. Int J Biol Sci, 2011, 7(5): 600-606.
[19] 高毅, 黄雅芳, 常才. 经阴道超声造影诊断附件肿块的价值. 中华超声影像学杂志, 2008, 17(12): 1066-1068.
[20] Antovska SV, Bashevska N, Aleksioska N. Predictive values of the ultrasound parameters, CA-125 and risk of malignancy index in patients with ovarian cancer. Klin Onkol, 2011, 24(6): 435-442.
[21] Macuks R, Baidekalna I, Donina S. An ovarian cancer malignancy risk index composed of HE4, CA125, ultrasonographic score, and menopausal status: use in differentiation of ovarian cancers and benign lesions. Tumour Biol, 2012, 33(5): 1811-1817.
[22] Lee SJ, Bae JH, Lee AW, et al. Clinical characteristics of metastatic tumors to the ovaries. J Korean Med Sci, 2009, 24(1): 114-119.
[23] Forstner R. Radiological staging of ovarian cancer: imaging findings and contribution of CT and MRI. Eur Radiol, 2007, 17(12): 3223-3235.
[24] Tempany CM, Zou KH, Silverman SG, et al. Staging of advanced ovarian cancer: comparison of imaging modalities--report from the Radiological Diagnostic Oncology Group. Radiology, 2000, 215(3): 761-767.
[25] 李常仑, 刘继红, 黄金华, 等. CT引导下125I放射性粒子组织间植入治疗复发性卵巢癌. 中华医学杂志, 2012, 92(39): 2760-2763.
[26] Manganaro L, Michienzi S, Vinci V, et al. Serum HE4 levels combined with CE CT imaging improve the management of monitoring women affected by epithelial ovarian cancer. Oncol Rep, 2013, 30(5): 2481-2487.
[27] Medeiros LR, Freitas LB, Rosa DD, et al. Accuracy of magnetic resonance imaging in ovarian tumor: a systematic quantitative review. Am J Obstet Gynecol, 2011, 204(1): 67.e1-67.e10.
[28] Anastasi E, Granato T, Coppa A, et al. HE4 in the differential diagnosis of a pelvic mass: a case report. Int J Mol Sci, 2011, 12(1): 627-632.
[29] Takeuchi M, Matsuzaki K, Nishitani H. Diffusion-weighted magnetic resonance imaging of ovarian tumors: differentiation of benign and malignant solid components of ovarian masses. J Comput Assist Tomogr, 2010, 34(2): 173-176.
[30] Motoshima S, Irie H, Nakazono T, et al. Diffusion-weighted MR imaging in gynecologic cancers. J Gynecol Oncol, 2011, 22(4): 275-287.
[31] Ho KC, Lin G, Wang JJ, et al. Correlation of apparent diffusion coefficients measured by 3T diffusion-weighted MRI and SUV from FDG PET/CT in primary cervical cancer. Eur J Nucl Med Mol Imaging, 2009, 36(2): 200-208.
[32] Alvarez Moreno E, Jimenez de la Peña M, Cano Alonso R. Role of new functional MRI techniques in the diagnosis, staging, and followup of gynecological cancer: comparison with PET-CT. Radiol Res Pract, 2012, (2012): 219546.
[33] Dilks P, Narayanan P, Reznek R, et al. Can quantitative dynamic contrast-enhanced MRI independently characterize an ovarian mass? Eur Radiol, 2010, 20(9): 2176-2183.
[34] Gu P, Pan LL, Wu SQ, et al. CA 125, PET alone, PET-CT, CT and MRI in diagnosing recurrent ovarian carcinoma: a systematic review and meta-analysis. Eur J Radiol, 2009, 71(1): 164-174.
[35] Yoshida Y, Kurokawa T, Tsujikawa T, et al. Positron emission tomography in ovarian cancer: 18F-deoxy-glucose and 16alpha-18F-fuoro-17beta-estradiol PET. J Ovarian Res, 2009, 2(1): 7.
R737.31;R445
2013-08-14
2013-10-24
(责任编辑 唐 洁)
兰州大学第一医院放射科 甘肃兰州 730000
郭顺林 E-mail: guoshunlin@msn.com
10.3969/j.issn.1005-5185.2014.03.021

