钙蛋白酶Ⅱ在萘性白内障氧化损伤中的作用
陈燕 蒋永祥 杨晋 卢奕
`
·基础研究·
钙蛋白酶Ⅱ在萘性白内障氧化损伤中的作用
陈燕 蒋永祥 杨晋 卢奕
目的 通过对萘性白内障氧化损伤及钙蛋白酶Ⅱ活性的研究,揭示钙蛋白酶Ⅱ在白内障中的作用。方法 30只150 g 雌性SD大鼠被随机分成对照组和萘组。每周进行裂隙灯照相及灰度分析;第9周实验结束时进行血浆及晶状体中还原型谷胱甘肽(GSH)、丙二醛(MDA)、细胞内外Ca2+的检测,通过酪蛋白的水解程度检测钙蛋白酶Ⅱ活性的变化。结果 第3周、第6周及第9周萘组皮质灰度值分别为51.98±3.17、52.19±2.96、53.61±3.79, 对照组分别为69.47±3.13、81.36±3.25、98.17±3.86,自第3周起2组差异具有统计学意义(P<0.01)。第3周、第6周及第9周萘组核灰度值分别为55.76±3.95、55.98±3.14、56.41±2.96, 对照组分别为58.67±3.02、65.13±3.21、69.48±2.83,自第3周起2组差异具有统计学意义(P<0.01)。第9周时,萘组血浆及晶状体中GSH水平低于对照组,而MDA明显高于对照组,差异具有统计学意义(P<0.05)。第9周时,萘组细胞内外Ca2+水平明显高于对照组,而钙蛋白酶活性明显高于对照组,差异具有统计学意义(P<0.05 )。结论 钙蛋白酶Ⅱ的活性升高在白内障的氧化损伤中起到重要作用。(中国眼耳鼻喉科杂志,2014,14:273-277)
萘性白内障; 还原型谷胱甘肽; 丙二醛; 钙蛋白酶 Ⅱ
年龄相关性白内障是世界范围内首要的致盲原因[1],我国一项流行病学研究[2]表明,致盲和致低视力眼病中,白内障占46.8%。随着人口的老龄化, 新生的年龄相关性白内障患者也将逐年增加,预防与治疗年龄相关性白内障成为老年人视力保健的首要问题[3]。
年龄相关性白内障模型的建立一直是困扰白内障研究者的难题。有研究认为,大鼠萘性白内障模型是一种理想的用于研究人类年龄相关性白内障发病机制的动物模型,原因在于两者在白内障形成机制方面均主要与氧化应激相关。萘在体内的代谢过程如下:口服的萘到达肝脏后经P-450氧化成为萘二氢二醇,再通过血-房水屏障进入房水到达晶状体内,在萘二氢二醇脱氢酶作用下生成二羟基萘,二羟基萘进一步通过自动氧化最终变成萘醌,萘及其代谢产物在代谢过程中均可引起组织的氧化损伤,从而导致白内障的发生[4]。但目前对萘性白内障的作用机制及其与年龄相关性白内障的相似性方面尚缺乏全面深入的研究。
钙蛋白酶参与细胞骨架蛋白重整、细胞转化和迁移等细胞活动的调节[5]。细胞钙蛋白酶 Ⅱ 是钙蛋白酶家族的典型代表,在诱导啮齿类动物的白内障发生中起到重要作用[6]。钙蛋白酶 Ⅱ在氧化损伤所致白内障中的作用尚有待进一步探讨。
本研究的目的在于建立萘性白内障模型,通过对其形态学、分子生物学的研究,探讨萘性白内障作为年龄相关性白内障模型的可靠性及可行性。在此基础上,初步探讨钙蛋白Ⅱ在萘性白内障中的活性变化,为进一步探讨氧化损伤性白内障的预防和治疗奠定基础。
1 材料与方法
1.1 萘性白内障动物模型的建立及分组
1.1.1 动物及试剂 SD 纯系雌性大鼠30只,体重150~160 g。随机分为2组,分笼饲养,自由摄食(标准饲料),动物房室温为(25±2) ℃,通风良好。动物及饲料均由复旦大学上海医学院实验动物中心提供。 试剂: 萘、石蜡(国药集团化学试剂有限公司),萘溶于石蜡,配成0.1 g/mL溶液。
1.1.2 分组 实验前用1%阿托品散瞳,晶状体均呈透明状态。A 组15只,萘灌服[萘初始计量0.5 mg/(kg·d),3 d后改为1 mg/(kg·d),每日灌服1次,直至第9周末处死]。B组15只,无特殊处理[4]。
1.2 裂隙灯观察及晶状体的灰度测量 观察方法:运用裂隙灯图像分析系统进行观察和图像采集,每周1次[7]。使用仪器:722型可见光分光光度计(上海第三分析仪器厂),裂隙灯图像分析系统:由中国中医研究院眼科医院和苏州医疗器械厂共同研制,由裂隙灯显微镜数字摄像和计算机分析处理两部分组成,可以进行图像灰度分析[6]。采集方法采用斜照法,日光灯照射为背景光线强度,10倍放大下拍照。大鼠眼平面正对目镜,45°光线裂隙光带照射, 聚焦于晶状体中外1/4交界处。每次检查前用照度计进行光强度测定, 使每次检查光强度保持一致。用仪器自带软件分析晶状体相对密度:在同等背景亮度下,每张图选取面积15 mm2的竖椭圆形核区域,分析该区域的灰度,代表相对密度,3次测量的平均值作为该晶状体的核密度[8]。
1.3 标本的获取及相关指标测定
1.3.1 房水的抽取 饲养至第9周时,大鼠在麻醉下,用棉签轻轻擦去大鼠眼表泪液,用1 mL空针从角巩膜缘穿刺,用40 μL毛细管吸取房水。
1.3.2 采血 剪开大鼠眦角,迅速取下眼球,同时取眼眶血至含5%乙二胺四乙酸(EDTA)抗凝剂的塑料离心管中,4 ℃,800×g离心20 min,取血浆,标记,保存于-80 ℃冰箱。
1.3.3 晶状体组织用苏木素-伊红(hematoxylin-eosin, HE)染色 取每组3只晶状体,在冰浴中眼科剪由后路剪开眼球后壁,将巩膜向两侧分开,剥离晶状体,去净玻璃体,使用含2%的戊二醛及4%的多聚甲醛固定液(pH=7.2)固定,室温保存5 d。然后将样品包埋在石蜡中,切成5~6 μm厚的切片,HE染色,光镜下观察拍照。
1.4 细胞内钙及晶状体总钙的测量
1.4.1 血浆、房水及晶状体总钙的测量 使用原子吸收光谱法测定血浆、房水及晶状体中总的钙含量。使用仪器: 原子吸收分光光度计(PE-800,美国)。条件:波长422.7 nm,狭缝0.7 nm ,灯电流8 mA,气流17 L/min,乙炔流200 mL/min,进样体积20 μL。冻干的小牛血清标准品[(93.5±7.2) mg/L]用于质量控制,允许偏差5%[9]。
1.4.2 细胞内钙的测定 后路法取出的每组3只大鼠晶状体立即使用Hanks液漂洗3次,放入单孔培养皿,滴加到含5 μmol/L FL-3的Hanks液中,37 ℃负载30 min。用不含荧光探针的Hanks液清洗3遍,滴加少许Hanks液,共聚焦显微镜观察晶状体上皮细胞内的荧光强度并拍照。使用共聚焦显微镜的自带软件进行细胞内钙相对强度的测量。
1.5 生物化学指标的检测 用比色法测定血浆和晶状体内还原型谷胱甘肽(glutathione, GSH)及丙二醛(malondialdehyde, MDA)浓度的变化。GSH、MDA测定试剂盒均由南京建成生物工程公司提供。GSH浓度测量原理:GSH与二硫代二硝基苯甲酸反应生成5-硫代二硝基苯甲酸的阴离子呈现较稳定的黄色,在412 nm处测其吸光度即可计算出GSH的量。MDA 浓度测量原理:过氧化脂质降解产物中的MDA可与硫代巴比妥酸(thiobarbituric acid, TBA)反应生成红色产物,在532 nm处有最大吸收,因其底物为TBA,所以又称为TBA法。
1.6 钙蛋白酶活性测量 将BODIPY-FL探针溶解于二甲基亚砜(5 mg/0.5 mL),加上3.0 mL 75 mmol/L的NaHCO3,pH 8.5 含有30 mg的酪蛋白,避光下,振荡混合3 h,透析袋将水分透析,4 ℃保存。每组50 μL的晶状体上清液用0.86%的生理盐水稀释4倍后,加入250 μL的BODIPY-FL-酪蛋白(5 μg/mL),同时加入CaCl2(使Ca2+的浓度达到10 mmol/L),作用20 min后,用63 μL 100 mmol/L的EDTA终止反应,离心(4 000×g,30 min),上清液使用激发波长485 nm及发射波长535 nm的荧光分光光度计分析荧光强度的大小[10]。
1.7 统计学处理 采用配对设计样本的t检验比较2组间指标的均数差异有无统计学意义,P<0.05为差异有统计学意义。结果用均值±标准差表示。
2 结果
2.1 白内障裂隙灯照片及灰度分析 裂隙灯观察显示,第2周时,萘组有10只大鼠出现前囊膜下皮质泡状浑浊,与年龄相关性白内障的初发期形态相似。第3周时,13只萘组大鼠呈现轻度的绕核性白内障。第6周末,该组所有的大鼠均出现明显的绕核性白内障。对照组中,直到第9周实验结束时,均无明显皮质性白内障的发生 (图1 A )。第3周、第6周及第9周萘组皮质灰度值分别为:51.98±3.17、52.19±2.96、53.61±3.79, 对照组皮质灰度值分别为:69.47±3.13、81.36±3.25、98.17±3.86,自第3周开始2组皮质灰度值差异具有统计学意义(P<0.01)(图1B)。第3周、第6周及第9周萘组核灰度值分别为:55.76±3.95、55.98±3.14、56.41±2.96, 对照组核灰度值分别为:58.67±3.02、65.13±3.21、69.48±2.83,自第3周起,萘组晶状体核灰度值稍微高于对照组核灰度值, 差异具有统计学意义(P<0.01)(图1 C)。 2.2 晶状体组织学分析 组织学显示萘组生发区上皮细胞数量减少、形态结构异常,该组晶状体的皮质及核区呈嗜酸性染色(图2)。

图1. A.2组的裂隙灯图像随时间变化情况;B.绕核区灰度随时间变化趋势,从第3周始,萘组绕核区灰度值高于对照组(P<0.01);C.核灰度随时间变化趋势,从第3周始,萘组绕核区灰度值高于对照组(P<0.01);CTL:对照组;N:萘组

图2. 晶状体生发区(黑色细箭头,放大倍率×200), 晶状体皮质(距离前极300~350 μm)及核区(距离前极500 μm) (白箭头及黑色粗箭头,放大倍率×1 000),萘组生发区上皮细胞数量减少、形态结构异常,该组晶状体的皮质及核区呈嗜酸性染色;CTL:对照组; N:萘组
2.3 细胞内Ca2+变化 共聚焦显微镜下显示萘组与对照组相比,细胞内Ca2+明显升高,荧光强度的定量比较显示差异具有统计学意义,对照组:(10.63±4.59)吸光度值(absorbance unit, a.u.), 萘组:(46.53±6.75)a.u.(P<0.05 )(图 3)。
2.4 钙蛋白酶活性 本研究是根据与荧光探针结合的酪蛋白释放到上清液中的荧光素强度,来判断钙蛋白酶活性的大小。作用20 min后检测到的荧光素强度,对照组:(16.37±1.43)a.u.,萘组:(61.74±4.31)a.u.,差异具有统计学意义(P<0.05)。 结果表明,萘组钙蛋白酶活性明显高于对照组。
2.5 生物化学结果
2.5.1 血浆及晶状体GSH及MDA浓度 萘组血浆及晶状体中GSH浓度均明显低于对照组(P<0.05);萘组MDA浓度明显高于对照组(P<0.05)(表1)。这说明萘组脂质过氧化水平高于对照组。

图3. 共聚焦显微镜显示萘组比对照组细胞内Ca2+的荧光强度明显增加,差异具有统计学意义(P<0.05);CTL:对照组;N:萘组

组别GSH(mg/gprotein)血浆晶状体匀浆(10%)MDA(nmol/mgprotein)血浆晶状体匀浆(10%)对照组557.81±25.1297.53±3.360.85±0.360.33±0.003萘组379.17±11.9976.82±1.091.61±0.660.57±0.008t值7.5323.275⁃4.329⁃3.602P值0.0000.0020.0000.003
2.5.2 血浆、房水及晶状体中Ca2+水平的比较 萘组血浆、房水及晶状体Ca2+明显高于对照组(P<0.05), 这说明氧化应激可引起机体 Ca2+水平的升高(表2)。
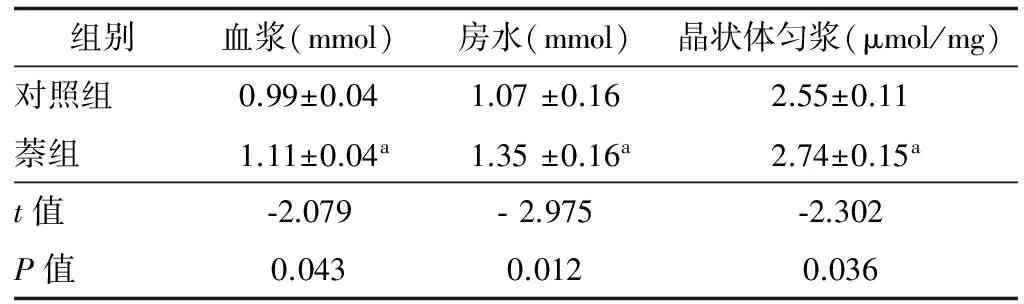
表2 血浆、房水及晶状体中Ca2+的浓度
注:a示和对照组相比,差异具有统计学意义(P<0.05)
3 讨论
萘性白内障模型具有诱发快、成模时间短、成模稳定的特点[11]。在我们的研究中,早期前囊膜下白内障的空泡状形态与年龄相关性白内障相似,这与以往的文献[12]结论一致。从第3周开始,萘组大鼠绕核性白内障开始形成。从形态学上讲,这种类型的白内障在年龄相关性白内障中不常见,而在先天性白内障中相对比较常见。也许萘所产生的氧化损伤已经导致大鼠基因学的改变[13]。氧化损伤对基因突变及表达的影响尚有待进一步研究。因此,萘性白内障作为年龄相关性白内障的模型在形态学上尚存在一定的不可靠性。
GSH 是晶状体中最主要的抗氧化剂,在晶状体中起到清除自由基和参与其他各种代谢活动[14]。氧化损伤可引起机体对还原型GSH的大量需求,导致组织中的GSH水平降低[15]。已有文献[13]表明GSH还原酶的减少与年龄相关性白内障的发生有关。本研究结果表明,萘性白内障组血浆及晶状体GSH水平均明显低于对照组,该变化与年龄相关性白内障的氧化损伤趋势一致[16]。
MDA是反映脂质过氧化水平的主要指标。晶状体膜不饱和脂肪酸支链的过氧化反应是白内障发生的重要机制之一[15]。丙二醛二烯轭合物可与晶状体蛋白上的氨基酸活性基因形成具有荧光性的Schiff碱基交联和分子凝聚蛋白质, 导致晶状体混浊[17]。本实验结果表明:萘组血浆及晶状体的MDA水平明显高于对照组,说明萘组的脂质过氧化水平高于对照组,血浆及晶状体MDA升高的水平与GSH降低的水平一致。
已有研究[18]表明钙蛋白酶Ⅱ在人类晶状体的成熟及白内障形成中均可能具有重要作用。本研究表明钙蛋白酶Ⅱ活性在萘性白内障中明显升高,作为同样以氧化损伤为主要作用机制的年龄相关性白内障[16],是否存在类似的钙蛋白酶Ⅱ活性升高的现象及能否用钙蛋白酶抑制剂抑制这种白内障的发生、发展等问题还有待进一步探讨。本研究使用的钙蛋白酶活性测量方法是应用钙蛋白酶致底物酪蛋白降解的原理,将晶状体匀浆与荧光素标志的酪蛋白反应一定时间后,通过EDTA引起酪蛋白的沉淀终止反应,检测上清液中荧光素强度,根据上清液中荧光素强弱就可判断酪蛋白的降解情况,从而判断钙蛋白酶活性[19]。本研究应用该原理发现氧化损伤可以导致钙蛋白酶活性的升高,该方法可用来研究人类年龄相关性白内障晶状体钙蛋白酶活性状况,为进一步通过钙蛋白酶抑制剂抑制年龄相关性白内障的发生、发展打下了技术基础。
总之,本研究相对系统地报道了萘性白内障大鼠的大体及组织细胞学损伤,并通过钙蛋白酶活性的研究证实了钙蛋白酶的活性升高在萘性白内障的氧化损伤中起到重要作用,为进一步通过钙蛋白酶抑制剂治疗氧化损伤所导致的白内障打下了基础。
从萘性白内障氧化损伤的机制及其早期形态而言,该白内障模型与年龄相关性白内障具有较好的一致性,但萘性白内障晚期形态与年龄相关性白内障具有较大差异。因此,大鼠萘性白内障模型用于模拟年龄相关性白内障尚存在不可靠的因素。但是,因为萘性白内障与年龄相关性白内障作用机制很大程度上均是以氧化损伤为主,作为一种成模稳定的白内障模型,对萘性白内障机制的探讨可为年龄相关性白内障的研究提供较多的指导意义。本研究关于钙蛋白酶在萘性白内障中的作用研究可为研究人类年龄相关性白内障提供参考。
[ 1 ] Congdon NG, Friedman DS, Lietman T.Important causes of visual impairment in the world today[J]. JAMA,2003,290(15):2057-2060.
[ 2 ] 郑宏,于普林,洪依舒,等.我国城乡老年人白内障的患病情况调查[J].中华流行病学杂志,2001,22(6):446-448.
[ 3 ] 张振平.晶状体病学[M].广州:广东科技出版社,2005:14-16.
[ 4 ] Lou MF, Xu GT, Zigler S Jr, et al. Inhibition of naphthalene cataract in rats by aldose reductase inhibitors[J]. Curr Eye Res,1996,15(4):423-432.
[ 5 ] Azam M, Andrabi SS, Sahr KE, et al. Disruption of the mouse mu-calpain gene reveals an essential role in platelet function[J].Mol Cell Biol,21(6):2213-2220.
[ 6 ] Goll DE, Thompson VF, Li H, et al. The calpain system[J]. Physiol Rev, 2003,83(3):731-801.
[ 7 ] 巢国俊,马文新,唐由之.裂隙灯图像分析系统对大鼠半乳糖性白内障的动态观察和定量分级[J].国际眼科杂志,2001,1(3):20-21.
[ 8 ] Chen Y, Yi L, Yan G, et al. alpha-Lipoic acid alters post-translational modifications and protects the chaperone activity of lens alpha-crysta-llin in naphthalene-induced cataract[J]. Curr Eye Res, 2010, 35(7): 620-630.
[ 9 ] Jia W, Wu H, Lu H, et al. Rapid and automatic on-plate desalting protocol for MALDI-MS: using imprinted hydrophobic polymer template[J].Proteomics, 2007,7(15): 2497-2506.
[10] Ma H, Nakajima E, Shih M , et al. Expression of calpain small subunit 2 in mammalian tissues[J]. Cur Eye Res,2004, 29(4) :337-347.
[11] Pandya U, Saini MK, Jin GF, et al. Dietary curcumin prevents ocular toxicity of naphthalene in rats[J].Toxicol Lett, 2000,115(3):195-204.
[12] Rossa V, Pau H. Is the experimental naphthalene cataract a model for human senile cataract?[J].Graefes Arch Clin Exp Ophthalmol, 1988,226(3):291-293.
[13] Brusick D, Small MS, Cavalieri EL, et al. Possible genotoxic modes of action for naphthalene[J].Regul Toxicol Pharmacol, 2008, 51(2suppl): S43-50.
[14] Kador PF, Randazzo J, Babb T, et al. Topical aldose reductase inhibitor formulations for effective lens drug delivery in a rat model for sugar cataracts[J]. J Ocul Pharmocal Th, 2007, 23(2):116-123.
[15] Truscott RJ. Truscott Age-related nuclear cataract—oxidation is the key[J]. Exp Eye Res,2005,80(5): 709-725.
[16] Chandrasena LG,De Silva LD, De Silva KI, et al. Changes in erythrocyte glucose-6-phosphate dehydrogenase(G6PD)and reduced glutathione (GSH) activities in the development of senile and diabetic cataracts[J].Southeast Asian J Trop Med Public Health, 2008,39(4):731-736.
[17] Gartaganis SP, Georgakopoulos CD, Patsoukis NE, et al. Glutathione and lipid peroxide changes in pseudoexfoliation syndrome[J].Curr Eye Res,2005,30(8): 647-651.
[18] Sanderson J, Marcantonio JM, Duncan G. A human lens model of cortical cataract:Ca2+-induced protein loss, vimentin cleavage and opacification[J]. Invest Ophthalmol Vis Sci, 2000,41(8):2255-2261.
[19] Potter DA, Tirnauer JS, Janssen R, et al. Calpain regulates actin remodeling during cell spreading[J]. J Cell Biol, 1998,141(3): 647-662.
(本文编辑 诸静英)
Effect of calpain Ⅱ on oxidative damage in naphthalene-induced cataract
CHENYan,JIANGYong-xiang,YANGJin,LUYi.
DepartmentofOphthalmology,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,China
Corresponding author:LU Yi, Email: luyiox@163.com
Objective To study the oxidative damage and the activity of calpain Ⅱ in naphthalene-induced cataract in order to clarify the possible mechanism for these changes. Methods Thirty female Sprague-Dawley rats weighted 150 g were randomly divided into two groups: the control group and the naphthalene group. Cataracts were induced by oral administration of 1 g naphthalene per kilogram body weight per day. The development of naphthalene-initiated cataract was monitored every week by slit lamp microscopy for 9 weeks, then the concentrations of reduced glutathione (GSH) and malondialdehyde (MDA) in rat lenses were measured to determine the role of oxidative stress in cataract induction. The total concentrations of Ca2+were measured by atomic absorption spectrometry and the intro-cell Ca2+were measured by co-focal microscopy. The activity of calpain Ⅱ was assayed fluorometrically with fluorescence-labeled casein. Results The cortex gray scales of the naphthalene group was 51.98±3.17, 52.19±2.96 and 53.61±3.79 at 3,6 and 9 weeks after the treatment respectively, and the cortex gray scales of the control group was 69.47±3.13, 81.36±3.25 and 98.17±3.86 at 3, 6 and 9 weeks respectively. The nucleus gray scales of the naphthalene group was 55.76±3.95, 55.98±3.14 and 56.41±2.96 at 3, 6 and 9 weeks after treatment respectively, and the nucleus gray scales of the control group was 58.67±3.02, 65.13±3.21 and 69.48±2.83 at 3, 6 and 9 weeks respectively. The lenses of rats fed with naphthalene exhibited higher light scattering than those of rats fed without naphthalene from 3 weeks after the treatment (P< 0.01). There were significant differences in GSH and MDA concentrations of plasma and lenses between the naphthalene group and the control group at 9 weeks after the treatment (P<0.05). The activity of calpain Ⅱ was increased in naphthalene-induced cataract at 9 weeks after the treatment (P<0.05). Conclusions The activity of calpain Ⅱ was raised by naphthalene, which might play important role in the oxidative damage in cataract. (Chin J Ophthalmol and Otorhinolaryngol,2014,14:273-277)
Naphthalene-induced cataract ; Glutathione; Malondialdehyde; Calpain Ⅱ
复旦大学附属眼耳鼻喉科医院眼科 上海 200031
卢奕(Email: luyiox@163.com)
现工作单位:上海交通大学附属第六人民医院眼科 上海 200233
2012-12-27)

