蟾毒灵在大鼠体内的药代动力学研究*
李 瑛 段林瑞 袁佳妮 曹 蔚 王四旺 涂宏海
第四军医大学药学院天然药物学教研室(西安710032)
蟾毒灵(bufalin)是中药蟾酥的主要有效成分,属于蟾毒甾烯类化合物,分子式为C24H34O4,相对分子量386,其疏水性较强,对多种类型肿瘤均具有强的抑制作用,有很广泛的应用前景[1-5]。研究表明,蟾毒灵通过诱导肿瘤细胞凋亡、分化及自噬,逆转多药耐药性,抑制肿瘤血管形成及对肿瘤细胞放射增敏作用等途径抑制肿瘤生长[6,7]。
本实验旨在采用一种简便高效液相法,考察蟾毒灵单体成分在大鼠体内的药代动力学特征,估算其静脉注射的主要药代动力学参数,为蟾毒灵的安全用药提供一定的参考依据。
1 材料与方法 1.1 仪器 日本岛津(SHIMADZU)LC-2010A HT型高效液相色谱仪(四元梯度泵,在线真空脱气机,紫外检测器);Sartorius ME235S型十万分之一电子分析天平(德国赛多利斯公司);Millipore超纯水系统(美国密理博公司);KQ-300E型超声波清洗器(昆山市超声仪器有限公司);HSC-24A型氮气吹干仪(天津恒奥科技有限公司);TD25-WS型高速离心机(湘仪离心机仪器有限公司);SHZ-D(III)型循环水真空泵(天津华鑫仪器有限公司);涡旋振荡器(海门市其林贝尔仪器制造有限公司);电子恒温水浴锅(北京化玻医疗器械有限公司)。
1.2 药品及试剂 色谱甲醇,乙腈(Burdick&Jackson美国Honeywell公司);磷酸(天津富宇精细化工有限公司);磷酸二氢钾(西安化学试剂厂);DMSO(西安沃尔森生物技术有限公司);羧甲基纤维素钠(天津市科密欧化学试剂有限公司);肝素钠(上海化学试剂厂);乙醚(天津市津东天正精细化学试剂厂);乙酸乙酯、石油醚(天津市红岩化学试剂厂)。
蟾毒灵标准品(纯度≥98.0%,陕西宝鸡辰光生物科技有限责任公司);华蟾酥毒基标准品(纯度≥98.0%,陕西宝鸡辰光生物科技有限责任公司)。
1.3 动物 SD大鼠20只,雄性,体重在280 g左右,由第四军医大学实验动物中心提供。
2 实验方法 2.1 色谱条件 色谱柱:大连依利特SinoChrom ODS-BP色谱柱(4.6 mm ×250 mm,5μm);流动相:乙腈∶0.5%磷酸二氢钾(50∶50)(用磷酸调节pH值为3.2);流速:1.0 mL/min;柱温:40℃;检测波长:296 nm;进样量:20 μL。
2.2 药液的制备与剂量 精密称取蟾毒灵标准品10 mg,以50μLDMSO助溶,0.5%的羧甲基纤维素钠稀释至10 mL,稀释过程中不断超声振荡,防止药物的沉淀,最终制备成均匀的混悬液。按照蟾毒灵10 mg/kg的剂量,采用灌胃方式给药。
精密称取华蟾酥毒基标准品2.5 mg,置于10 mL容量瓶中,加甲醇稀释至刻度,超声使之充分溶解,得到250μg/mL的华蟾酥毒基对照品溶液,作为内标溶液。
2.3 血浆样品的处理 精密吸取血浆200μL,置于10 mL离心管中,加入甲醇40μL,涡旋振荡使其混匀,加入乙酸乙酯和石油醚混合萃取液(1:1)4 mL,用涡旋振荡器充分振摇5 min,4000 r/min离心15 min,吸取上清液,氮气吹干后用200μL乙腈复溶,再以12000 r/min离心,取上清液20μL进样。
2.4 专属性试验 取大鼠空白血浆,空白血浆+蟾毒灵、华蟾酥毒基标准品和给药后血浆样品,按照“2.3”项下所述方法萃取处理后分别进样,进行色谱分析。
2.5 血浆中标准曲线的制备 精密称取蟾毒灵标准品3 mg,置于10 mL容量瓶中,加甲醇稀释至刻度,并用超声振荡使之充分溶解,得到300μg/mL的蟾毒灵标准品储备液。精密量取蟾毒灵标准品储备液适量,依次稀释成浓度分别为150、75、37.5、18.75、9.375、4.688、2.344μg/mL 的系列对照品溶液,4℃冰箱中避光保存备用。分别精密吸取上述系列对照品溶液及内标溶液各20μL,加入至200μL空白血浆中,配置成相应的系列浓度含药血浆样品溶液。按照“2.3”项下所述方法萃取处理后分别进样,进行色谱分析。用待测物浓度(X)为横坐标,待测物峰面积与内标峰面积的比值(Y)为纵坐标,进行线性回归,得出标准曲线方程。
2.6 方法回收率实验 取200 μL大鼠空白血浆共18份,分为高、中、低浓度3组,每组平行制备样品6份,加入蟾毒灵标准品适量,配置成浓度分别为 7.5 μg/mL、1.875 μg/mL、0.469 μg/mL 的含药血浆样品溶液,加入内标溶液,按照“2.3”项下所述方法萃取处理后分别进样,进行色谱分析。
2.7 精密度试验 取200 μL大鼠空白血浆共6份,分为日内、日间两组,加入蟾毒灵标准品适量,配置成浓度分别为7.5 μg/mL、1.875 μg/mL、0.469 μg/mL 的含药血浆样品溶液,加入内标溶液,按照“2.3”项下所述方法萃取处理,日内组1d内连续测定5次,日间组每天测定1次连续5d,记录蟾毒灵与内标峰面积,根据回归方程计算其浓度。
2.8 稳定性试验 取200 μL大鼠空白血浆共27份,分为室温稳定性、反复冻融稳定性、长期稳定性3组,每组分别加入蟾毒灵标准品适量,配置成浓度分别为 7.5 μg/mL、1.875 μg/mL、0.469 μg/mL 的含药血浆样品溶液,加入内标溶液,涡旋混匀,每组中各浓度样品平行制备3份。20℃室温下放置样品12 h,检测其室温稳定性;-20℃冰箱中反复冻融样品3次,检测其反复冻融稳定性;-80℃冰箱中冷冻放置样品7d,评价其长期稳定性。所有样品按照“2.3”项下所述方法萃取处理,进样后进行色谱分析,记录峰面积并按回归方程计算药物浓度。
2.9 大鼠体内的药动学实验 选取健康成年SD大鼠,实验前禁食12 h以上,自由饮水。灌胃给药后 2、5、15、30、45、60、90、120、240、360、600 min 时通过眼底静脉丛取血 0.5 mL,置于事先用肝素钠抗凝处理的1.5 mL离心管中,3500 r/min离心15 min,吸取上层血浆,按照“2.3”项下所述方法萃取处理,进样后进行色谱分析,记录峰面积并按回归方程计算药物浓度。
2.10 药时曲线与药代动力学参数 运用中国药理学会数学药理专业委员会编制的药物与统计(DrugAnd Statistics)简称DAS统计软件(2.1.1版)对血药浓度与时间进行药代动力学拟合计算,获得蟾毒灵单体给药药时曲线与相关的药代动力学参数。
3 结果 3.1 专属性试验 三者色谱图比较可知,本实验所采用色谱条件适宜,提取方法理想,血浆中不存在干扰蟾毒灵检测的内源性物质,专属性较强(图1)。

图1 专属性实验(A)空白血样;(B)空白血中加入蟾毒灵和内标;(C)蟾毒灵单体给药后血样;1 蟾毒灵;2 内标
3.2 血浆中标准曲线的制备 由试验可知,蟾毒灵的浓度和峰面积比之间有良好的线性关系,得到标准曲线方程为y=0.03981x-0.003(r=0.9997),其标准曲线见图 2。蟾毒灵在0.2344~15.0 μg/mL范围内,线性关系良好,符合分析测试要求,同时以信噪比为3:1确定其最低检测限(LOD)为0.06 μg/mL。
3.3 精密度实验 由测定结果可知(表1),所有样品的日内RSD小于3%,日间RSD小于5%,精密度良好,符合生物样品的质量控制要求。
3.4 回收率实验 结果如表2,所有样品的回收率均在92.34% ~101.61%之间,符合生物样品分析的质量控制要求。
3.5 稳定性实验 结果表明(表3),蟾毒灵在考察范围内稳定,可在考察范围内对蟾毒灵进行含量测定。
3.6 大鼠口服蟾毒灵单体的药代动力学试验 分析血药浓度数据并结合药时曲线可知(表4),单体口服给药后,蟾毒灵在大鼠体内迅速吸收,给药后2 min即可在血样中检测到,血药浓度约在15~30 min达到最大值,随时间的延长,大鼠血浆中蟾毒灵含量逐渐减少,在360 min左右浓度降至最低且趋于稳定,同一时间点各组数据之间存在着较大的差别,这可能与动物的个体差异和蟾毒灵的较强毒性有关。

图2 蟾毒灵血药浓度标准曲线

表1 蟾毒灵在大鼠血浆内的精密度测定结果(n=5)

表2 蟾毒灵在大鼠血浆内的回收率测定结果(n=6)
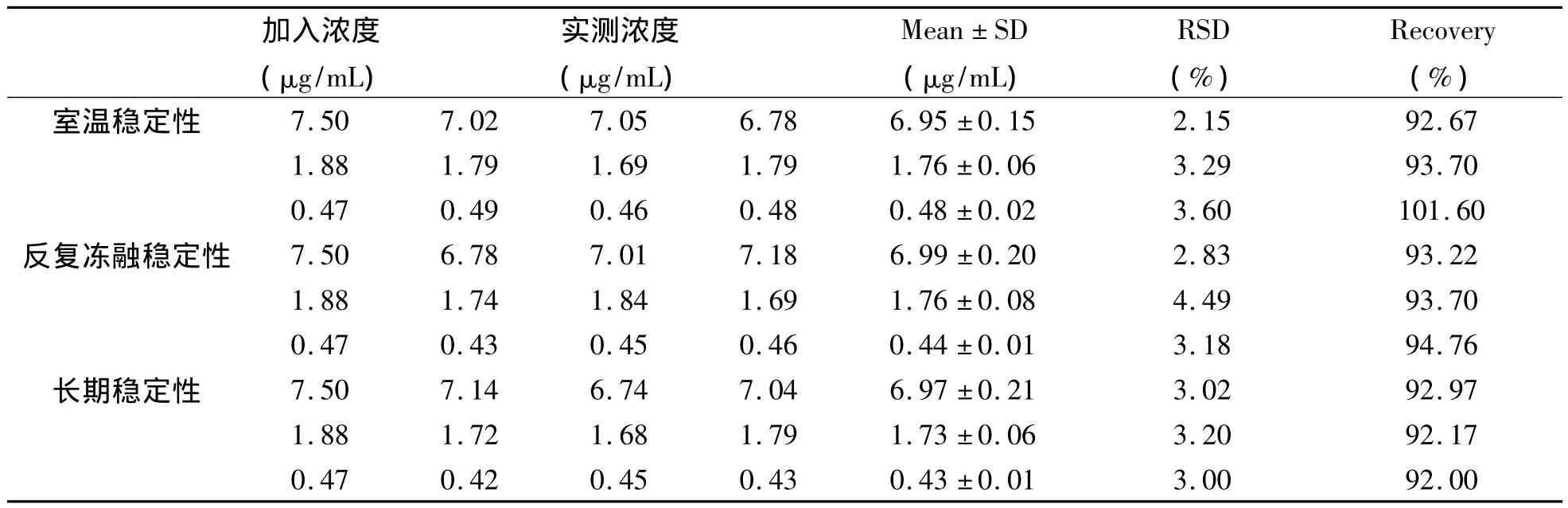
表3 蟾毒灵大鼠血浆样品稳定性(n=3)
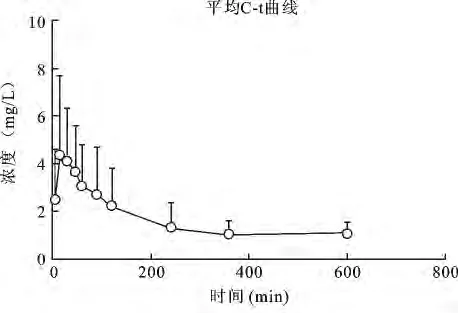
图3 大鼠口服蟾毒灵单体的药时曲线

表4 主要药代动力学参数
4 讨 论 药物动力学作为一门用数学分析手段处理的药物体内动态变化过程的科学,具有重大的理论价值和实用意义。蟾毒灵为蟾酥的主要成分,作用广泛,已引起国内外广泛关注。对其药代动力学的研究多局限于蟾酥提取物的复合成分研究[8-10]。本实验首次建立了测定大鼠血浆中蟾毒灵单体成分的的药动学特点,主要药动学参数及血药浓度-时间曲线,方法操作简单、结果准确可靠。
本实验结果可为中蟾蜍甾烯类成分体内测定方法的建立、其他给药途径药动学以及相对生物利用度等方面的研究提供参考。
[1] 宋长城,吕 祥.蟾毒灵抗肿瘤作用及其分子机制研究进展[J].现代肿瘤医学,2010 2010-11-22;18(9):1863-1866.
[2] Yin P,Wang Y,Qiu Y,Hou L,Liu X,Qin J,et al.Bufalin-loaded mPEG-PLGA-PLL-cRGD nanoparticles:preparation,cellular uptake,tissue distribution,and anticancer activity[J].Int J Nanomedicine 2012 2012-01-20;7:3961-3969.
[3] Xie CM,Chan WY,Yu S,Zhao J,Cheng CH.Bufalin induces autophagy-mediated cell death in human colon cancer cells through reactive oxygen species generation and JNK activation[J].Free Radic Biol Med 2011 2011-10-01;51(7):1365-1375.
[4] 韩健勇,董明慧,王 珏,等.蟾毒灵抗肿瘤作用研究进展[J].河南中医,2009 2009-08-17;29(7):724-726.
[5] 曹 蔚,李 瑛,段林瑞,等.蟾皮药材质量标准研究[J].陕西中医,2012,33(11):1539-1541.
[6] 李 瑛,曹 蔚,王四旺,等.安替可胶囊物效基础研究进展[J].亚太传统医药2012,(02).
[7] Qi F,Li A,Inagaki Y,Kokudo N,Tamura S,Nakata M,et al.Antitumor activity of extracts and compounds from the skin of the toad Bufo bufo gargarizans Cantor[J].Int Immunopharmacol 2011 2011-03-01;11(3):342-349.

