两株野鸭源新城疫病毒分离株F基因和HN基因的分子特性分析
徐 钰,解林红,耿海东,高晓龙,王海军,范胜涛,李元果,王铁成,吴长江,张晓田,孙贺廷,初 冬,高玉伟*
(1.国家林业局野生动物疫源疫病监测总站,辽宁沈阳110034;2.中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨150001;3.吉林农业大学动物科学技术学院,吉林长春130118;4.国家林业局长春野生动物疫病研究中心,吉林长春130122)
新城疫(Newcastle disease,ND)又名亚洲鸡瘟,是由新城疫病毒(Newcastle disease virus,NDV)引起的一种多病型的高度接触性急性传染病。本病传播快,具有很高的发病率和病死率,被列为我国进境动物的一类传染病。ND作为世界动物卫生组织(OIE)规定的必须报告的疫病与其他副黏病毒成员相比,其流行与传播更具广泛性,可引起世界性的大流行,对野生鸟类资源安全和家禽养殖业影响重大[1]。根据已有的文献报道,除家禽外,已证实有27目至少236种野生鸟类可以自然或者实验性感染NDV,其中抵抗力最强的是水鸟,最敏感的是群居鸟,环颈雉、鹌鹑、燕八哥、鹦鹉等无论是野生还是人工饲养的都可感染[2]。
NDV属副黏病毒科禽腮腺炎病毒属,是一种具有囊膜的单股、负链、不分阶段的RNA病毒,其基因组包含6个基因,按照3′-NP-P-M-F-HN-L-5′排列,分别编码6个主要结构蛋白[3]。根据NDV基因组长度、F基因和L基因序列,NDV可分为ClassⅠ类(1~9亚型)和ClassⅡ类(1~9亚型)两大分支,ClassⅠ类NDV绝大部分为弱毒株,其自然宿主是野生水鸟及活禽市场中的鸡。刘华雷等[4]2008年首次报道我国存在ClassⅠ类基因3型NDV弱毒株,随后,研究人员通过对我国ClassⅠ类NDV的分子流行病学调查分析表明,目前我国存在的ClassⅠ类NDV以2型和3型为主。
F蛋白具有使病毒脂蛋白囊膜与宿主细胞膜融合的功能,参与病毒的穿入过程。同时F蛋白是主要的宿主保护性抗原,可诱导机体产生中和抗体,F蛋白裂解位点的差异与病毒独立直接相关,根据F基因序列分析,所有强毒株裂解位点氨基酸残基为112R-R-Q-R/K-R-F117,弱毒株裂解位点为112E/GR/Q-Q-E/G/D-R-L117[5-6]。血凝素-神经氨酸酶糖蛋白(HN蛋白)在病毒脂质囊膜上形成纤突,具有血凝素和神经氨酸酶活性,其在病毒侵染过程中通过识别细胞受体,介导病毒吸附细胞膜,增强F蛋白的融合作用,并通过去除新合成病毒核衣壳蛋白上的唾液酸,对子代病毒粒子进行加工。HN基因是决定NDV的毒力、神经氨酸酶活性和血凝性等关键基因[7]。本研究对2013年从湖南长沙野鸭粪便中分离到的2株NDV弱毒株的F基因和HN基因进行扩增和测序,并对其核苷酸序列进行了遗传进化分析。
1 材料与方法
1.1 材料
1.1.1 病毒 NDV 分离株 HC911、HC984,2013年秋季分离自湖南长沙采集的野鸭粪便样本,由中国人民解放军军事医学科学院军事兽医研究所分离、鉴定、保存。
1.1.2 主要试剂 病毒 RNA提取试剂盒为BioFlux公司产品;反转录试剂盒AMV Reverse Transcriptase Kit为Promega公司产品;胶回收试剂盒E.I.N.ATMGel Extraction Kit为Omega公司产品;克隆载体pEASY-Blunt Cloning Kit、高保真DNA聚合酶TransStart Fastpfu DNA Polymerase为全式金公司产品;质粒提取试剂盒AxyPrep质粒小量制备试剂盒为AXYGEN公司产品。
1.2 方法
1.2.1 病毒RNA的提取、反转录 取200μL分离株的病毒尿囊液,按照BioFlux公司病毒RNA提取试剂盒使用说明书提取病毒RNA,然后按照Promega公司反转录试剂盒AMV Reverse Transcriptase Kit使用说明进行反转录,得其cDNA。
1.2.2 RT-PCR 25μL反应体系中包括以下各组成分:5× Fastpfu buffer 10μL,dNTP(2.5mm)5μL,上游引物1μL,下游引物1μL,模板(cDNA)2μL,ddwater 5μL,酶1μL。PCR扩增程序:95℃3min;95℃20s,50℃20s,72℃1min,共40个循环;72℃5min,4℃结束反应。取5μL PCR扩增产物,10g/L琼脂糖凝胶上电泳鉴定结果[8]。
1.2.3 PCR产物胶回收、克隆转化、质粒提取和序列测定 将PCR产物经胶回收纯化后,与pEASYBlunt Cloning Vetor进行连接、克隆转化,每个基因选择3个阳性重组单克隆,送吉林省库美生物科技有限公司进行测序。
1.2.4 F基因和HN基因进化树与同源性比较利用Lasergene软件对所测定的NDV毒株F基因序列和HN基因序列与ClassⅠ和ClassⅡ参考毒株[9]进行序列分析、核苷酸同源性比较。利用遗传进化分析软件MEGA6,采用Neighbor joining方法和Bootsrap值为1 000构建2株NDV毒株的F基因和HN基因的系统进化树[3]。
2 结果
2.1 HN基因和F基因的PCR扩增
经琼脂糖凝胶电泳,HN基因和F基因PCR扩增产物大小分别为2 054bp和1 694bp(图1)。
2.2 F基因序列和遗传进化分析
序列分析表明,2株NDV分离株HC911和HC984F基因编码区核苷酸长度为1 662bp,编码553个氨基酸,见表1。F基因碱性裂解位点序列为112E-R-Q-E-R-L117,与典型的NDV弱毒株的裂解位点序列特征一致,但是与减毒疫苗株La Sota的F蛋白裂解位点氨基酸序列112G-R-Q-G-R-L117不同。F蛋白氨基酸序列中存在5个潜在糖基化位点分别为85、191、366、471、541位,相对参考株缺少第447位潜在糖基化位点。
同源性分析表明,HC911、HC984与ClassⅠ类毒株之间核苷酸同源性在92.3%~93.8%之间,氨基酸同源性在94.4%~96.9%之间。
F基因遗传进化分析表明,HC911、HC981与我国首次分离到的ClassⅠ型NDV08-004同属于Genotype 3型,分离株与参考株F基因核苷酸序列间的系统进化树见图2。

表1 NDV分离株F蛋白氨基酸序列Table 1 The amino acid sequence of F protein of NDV isolates

图2 NDV分离株与参考株F基因核苷酸序列间的系统进化树Fig.2 The phylogenetic tree analysis of F gene between NDV isolates and reference strains
2.3 HN基因序列和遗传进化分析
序列分析表明,HC911和HC984的HN基因编码区核苷酸长度为1 851bp,编码616个氨基酸(表2)。同时,其氨基酸序列中存在4个潜在糖基化位点,分别是第49、119、341、433位。
同源性分析表明,HC911、HC984与ClassⅠ类毒株之间核苷酸同源性在91.6%~93.9%之间,氨基酸序列同源性在90.8~95.5%之间。
HN基因遗传分析结果与F基因遗传进化树一致,也属于Genotype 3型,NDV分离株与参考株HN基因核苷酸序列间的系统进化树见图3。

表2 NDV分离株HN蛋白氨基酸序列Table 2 The amino acid sequence of HN protein of NDV isolates
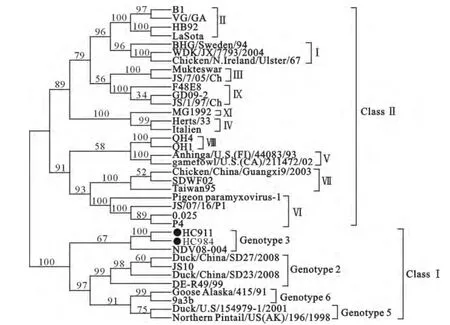
图3 NDV分离株与参考株HN基因核苷酸序列间的系统进化树Fig.3 The phylogenetic tree analysis of HN gene between NDV isolates and reference strains
3 讨论
F基因作为NDV的主要结构基因,与多种生物活性有关,是决定病毒毒力的关键因子。本研究分析的2株NDV分离株的F基因裂解位点的序列为112E-R-Q-E-R-L117,具有典型的NDV弱毒株特征。
糖基化位点在病毒糖蛋白折叠、蛋白质水解过程中发挥重要作用。但是研究表明,F基因单个或者多个糖基化位点的缺失对F蛋白表达几乎不产生影响,同时也不影响F蛋白转运至细胞表面[10]。大部分ClassⅠ类NDV毒株的F蛋白潜在糖基化位点有6个,即第85、191、366、447、471、541位。Sa-mal S等[11]还发现这些位点突变都不会对F蛋白碱性裂解位点产生影响。HC911和HC984的F蛋白第447位潜在糖基化位点的缺失不会对其致病性和毒力产生影响,其仍为弱毒株。
HN基因开放性阅读框长度影响HN蛋白结合含有唾液酸的受体的能力[12]。含有616个氨基酸的HN蛋白目前仅在NDV弱毒株中发现,而含有571个氨基酸的HN蛋白只在强毒株中检测到,但是NDV毒力的强弱主要还是由碱性裂解位点决定的。HC911和HC984的HN基因编码616个氨基酸,与遗传进化分析结果相一致[13]。
根据遗传进化分析表明,HC911和HC984属于ClassⅠ类Genotype 3型,该基因型在水鸟中曾被发现,说明该病毒可能通过野鸟—家禽的模式在自然界中循环。更重要的是,有研究证明ClassⅠ经气囊连续传代后可转变为强毒株[14],这就要求我们将ND及其宿主作为日常监测的重点予以加强,同时,有条件的地区可以针对ND开展专项监测工作。
[1]Yuan X,Wang Y,Li J,et al.Surveillance and molecular characterization of Newcastle disease virus in seafowl from coastal areas of China in 2011[J].Virus Genes,2013,46(2):377-382.
[2]夏咸柱,高宏伟,华育平.野生动物疫病学[M].北京:高等教育出版社,2011:445-456.
[3]李师师,赵焕云,张文东,等.云南省新城疫病毒分离株F基因和 HN基因克隆与序列分析[J].动物医学进展,2012,33(6):21-26.
[4]刘华雷,蒋小刚,张 维,等.一株ClassⅠ新城疫病毒中国分离株分子特性的研究[J].中国动物检疫,2008,25(8):30-33.
[5]Liu H,Chen F,Zhao Y,et al.Genomic characterization of the first class I Newcastle disease virus isolated from the mainland of China[J].Virus Genes,2010,40(3):365-371.
[6]刘佳佳,严专强,刘 迪,等.新城疫病毒广东基因Ⅶ型分离株的分离鉴定及F基因克隆与序列分析[J].动物医学进展,2013,34(10):50-53.
[7]Yuan P,Swanson K A,Leser G P,et al.Structure of the Newcastle disease virus hemagglutinin-neuraminidase(HN)ectodomain reveals a four-helix bundle stalk[J].Proc Natl Acad Sci USA,2011,108:14920-14925.
[8]徐守振,尹燕博.H9亚型禽流感病毒、新城疫病毒和传染性支气管炎病毒多重RT-PCR检测方法的建立[J].动物医学进展,2014,35(1):12-16.
[9]Liu K,Ma Y,Wang J,et al.Complete genome sequencing and analysis of an anti-tumor Newcastle disease virus strain[J].Gene,2013,525(1):47-57.
[10]Mirza A M,Iorio R M.A mutation in the stalk of the NDV HN protein prevents triggering of the F protein despite allowing efficient HN-F complex formation[J].J Virol,2013,87(15):8813-8815.
[11]Samal S,Khattar S K,Kumar S,et al.Coordinate deletion of N-glycans from the heptad repeats of the fusion F protein of Newcastle disease virus yields a hyperfusogenic virus with increased replication,virulence,and immunogenicity[J].J Virol,2012,86(5):2501-2511.
[12]Romer Oberdorfer A,Werner O,Veits J,et al.Contribution of the length of the HN protein and the sequence of the F protein cleavage site to Newcastle disease virus pathogenicity[J].J Gen Virol,2003,84(Pt 11):3121-3129.
[13]秦卓明,马保臣,何叶峰,等.新城疫病毒HN和F基因遗传变异相关性的研究[J].病毒学报,2006,2(46):227-232.
[14]于圣青,丁铲,Kishida N,等.新城疫病毒某水禽分离株经鸡体传代后由非致病型转变为速发型的研究[J].中国预防兽医学报,2003,25(1):59-64.

