基于生理药动学模型计算氟甲喹在家兔体内的药动学参数
杨 帆,杨 芳,赵振升,周变华,郝雪琴
(河南科技大学动物科技学院,河南洛阳471003)
氟甲喹(flumequine,FLU)为第2代喹诺酮类合成抗菌药,对革兰阴性菌有较好的杀灭效果[1-2]。其作用机理主要是通过抑制细菌DNA解旋酶A亚单位,干扰细菌DNA合成[3-4]。氟喹诺酮类药物因其高效广谱和价格低廉的特点,在家兔养殖中具有较好的应用前景。药动学是指导临床合理用药的一个有力工具,目前FLU的药动学研究已见于多种动物[5-9],但在家兔体内则未见相关报道。因此,阐明FLU在家兔体内的药动学特征对于临床合理使用该药具有重要意义。
生理药动学(physiologically based pharmacokinetics,PBPK)模型是一种模拟机体循环系统的血液流向,将各器官或组织相互联结起来而建立的整体模型[10]。该模型中包含了各组织的体积(V)和血流量(Q)、药物在各组织中的组织-血浆分配系数(P)、肝脏和肾脏中药物的清除率(Clhe和Clre)等参数,能够从机理上预测药物在动物体内的药动学特征[11-12]。
本研究通过建立FLU在家兔体内灌胃后的PBPK模型,获得灌胃后FLU在家兔体内的血浆药动学参数,为FLU在家兔养殖中的合理使用提供依据。
1 材料与方法
1.1 材料
本研究利用acslXtreme软件(AEgis Technologies公司产品;Version 3.0),以代码形式(高级连续仿真语言,acsl)建立此PBPK模型,其参数见表1[13]。

表1 家兔PBPK模型中生理学和解剖学参数Table 1 The physiological and anatomical parameters of rabbits used in the present PBPK model
1.2 方法
1.2.1 模型循环血流图设计 Villa R等[14]报道了家兔单次灌胃FLU(15mg/kg)后药物的组织分布特点,其研究结果显示口服后FLU吸收迅速完全,且分布广泛。此外,有研究表明FLU主要通过肝脏代谢从动物体内清除,其主要代谢产物为7-羟基氟甲喹[15]。Villa R 等[14]仅报道了肝脏、肾脏、肌肉、脂肪和肺脏中的药物浓度,未涉及血浆药物浓度,因此无法准确计算FLU在家兔体内的药动学参数。因此,本研究根据血液循环途径,建立了一个包含动脉和静脉血液在内的PBPK模型来预测FLU的血浆药动学参数,模型结构见图1。图1中QX为FLU在X组织中的组织-血浆分配系数;DOSE为给药剂量;Clhe为FLU的肝脏清除率;Kst和Ka则分别为胃排空速率常数和FLU的口服吸收速率常数;F为绝对生物利用度。

图1 氟甲喹灌胃给药后在家兔体内的PBPK模型结构图Fig.1 Schematic diagram of the physiologically based pharmacokinetic model for flumequine in rabbits after one single oral dose
在该模型中,药物灌胃后直接到达胃部,之后在胃排空(速率常数为Kst)作用下转移到肠道,并在肠道完全吸收(生物利用度为100%),吸收的药物直接通过门静脉进入肝脏,并在肝脏发生代谢。因FLU的代谢产物并无抗菌活性,因此为简化该模型,此处并未对代谢物浓度进行模拟。根据此前的报道[14],本研究中假定肝脏代谢是FLU的唯一清除途径,且该过程符合线性规律,而FLU在肝脏中的清除率以Clhe表示。
1.2.2 微分方程组的书写 按照质量平衡原理书写代表各个组织(或消化道内容物)中FLU浓度或质量随时间变化的微分方程,具体如下:
胃内容物:
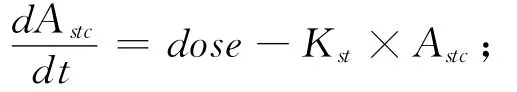
肠内容物:
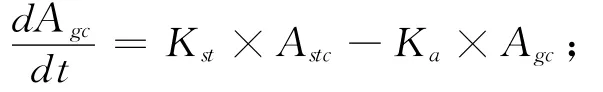
肝脏:

脂肪、肌肉、肾脏和其他组织:

x代表脂肪(f)、肌肉(m)、肾脏(k)和其他组织(r);肺脏:
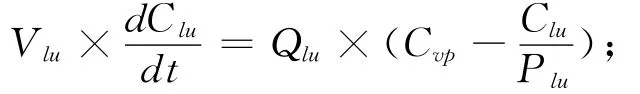
静脉血:

动脉血:
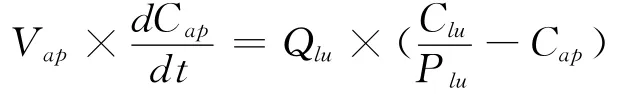
以上各式中Ci为i组织中FLU的浓度;Ai为i组织(或消化道内容物)中FLU的质量;Qi、Vi和Pi分别为i组织的血流量、体积和FLU的组织-血浆分配系数;而stc、gc、li、f、m、k、r、lu、vp 和ap 则分别是胃内容物、肠内容物、肝脏、脂肪、肌肉、肾脏、其他组织、肺脏、静脉血浆和动脉血浆的缩写;DOSE为灌胃给药剂量;Clhe为FLU的肝脏清除率;Kst和Ka则分别为胃排空速率常数和FLU的口服吸收速率常数。
1.2.3 模型参数 本模型中家兔的解剖学和生理学参数均来源于文献[13](表1),而FLU在各组织中的P、Clhe、Ka和Kst等参数,则利用联合国粮农组织(Food and Agriculture Organization,FAO)报道的组织浓度通过acslXtreme软件自带的参数优化程序优化得到。
1.2.4 PBPK模型的建立及验证 本文利用acsl语言建立代码型PBPK模型。即在acslXtreme软件中首先定义FLU的灌胃给药方案、家兔的体重和心输出量及模型中其他各个变量(V、Q、P及各速率常数等),并对这些变量进行赋值;之后以acsl语言书写1.2.2中的各微分方程,并进行导数化处理;此外还要定义模型运行参数,如步长、通信间隔、采样时间、计算方法等。模型建立成功后,对模型模拟得到的组织浓度与Villa R等[14]报道的数值进行比较来验证模型的有效性。
1.2.5 FLU在家兔体内药动学参数的计算 利用本文所建PBPK模型模拟得到家兔单次灌胃FLU(15mg/kg)后的血浆浓度-时间数据,之后利用 WinNonlin软件(美国Pharsight公司)以房室模型和非房室模型方法计算FLU在家兔体内的药动学参数。
2 结果
2.1 模型参数
家兔的生理学和解剖学参数均来源于文献[13](表1)。而FLU在各组织中的P值则通过参数优化获得,其数值如下:肌肉0.35、脂肪0.19、肝脏5.64,肾脏21.14,肺1.02,其他组织1.01;Clhe、Ka和 Kst的 数 值 则 分 别 为 6.01L/h、2.23h-1和0.23h-1。
2.2 模型验证
本文通过比较模型模拟值和文献报道值进行模型有效性验证,验证结果见图2。从图2中可见各组织中模型模拟浓度均与文献报道值吻合良好,说明模型具有较高的模拟精度。
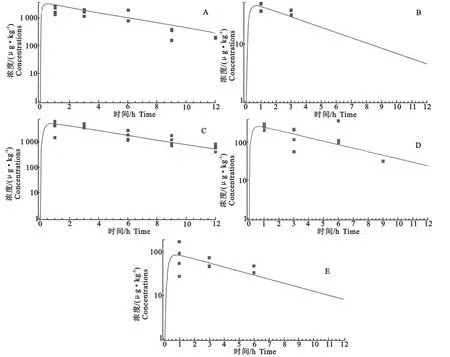
图2 模型模拟氟甲喹浓度值与文献报道值比较:曲线为模拟浓度,点为报道浓度Fig.2 Comparisons between simulated tissue concentrations(curves)and published ones(points)
2.3 FLU药动学参数的计算
运行模型得到FLU单次灌胃后在家兔血浆中的浓度-时间曲线(图3)。对该浓度-时间数据进行房室模型分析处理,以AIC判断法确定FLU在家兔体内属于几室模型。研究结果显示,家兔单次灌胃FLU后,最优拟合模型为二室开放模型,其药动学参数见表2。经非房室模型分析后其药动学参数与房室模型计算结果相差不大(表2)。

图3 家兔单次灌胃氟甲喹(15mg/kg)后血浆浓度-时间曲线Fig.3 Flumequine plasma concentrations versus time curve in rabbits after one single oral dose at 15mg/kg
3 讨论
目前,国内有关PBPK模型的研究多集中在猪和禽上。蒋智钢等[11]建立了恩诺沙星在猪体内的PBPK模型,然后利用种属间外推预测了绵羊单次静脉注射2.5mg/kg的恩诺沙星后的血药浓度。蒋智钢等研究表明,利用PBPK模型以药物在一种动物体内的药动学数据为基础推测其在另一种动物体内药动学数据的近似值是可行的。罗显阳等[16]也进行了类似的研究,将磺胺二甲嘧啶在猪体内的PBPK模型外推到绵羊,预测了药物在绵羊体内的动力学过程。罗显阳[12]还曾建立了一个肌内注射给药途径下泰拉霉素在家兔体内的PBPK模型,并利用该PBPK模型计算得到了泰拉霉素在家兔体内的药动学参数。

表2 单次灌胃给药(15mg/kg)后氟甲喹在家兔体内的药动学参数Table 2 Pharmacokinetics parameters of flumequine in rabbits after single oral administration at 15mg/kg
组织-血浆分配系数(P)是PBPK模型中一类重要参数,其大小决定着药物在各组织中的分布情况。该参数可通过体内或体外试验法获得。体内试验法又分为两种,即稳态浓度法和面积法。稳态浓度法是采取多次给药或单次持续恒速静脉输注给药的方式使动物血药浓度达到稳态,待稳态以后对动物进行剖杀,采集血浆及各组织,进行药物浓度测定,然后以组织中的药物浓度比血浆中的药物浓度来计算各组织中药物的P值。面积法一般是对动物单次给药后,在不同时间点剖杀动物,采集各组织及血浆,进行药物浓度测定,然后经药动学分析得到血浆及各组织中的药时曲线下面积(AUC),之后以组织中药物的AUC值比血浆中药物的AUC值,获得各组织中药物的P值。体外试验法则主要是利用油-水分配系数来粗略估算P值,其结果准确性偏低。除以上试验方法外,也常采用参数优化的方法来估算P值。在本研究中,通过该法获得的FLU在家兔各组织中的P值,大小为肾脏(21.14)>肝脏(5.64)>肺(1.02)>肌肉(0.35)>脂肪(0.19)。这一结果表明FLU在肾脏中分布最多,在脂肪中分布最少,这与Villa R等[14]的报道一致。
本研究应用PBPK模型预测得到了FLU在家兔体内的药动学参数。由表2可见,灌胃给药后FLU吸收迅速(Ka为1.04h-1),分布广泛(V/F为41.30L/kg),消除迅速(t1/2β为3.14h)。这一结果与牛[7]、鸽子[8]和猪[9]等动物体内的报道结果一致。FLU属于浓度依赖性药物,其杀菌效果与AUC/MIC的比值有关。如果该数值大于125h[17],就能够有效清除感染的革兰阴性菌;而对于革兰阳性菌而言,该数值大于30h就能够将其有效清除[18]。因此如果家兔所感染的革兰阴性菌的MIC值小于12μg/L或所感染的革兰阳性菌的 MIC值小于50μg/L的话,单次灌胃FLU(15mg/kg)即能有效治疗感染,如果MIC值高于这两个数值,则需要采用多次给药-首次倍量的方法来提高疗效,即连续2次给药,首次给药剂量提高到30mg/kg。
本研究结果表明,应用PBPK模型能够精确模拟FLU单次灌胃后在家兔各组织中的浓度,并能够准确计算FLU在家兔体内的药动学参数。本研究结果可为家兔临床生产中FLU的合理使用提供依据。
[1]李 璐,刘 菲,陈鸿汉,等.高效液相色谱法同时测定水体中的环丙沙星和氟甲喹[J].色谱,2013,31(6):567-571.
[2]Ferraresi C,Lucatello L,Meucci V,et al.Pharmacokinetic/pharmacodynamic evaluation of the efficacy of flumequine in treating colibacillosis in turkeys[J].Poult Sci,2013,92(12):3158-3165.
[3]张海琪,何 欣,钱鸣蓉,等.氟甲喹在中华鳖日本品系组织中的残留代谢规律研究[J].西南大学学报:自然科学版,2013,35(9):35-42.
[4]Kuroda K,Kijima A,Ishii Y,et al.Flumequine enhances the in vivo mutagenicity of MeIQx in the mouse liver[J].Arch Toxicol,2013,87(8):1609-1619.
[5]Cornejo J,Lapierre L,Iragueen D,et al.Study of enrofloxacin and flumequine residues depletion in eggs of laying hens after oral administration[J].J Vet Pharmacol Therap,2012,35(1):67-72.
[6]Cornejo J,Lapierre L,Iragueen D,et al.Depletion study of three formulations of flumequine in edible tissues and drug transfer into chicken feathers[J].J Vet Pharmacol Therap,2012,34(2):168-175.
[7]Meijer B A,Ceyssens K G,de Jong W T,et al.Bioavailability of flumequine after semisimultaneous administration to veal calves[J].Pharmac Res,1994,11(1):117-121.
[8]Dorrestein G M,Van Gogh H,Buitelaar M N,et al.Clinical pharmacology and pharmacokinetics of flumequine after intravenous,intramuscular and oral administration in pigeons(Columba livia)[J].J Vet Pharmacol Therap,1983,6(4):281-292.
[9]Villa R,Cagnardi P,Acocella F,et al.Pharmacodynamics and pharmacokinetics of flumequine in pigs after single intravenous and intramuscular administration[J].Vet J,2005,170(1):101-107.
[10]丁焕中,曾振灵.生理药动学模型及其在兽医药理学研究中的应用[J].动物医学进展,2007,28(9):55-59.
[11]蒋智钢,高 海,刘开永,等.生理药动学模型预测绵羊静脉注射恩诺沙星后的血药浓度[J].中国兽医杂志,2013,49(8):77-80.
[12]罗显阳.泰拉霉素在兔体内的药动学预测[J].广东畜牧兽医科技,2013,38(5):32-35.
[13]Davies B,Morris T.Physiological parameters in laboratory animals and humans[J].Pharmac Res,1993,10(7):1093-1095.
[14]Villa R,Cagnardi P,Bacchetta S,et al.Tissue distribution and residue depletion of flumequine in the rabbit[J].World Rabbit Sci,2003,11(1):87-100.
[15]Mevius D J,Breukink H J,Guelen P J,et al.Pharmacokinetics,metabolism and renal clearance of flumequine in veal calves[J].J Vet Pharmacol Therap,1990,13(2):159-169.
[16]罗显阳,远立国.磺胺二甲嘧啶生理药动学模型种间类推的应用[J].中国畜牧兽医,2010,37(3):194-197.
[17]杨 帆,刘志昌,丁焕中,等.蒙特卡罗模拟法在抗微生物药物药动学和药效学研究中的应用[J].动物医学进展,2009,30(7):83-87.
[18]丁焕中,陈杖榴.群体药动学及其在兽药监测和评价中的潜在应用[J].动物医学进展,2001,22(1):75-78.

